银屑病关节炎合并类风湿关节炎的临床特征及文献回顾
2023-11-24陈源张晓慧宋志博张卓莉
陈源,张晓慧,宋志博,张卓莉
作者单位:100034 北京,北京大学第一医院风湿免疫科
银屑病关节炎(psoriatic arthritis,PsA)和类风湿关节炎(rheumatoid arthritis,RA)均为临床常见的慢性关节炎性疾病,两者在发病机制、临床表现、影像学特征及治疗药物选择上既有相似之处,又有各自鲜明的特征。一直以来PsA被归类为血清学阴性脊柱关节炎,然而部分PsA患者血清中可出现类风湿因子(rheumatoid factor,RF)和(或)抗瓜氨酸化肽/蛋白抗体(anti-citrullinated protein antibodies,ACPA)阳性,近年来有流行病学研究报道PsA与RA可合并存在,但是相关病例报道很少。本研究回顾性分析本院PsA队列中5例PsA患者的资料,并通过国内外文献复习,结合4例已报道病例进行汇总分析,以提高临床医生对此类重叠疾病人群的认识。
1 资料与方法
1.1 研究对象
本研究共纳入9例患者,其中5例来自北京大学第一医院银屑病关节炎(Peking University First Hospital PsA,PKUFHP)队列,4例来自既往文献报道。
PKUFHP队列由北京大学第一医院风湿免疫科于2008年建立,是基于诊断明确PsA患者的纵向观察性队列。在此队列中,疾病活动患者每1~3个月随访一次,病情稳定患者每3~6个月随访一次,所有患者有详细的病历记录,包括临床、实验室、影像学评估以及具体治疗方案。
截止2023年3月1日,本队列共有453例PsA患者,其中完善自身抗体检查的315例患者中36例(11.4%)RF和/或ACPA阳性,最终5例患者在经验丰富的风湿科医生讨论后,判断为PsA与RA独立诊断,两者合并存在,他们均同时满足PsA分类标准(Classification Criteria for Psoriatic Arthritis,CASPAR)[1]及2010年美国风湿病学会/欧洲抗风湿病联盟RA分类标准[2]。
以“银屑病关节炎”、“关节型银屑病”、“牛皮癣关节炎”及“类风湿关节炎”为关键词在知网检索到病例报道共2篇,以“Psoriatic Arthritis”及“Rheumatoid Arthritis”为关键词在PubMed上检索到病例报道共3篇。一共5例患者,纳入其中有完整病史资料者共4例[3-6]。
1.2 数据收集
采集患者的一般资料、临床表现、实验室检测结果、疾病活动度、肌肉骨骼超声、治疗用药、转归。一般资料包括性别、年龄、银屑病皮损及关节症状出现的时间。临床表现包括压痛或肿胀关节部位及数量、银屑病皮损、甲病、指趾炎、附着点炎、眼炎、炎症性肠病、类风湿结节等。实验室检测结果包括RF、ACPA、人类白细胞抗原-B27(human leukocyte antigen-B27,HLA-B27)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、C反应蛋白(C-reactive protein,CRP)。肌肉骨骼超声检查包括双手腕、足踝关节以及其他有症状的关节,在入组时所有患者进行附着点筛查,包括双侧肱骨内/外上髁、鹰嘴粗隆、髌骨上/下缘、胫骨粗隆、跟腱、跖筋膜处肌腱或韧带附着点。超声病变判定均依据风湿病预后评估组织(Outcome Measures in Rheumatology,OMERACT)的定义[7]。
对所有患者采用银屑病关节炎疾病活动指数(Disease Activity Index for Psoriatic Arthritis,DAPSA)评分、应用C反应蛋白基于28关节计数的疾病活动度评分(Disease Activity Score of 28 joints-CRP,DAS28-CRP)以及应用血沉基于28关节计数的疾病活动度评分(Disease Activity Score of 28 joints-ESR,DAS28-ESR)。
2 结果
2.1 本中心5例患者临床资料
2.1.1 一般情况:5例PsA合并RA患者中3例为女性,中位年龄54岁(36~63岁)。所有患者均有外周关节受累并存在附着点炎,但均无指(趾)炎,仅1例有骶髂关节受累。所有患者均以银屑病皮损为首发表现,皮疹至出现关节症状间隔9~36年不等,2例有银屑病家族史。4例存在甲病。5例患者均无眼炎、炎症性肠病、类风湿结节等关节外表现。所有患者RF及ACPA双阳性,且ACPA均为高滴度阳性,4例RF高滴度阳性。行HLA-B27检测的4例患者均为阴性,包括骶髂关节受累病例(表1)。

表1 5例PsA合并RA患者一般情况和临床表现Table 1 Demographic and clinical characteristics of 5 cases with coexisting PsA and RA
2.1.2 关节表现及实验室资料:5例患者均主要表现为对称性多关节炎,大小关节均有受累,其中对称性手关节炎见于所有患者,包括远端指间关节(distal interphalangeal joints,DIP joints)、近端指间关节(proximal interphalangeal joints,PIP joints)、掌指关节(metacarpophalangeal joints,MCP joints);至少有一个下肢大关节(髋、膝或踝关节)受累,仅1例患者有中轴受累(表2)。
首次就诊时,所有患者均处于疾病活动状态,3例患者ESR及CRP升高。依据DAPSA或DAS28-ESR评分,1例为高疾病活动度,4例为中等疾病活动度;依据DAS28-CRP评分,1例为高疾病活动度,3例为中等疾病活动度,1例为低疾病活动度(表2)。
2.1.3 影像学所见:所有患者均完成了手足关节超声及X线检查。超声检查示5例患者均有滑膜炎表现,同时均存在超声下附着点炎,其中单纯急性附着点炎1例,单纯慢性附着点病变1例,急慢性附着点病变3例;5例患者中3例可见骨侵蚀,2例有肌腱炎或腱鞘炎表现。X线检查示5例患者均存在不同程度关节间隙狭窄,其中1例患者可见骨侵蚀(图1)。

图1 病例3手部超声及X线影像Fig 1 Ultrasound images and radiograph of the hand of case No.3A.左第5远端指间关节急性附着点炎,可见伸肌腱末端附着点处增厚、回声减低,伴多普勒血流信号;B. 右腕关节滑膜炎,可见桡腕关节及腕骨间关节滑膜增生伴多普勒血流信号(GS1-2级,PD2级);C. 右手X线,右手第2、3指远端指间关节见骨侵蚀(黄色箭头)及骨质增生(白色箭头),周围软组织肿胀,第2、3指远端指间关节及第3、4近端指间关节间隙变窄
2.1.4 治疗与转归:所有患者起始治疗均采用传统合成的改善病情抗风湿药(conventional synthetic disease-modifying anti-rheumatic drugs,csDMARDs),包括甲氨蝶呤、来氟米特、柳氮磺吡啶等。其中2例患者分别在甲氨蝶呤单药、甲氨蝶呤联合来氟米特治疗后达到低疾病活动度/临床缓解;另外2例患者因csDMARDs疗效不佳,联合靶向药物治疗;其中1例患者于初诊后应用csDMARDs治疗1月后达到低疾病活动度,后因自行停药导致疾病复发,再次csDMARDs联用无效,因此加用托法替布5 mg bid,疗效反应较好,2月余后DAS28-ESR达到缓解、DAPSA达到低疾病活动度;另1例患者非常难治,在8年随访期间先后用过阿达木单抗、依那西普、英夫利昔单抗及托法替布等多种靶向药物,始终未能实现达标。1例患者在应用甲氨蝶呤单药治疗后未再就诊,转归情况不详。
2.2 既往文献及本中心9例PsA合并RA病例汇总分析
对既往文献报告4例PsA合并RA患者(表3)结合本中心5例患者的临床资料进行汇总分析。9例患者中男性5例,中位年龄62岁(36~74岁),病程为9个月至49年,其中6例以银屑病(psoriasis,PsO)起病的患者皮疹与关节症状的中位间隔时间为16年(5~36年),3例以关节症状起病者关节症状与皮疹的中位间隔时间为27年(6个月~39年)。7例患者在病程中曾单纯被诊断为RA或RA合并PsO。
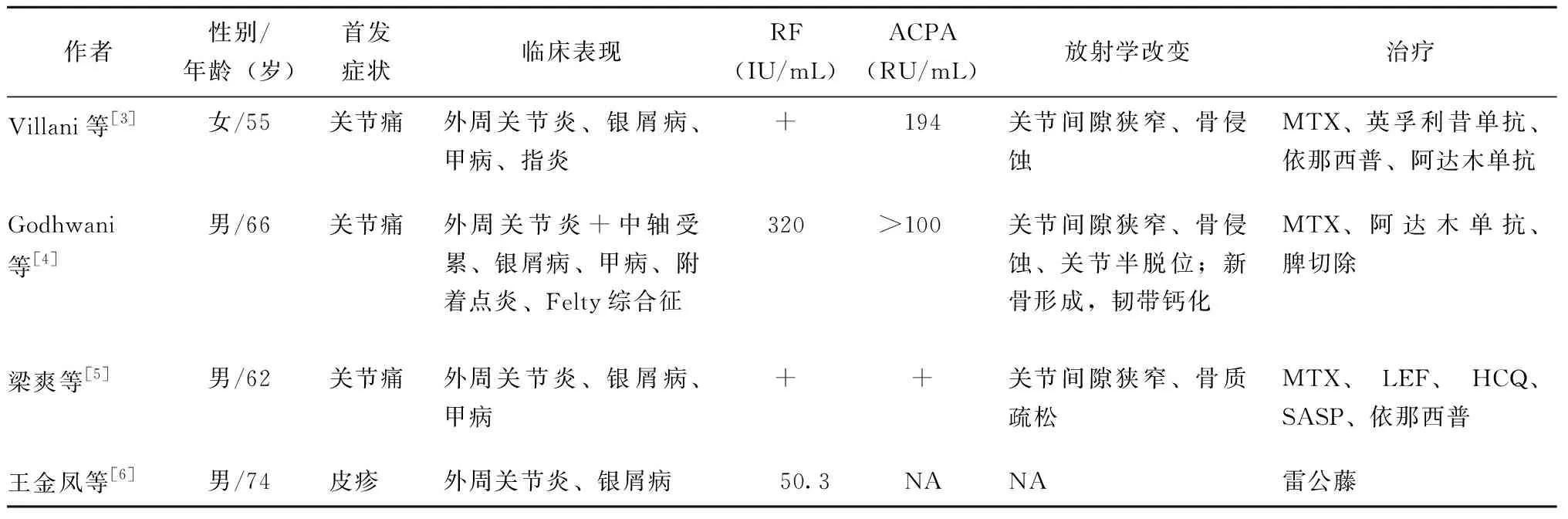
表3 既往文献4例PsA合并RA患者的临床特点和治疗Table 3 Clinical characteristics and treatments of 4 cases with coexisting PsA and RA in published reports
临床表现方面,9例患者均有外周多关节受累及PsA特征表现,其中所有患者均有银屑病皮损,7例有甲病,1例有指炎,2例同时有中轴受累。8例患者RF及ACPA双阳性,1例单纯RF阳性。8例曾行X线检查,可见关节间隙狭窄、骨质疏松或骨侵蚀表现,其中既往文献报道的66岁男性患者还有双手MCP关节尺侧偏等RA特有征象及髌骨与股骨及胫骨融合、跟腱及跖筋膜钙化、跖趾关节笔帽征等PsA特有征象(表3)。8例患者应用甲氨蝶呤治疗,2例患者联合了托法替布,4例患者联合肿瘤坏死因子拮抗剂,其中2例曾用过3种肿瘤坏死因子拮抗剂。
3 讨论
PsA和RA均是引起关节肿痛、畸形及功能障碍的临床常见风湿免疫性疾病。PsA的基本病理改变为附着点炎,临床表现具有异质性,外周及中轴关节均可受累,可表现为多关节炎型、寡关节炎型、远端指(趾)间关节炎型、残毁型关节炎、脊柱关节炎5种临床亚型[8],并可伴有银屑病、甲病、指趾炎、眼炎、炎症性肠病等;缺乏特异性血清学标志物;影像学可出现附着点炎、骨侵蚀、新骨形成、弥漫性皮下软组织炎症等特征性表现[9]。而RA以滑膜炎为基本病理改变,多表现为小关节对称性受累为主,部分患者可出现类风湿结节、肺间质病变、血管炎等关节外表现[10],82.4%患者RF及/或ACPA阳性[11];影像学表现以滑膜炎及骨侵蚀为主。
尽管PsA和RA病理基础不同、血清学表现差异很大,但是目前已有多个研究指出存在一类血清学阳性的PsA患者,PsA患者中约5.6%~35.0%血清学阳性,其中RF及ACPA双阳性为1.5%~10.7%[12-14]。既往研究中这类患者ACPA多呈高滴度,但有对比研究显示其抗体水平较单纯RA患者更低[15]。既往研究中,ACPA阳性多见于多关节炎型PsA患者[16-17],但寡关节炎型及中轴受累者也有ACPA阳性的报道[12]。ACPA阳性患者具有对称分布、手关节受累为主等RA的特点[18],较血清学阴性PsA患者更容易出现放射学骨侵蚀[12,15],但RF阳性与患者的临床及影像学表现未发现明确联系[12,19]。Alenius等[20]研究显示72.7%(8/11)ACPA阳性PsA患者满足1987年RA分类标准。目前,国内外尚无针对ACPA和/或RF阳性PsA患者与PsA合并RA患者的对比研究,两类患者之间的异同、部分血清学阳性患者可否进一步诊断为PsA合并RA,仍有待进一步研究。
近年来流行病学研究显示PsA与RA可合并存在,在PsA患者中RA患病率为3.16%~29.6%[21-22],但全球相关病例报道却很少,分析差异很大的可能原因:(1)既往流行病学研究大多根据医疗数据库中登记的诊断进行统计分析,部分以外周多关节炎为主要表现、RF和/或ACPA阳性的患者可能被不同的医生登记为不同性质的关节炎。(2)部分患者未经风湿科医生专业评估和随访即被诊断。台湾一项针对10 844例PsO或其相关疾病患者的研究,共111例(1.02%)仅基于患者主诉被同时诊断了RA,然而经过研究者回顾病历和电话/面诊,仅25例(0.23%)最终明确诊断为RA[23],在本中心所有PsA患者中仅1.1%合并RA。
本中心及既往病例报道中所有PsA合并RA患者均以外周关节受累为主,表现为对称性手关节炎,均呈血清学阳性,且ACPA均呈高滴度阳性,上述均符合RA的临床特点;但9例患者除PsO病史外,还具有甲病、指炎、附着点炎、DIP受累等PsA特征性病变,部分患者还有中轴受累,影像学同时有骨质疏松、骨侵蚀、新骨形成、附着点炎的征象,以上特点不能单纯用PsA解释,故诊断为两种关节炎并存。除上述共同点外,既往报道的病例及本中心病例也存在差异,既往病例主要以关节痛为首发表现,而本中心5例患者的首发表现均为银屑病皮损,在出现PsO数年甚至数十年后出现关节症状,可能是因为本研究是基于PsA队列进行的研究;另外,当已经明确诊断RA的患者在病程中出现PsO时促使医生完善查体及影像学检查以排除PsA可能,并最终得出PsA合并RA的诊断,但这同时说明PsA合并RA患者可能存在不同的亚型。此外,既往病例的放射影像学表现更严重,可见骨侵蚀、关节半脱位、新骨形成等表现,但本中心患者放射学表现更轻,其原因可能为本中心关节炎患者常规进行肌肉骨骼超声检查并将超声下病变改善情况纳入随访监测指标中,故诊断和治疗更及时。
肌肉骨骼超声在RA和PsA早期诊断与疾病活动度监测中具有重要价值。在临床上,RA和PsA均可出现手、足小关节受累。对于同时具有银屑病皮损及RF和(或)抗CCP抗体阳性的患者,超声有助于鉴别诊断。RA的典型超声下表现为滑膜炎及骨侵蚀,PsA的典型超声下表现为附着点炎及继发的骨侵蚀、骨质增生等表现。虽两者均可出现滑膜炎、关节腔积液、腱鞘炎等急性期改变,但RA和PsA的滑膜炎、腱鞘炎的好发部位有所不同。RA多出现PIP、MCP和腕关节滑膜炎[24],腱鞘炎多见于双手第2、3、4指屈肌腱和尺侧腕伸肌腱[25];PsA滑膜炎多继发于附着点炎,以DIP关节伸肌腱附着点炎所致的DIP关节滑膜炎最为典型,屈肌腱滑车增厚及MCP关节附近的伸肌腱鞘炎都是PsA较为特征性的改变[24,26-27]。此外,在PsA中还可发现肌腱、韧带、关节囊于骨表面附着点处增厚、回声不均匀(附着点炎)[28]及累及整根手指或足趾腱鞘、滑膜、软组织的弥漫性炎症表现(指趾炎)[29]等PsA特征性的滑膜外改变。此外,超声有助于发现亚临床炎症性病变。本中心既往研究显示:超声发现33%~52%达到临床缓解的RA患者存在亚临床滑膜炎[30];阿根廷一项研究同样发现处于临床缓解的RA患者中39%有超声下亚临床滑膜炎、23%存在超声下亚临床腱鞘-滑膜炎[31]。Chen等[32]对384例中重度PsO但无关节症状的患者进行超声筛查后发现16.1%的患者有附着点炎或附着点炎继发滑膜炎改变。肌肉骨骼超声对关节滑膜、附着点、腱鞘等软组织急性期炎症时的充血、水肿等改变较X线等更敏感,同时也较磁共振更加快捷、经济。通过超声对全身多处外周关节、肌腱及腱鞘进行全面的筛查可以明确局部结构的受累情况,在鉴别PsA和RA、识别PsA合并RA、准确判断PsA分型以及治疗疗效的监测中起到重要作用[33-34]。本中心5例患者均于初次就诊时发现超声下PIP、MCP或腕关节滑膜炎及DIP、肱骨内/外上髁、髌骨上/下缘、跟腱或跖筋膜处等附着点炎好发部位的急/慢性病变,这些病变均不能单纯用RA或PsA解释,最终诊断PsA合并RA。
PsA及RA均可造成不可逆转的关节畸形和功能丧失,需要尽早启动治疗。RA及PsA的治疗用药存在部分重叠,MTX是RA治疗的“锚定药物”,但是在PsA治疗中的疗效及作用存在争议[35-37]。目前两种疾病的治疗指南均推荐MTX为RA或表现为多关节炎PsA的一线用药[38-39],既往病例报道及本研究几乎所有患者均以MTX为初始用药。靶向药物方面,肿瘤坏死因子拮抗剂在治疗两种疾病中最常用,可抑制全身炎症反应,抑制RA关节局部的滑膜炎及骨质破坏,同时可以改善PsA的附着点炎、指趾炎、中轴受累及PsO皮损[40]。既往病例报道中3例及本中心1例患者均在关节炎症状加重或复发后使用了肿瘤坏死因子拮抗剂。此外,目前也有研究试图评价IL-17拮抗剂、IL-12/23拮抗剂等对PsA和RA的疗效是否相当[41-42]。另外,JAK抑制剂托法替布和乌帕替尼均已获批RA和PsA两个适应证。本研究所有患者初诊时均处于中-高疾病活动度,治疗过程中55.6%(5/9例)患者因疾病活动度未得到控制或加重起始了生物制剂或JAK抑制剂治疗,提示PsA合并RA患者较单纯PsA或RA患者可能更重。
PsA和RA的发病机制均未被完全阐明,与发病密切相关的遗传因素及发病过程中起主要作用的炎症因子也有很大差异,但两种疾病可能存在同样的效应阶段,即各种原因引起肿瘤坏死因子生成增多,进而介导炎症部位的巨噬细胞、中性粒细胞和成纤维细胞激活[43]。PsA合并RA是一种巧合还是一种重叠综合征的体现还有待更多研究解答。
本研究为回顾性研究,样本量较小,数据收集中存在不可控因素,可能对研究结果产生影响。但本研究是目前样本量最大的报道,表明PsA和RA可以合并存在,提示当临床上诊断RA合并PsO时,应该行肌骨超声检查筛查亚临床附着点炎等病变;PsA患者出现对称性多关节炎时,不能忽略RF和ACPA检查,血清学阳性且肌肉骨骼超声证实存在滑膜炎时,应考虑PsA合并RA的可能。既往研究已发现ACPA阳性的PsA患者更易出现骨侵蚀,且PsA合并RA患者还存在银屑病等关节外病变,提示PsA合并RA患者可能病变更重、更复杂,临床需要重视,应早期给予足够强度的治疗,确定全面的监测指标,制定准确的治疗目标,以期改善患者预后,减缓关节损毁和功能障碍的发生。