鸟苷酸结合蛋白家族在感染性疾病中调控炎症小体活化的研究进展
2023-11-24全舒婷焦伟伟徐放孙琳綦辉申阿东
全舒婷,焦伟伟,2,徐放,孙琳,2,綦辉,2,申阿东,2
综 述
鸟苷酸结合蛋白家族在感染性疾病中调控炎症小体活化的研究进展
全舒婷1,焦伟伟1,2,徐放3,2,孙琳1,2,綦辉1,2,申阿东1,2
1. 国家儿童医学中心,首都医科大学附属北京儿童医院,北京市儿科研究所,国家呼吸系统疾病临床医学研究中心,儿科学国家重点学科,儿科重大疾病研究教育部重点实验室,儿童呼吸道感染性疾病研究北京市重点实验室, 北京 100045 2. 首都医科大学附属北京儿童医院保定医院,保定市儿童感染性疾病精准诊治重点实验室,保定 071000 3. 国家儿童医学中心,首都医科大学附属北京儿童医院,北京市儿科研究所,儿科学国家重点学科,儿科重大疾病研究教育部重点实验室,出生缺陷遗传学研究北京市重点实验室,遗传与出生缺陷防治中心,北京 100045
鸟苷酸结合蛋白(guanylate-binding proteins,GBP)是一类干扰素诱导蛋白,在应对细菌、病毒、衣原体以及寄生虫等病原体感染时,其发挥的作用存在差异,并且影响感染性疾病的发展和结局。目前,研究者发现在细菌等病原体感染引发的细胞自主免疫中,GBP蛋白通过影响炎症小体的经典和非经典活化途径调控细胞焦亡。本文对GBP家族成员结构、进化特征以及炎症小体的经典和非经典活化途径进行了介绍,综述了GBP蛋白调控炎症小体活化的相关研究进展,归纳总结了GBP蛋白影响不同病原体感染的作用机制,以期为感染性疾病的发病机制和诊疗提供新的基础研究线索。
鸟苷酸结合蛋白;感染性疾病;炎症小体;炎症小体经典活化途径;炎症小体非经典活化途径
鸟苷酸结合蛋白(guanylate-binding proteins,GBP)家族是一类分子量在65~73 kDa的鸟苷三磷酸酶(guanosine 5′-triphosphatases,GTPases)家族,其表达受到I型干扰素(interferon,IFN) IFN-α和IFN-β以及II型干扰素IFN-γ的诱导[1]。GBP家族是动力蛋白GTPase超家族的成员之一,该超家族还包括:免疫相关GTPases亚家族(immunity-related GTPases,IRGs),超大GTPases家族(very large inducible GTPases,VLIGs)和抗黏液病毒蛋白亚家族(myxoma resistance proteins,MXs)等成员[2,3]。GBP家族成员种类以及编码基因的染色体位置在不同物种中存在差异,如人GBP蛋白有7种(hGBP1~hGBP7),编码基因位于1号染色体,而鼠GBP蛋白有11种(mGBP1~mGBP11),编码基因位于3号和5号这两条染色体上(图1A)[4]。GBP家族成员在多种免疫细胞内广泛分布,在单核巨噬细胞、T淋巴细胞、B淋巴细胞和NK细胞中多有表达[4,5]。GBP家族成员在宿主抵御细菌、病毒、衣原体以及寄生虫等不同病原体感染中发挥的作用及作用途径并不相同,但均能够影响感染性疾病的发展和结局[4,5]。其中,GBP家族成员在宿主抵御细菌等病原体感染的细胞自主免疫应答中,通过调控炎症小体活化而影响细胞焦亡,引起了研究者的广泛关注[6]。
除了经典的固有免疫应答和适应性免疫应答外,脊椎动物等多细胞动物还利用细胞内的防御系统来识别胞内病原体,限制病原体的复制,甚至以细胞自主的方式杀死病原体。以上这些细胞自卫反应被称为细胞自主免疫应答,普遍存在于免疫细胞和非免疫细胞中,其反应的激活依赖于细胞对病原体的识别[7]。细胞通过模式识别受体(pattern recognition receptor,PRR)识别病原体相关分子模式(pathogen- associated molecular patterns,PAMP),激活信号转导,分泌多种促炎细胞因子,可直接杀伤病原体、增强其他固有免疫细胞杀死病原体,同时通过抗原提呈活化适应性免疫应答细胞[7]。在细胞自主免疫中,IFN诱导产生大量GBP家族蛋白,参与了宿主细胞内囊泡转运、自噬、蛋白翻译后修饰以及炎症小体活化等生命活动[1]。其中,GBP家族成员可以通过促进炎症小体经典和非经典途径的活化,使促炎细胞因子IL-1β和IL-18等释放到胞外,并引起依赖半胱氨酸蛋白酶-1 (cysteine aspartic acid specific protease-1,caspase-1)和(或)caspase-11/4/5的程序性细胞死亡,即细胞焦亡[8],阻止病原体在宿主体内的扩散。近年来,GBP家族成员在激活炎症小体促进细胞焦亡方面的作用引发了越来越多学者的关注。本文将对GBP家族成员结构、进化特征、炎症小体的经典和非经典活化途径以及GBP家族调控炎症小体活化等方面的研究进展展开综述。
1 GBP家族的蛋白结构
人和鼠的GBP蛋白结构相似,主要包括三个部分:N端的球状GTPase结合域(也称LG结构域)、中间结构域和C端α螺旋GTPase效应域[9](图 1B)。GBP蛋白能够与鸟嘌呤三核苷酸磷酸(guanosine triphosphate,GTP)结合,并在两者结合后,GBP蛋白会表现出很高的GTPase和鸟苷二磷酸酶(guanosine 5′-diphosphatase,GDPase)活性(催化速率常数约为80~150/min)[10,11]。与鸟苷二磷酸(guanosine diphosphate,GDP)结合的hGBP5能够形成封闭的面对面二聚体结构,这种封闭构象对于hGBP5抗人类免疫缺陷病毒I型(human immunodeficiency virus type I,HIV-1)的活性至关重要[12]。此外,GBP蛋白的N端GTPase结构域能够与核苷酸结合寡聚化结构域样受体蛋白3 (nucleotide oligomerization domain(NOD)- like receptor protein 3,NLRP3)炎症小体中的半胱氨酸激活和募集结构域(caspase activation and recruitment domain,CARD)结合,促进NLRP3炎症小体组装并激活下游信号通路[13]。
GBP蛋白与微生物表面、病原体液泡和内溶酶体膜的物理结合依赖于C末端结构域内的异戊烯化修饰,即异戊二烯类脂质对蛋白质的翻译后修饰,可促进蛋白质与生物膜的锚定以及脂化的蛋白结合其他蛋白[14~16]。法尼酰基转移酶和二牛龙牛氨基转移酶I为两种不同的异戊烯化转移酶,两者可以催化含有CaaX结构(“C”表示半胱氨酸,“a”表示脂肪族氨基酸,“X”表示任何氨基酸)的蛋白质,促进该蛋白与膜的结合。例如:人GBP1、GBP2和GBP5在C端具有CaaX结构,研究证明GBP1、GBP2和GBP5在体内发生了异戊烯化修饰,且这一过程对于三种蛋白进行膜结合是必须的[17]。GBP1与脂质膜的相互作用是复杂的过程,不仅由于这个过程依赖于GTP介导的异戊烯化修饰,还由于GBP1自体组装和膜结合状态之间的竞争关系[18]。与GDP或GMP结合的GBP1不能与脂质膜结合,只有与GTP结合时才出现与脂质膜的相互作用[19]。

图1 人和小鼠的GBP家族成员与人GBP1蛋白的结构图
A:人和小鼠的GBP家族成员;B:人GBP1蛋白的结构图。根据文献[16,20~22]修改绘制。
2 GBP家族的进化特征
GBP家族为多基因家族,其进化模式符合“生与灭(birth-and-death)”进化模式,即通过拷贝产生新的基因,一些重复的基因在基因组中保持了很长时间,而另一些基因由于有害突变而被删除或失去功能[23]。例如,基因似乎只通过基因复制出现在猿类中,并获得了调控caspase-4活化的新功能[24]。而基因似乎只存在于灵长类动物中,并且其可能源自基因复制[25]。此外,和基因在旧世界猴基因组中缺失,而同源基因的缺乏可以解释这些灵长类动物对HIV-2的易感性,因为GBP5具有抑制HIV-2感染的作用[16,25]。
Li等[26]采用生物信息学的手段验证GBP家族编码基因在不同物种间的基因序列和基因保守性分析。结果显示,在四足动物中发现了3~12个功能性GBP家族编码基因和1~7个假基因,在斑马鱼()中发现了12个成员(包括4个假基因),而在河鲀()中未发现GBP家族编码基因的同源基因。在新真骨鱼类(Neoteleostei)中,研究者在青鳉()和刺鱼()的基因组中也观察到GBP基因的丢失。尽管如此,来自同一物种的GBP基因在其基因组结构上表现出高度的保守性,并且GBP家族编码基因结构在不同的脊椎动物谱系中也表现出一定的相似性,特别是编码GTP结合域的区域[26]。因此,GBP家族的进化过程是复杂和动态的,研究GBP家族的进化过程也将为研究其成员功能提供重要线索。
3 GBP家族在病原体感染细胞的过程中促进炎症小体活化
目前,已有研究描述了GBP家族在不同病原体感染过程中,参与了炎症小体的激活和细胞焦亡(表1)。
3.1 炎症小体的活化途径
炎症小体是一种由细胞内的PRRs参与组装而成的多蛋白复合物,在宿主抵御感染、维护免疫稳态中具有重要地位。炎症小体主要由三部分构成:传感器、接头蛋白和效应器。传感器主要是胞浆PPRs,例如核苷酸结合寡聚化结构域样受体(nucleotide oligomerization domain (NOD)-like receptors,NLRs)家族的部分成员(如NLRPl、NLRP2、NLRP3等)和细胞质DNA传感器黑色素瘤缺乏因子2 (absent in melanoma 2,AIM2)等;接头蛋白为凋亡相关点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC又称为PYCARD);而效应器为caspase-1[27,28]。ASC的N端与传感器相连接,C端具有CARD结构域,可与效应器caspase-1相连接[29]。本文将以近期研究热点——NLRP3炎症小体为例,对炎症小体活化的途径进行阐述(图2)。
目前,研究者认为NLRP3炎症小体活化需要两个阶段:(1)启动阶段:由细胞因子(例如I型IFN)或PAMPs的激活所提供,PAMPs和PRRs (例如Toll样受体(Toll-like receptors,TLR))之间的相互作用通过激活含TIR结构域的衔接分子1 (TIR domain containing adaptor molecule 1,TICAM1,TRIF)、诱导核因子κB (nuclear factor kappa-B,NF-κB)和干扰素调节因子3 (interferon regulatory factor 3,IRF3)信号传导途径级联放大,导致NLRP3、caspase-1前体、caspase-11以及I型IFN等表达增多,这是随后NLRP3炎症小体激活所必需的。产生的I型IFN以自分泌方式与胞外受体结合,并上调caspase-11和GBP蛋白的表达;(2)激活阶段:此阶段分为经典途径和非经典途径。
在经典途径中,PAMPs或损伤相关分子模式(damage-associated molecular patterns,DAMPs)中的任何一种作为刺激信号(如微粒和ATP)通过激活信号通路,导致K+外排、Ca2+内流和溶酶体破坏等过程并激活NLRP3,以及促进NLRP3炎症小体的组装和和活化[30]。NLRP3炎症小体活化后,caspase-1前体在大(p20)和小(p10)催化亚基之间的接头处通过自体蛋白水解切割,产生p33 (由CARD和p20组成)和p10。Caspase-1前体被切割后,成熟的caspase-1与ASC结合并且具有蛋白水解活性,水解IL-1家族的促炎细胞因子(如IL-1β和IL-18)前体以及焦孔素D (gasdermin D,GSDMD)前体,引起IL-1β和IL-18分泌以及细胞焦亡的发生[31]。
在非经典途径中,革兰氏阴性菌的LPS通过细胞内吞作用直接进入胞内[32],通过脂质A与小鼠caspase-11 (人caspase-4/5)的CARD结构域相互作用[33,34],激活caspase-11,导致GSDMD前体水解以及细胞焦亡。同时,活化的caspase-11还可以通过非经典途径促进NLRP3炎症小体活化,激活caspase-1,促进caspase-1下游的细胞因子分泌和细胞焦亡[35]。
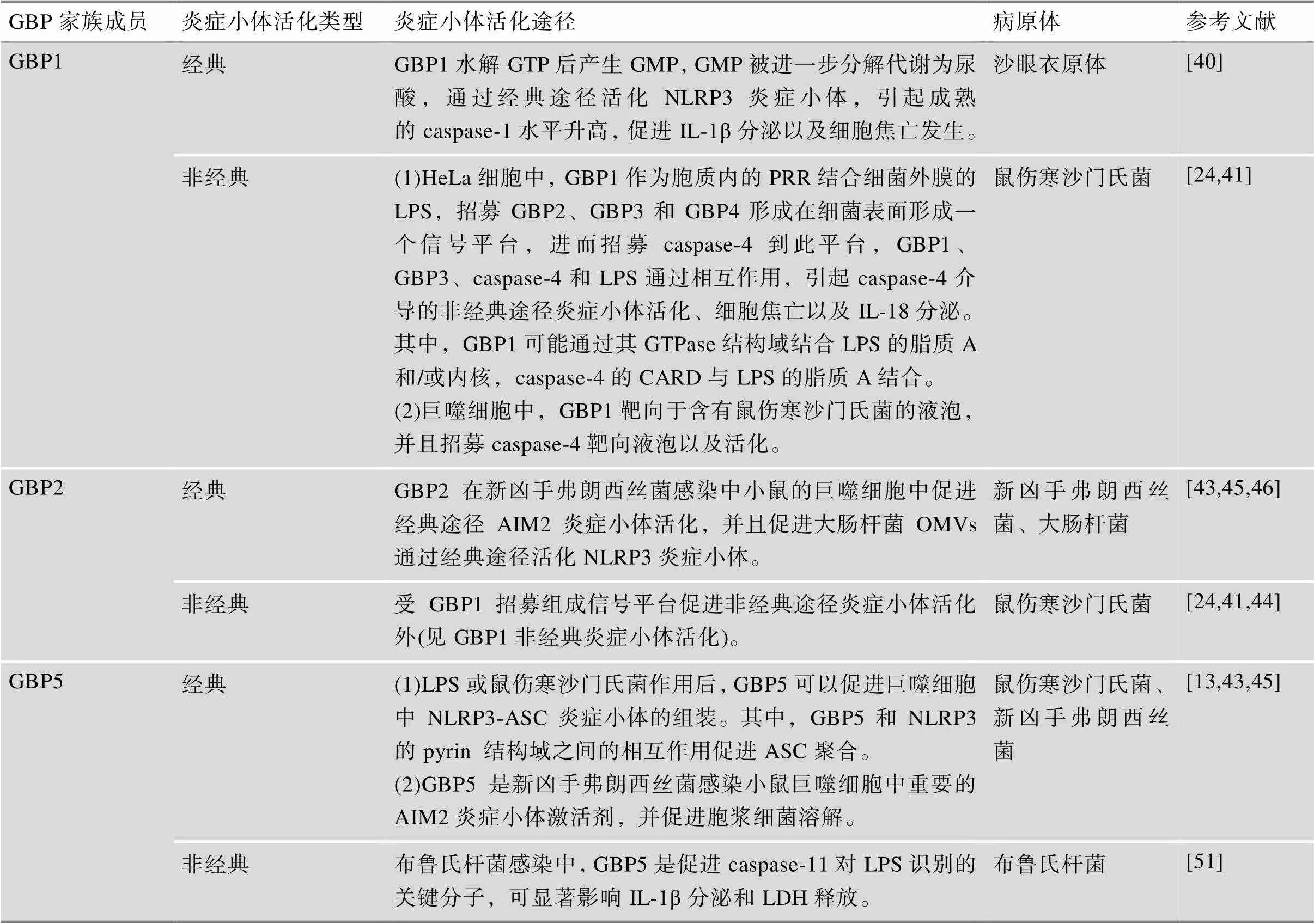
表1 GBP家族成员在炎症小体活化中的作用
尽管经典和非经典炎症小体活化途径在PRRs类型、激活配体和炎症小体分子结构上存在差异,但它们共享下游的信号通路。炎症小体活化后,可诱导细胞焦亡,caspase-11和caspase-1活性体能够促进焦亡过程中关键执行蛋白GSDMD的激活和N端裂解释放。GSDMD的N端能够在细胞膜上打孔并形成孔道,改变渗透压,促进水分内流,引起细胞肿胀和细胞膜破裂,使促炎性细胞因子IL-1β和IL-18释放到胞外[36,37]。
3.2 GBP1
GBP1是GBP家族中第一个被发现的成员,分子量大小约为65 kDa,在巨噬细胞、内皮细胞和上皮细胞中高表达。GBP1已被报道与单核细胞增生李斯特菌()、卡介苗(Bacille Calmette-Guérin,BCG)和弓形虫()感染性疾病相关[38,39]。越来越多的研究证实GBP1在宿主抵御病原体感染中促进了炎症小体经典和非经典途径的活化。
3.2.1 GBP1促进经典途径炎症小体活化
GBP1具有GTP水解酶活性,可以通过两个连续的水解步骤将GTP水解为GMP。Xavier等[40]在对沙眼衣原体()的研究中发现:GBP1水解GTP后产生GMP,GMP被进一步分解代谢为尿酸,通过经典途径活化NLRP3炎症小体,引起成熟的caspase-1水平升高,促进IL-1β分泌以及细胞焦亡的发生。为了探索GMP的生成对于活化NLRP3炎症小体的必要性,研究者还构建了GBP1的G68A突变体(仅能水解GTP产生GDP,不能产生GMP),发现GBP1突变后NLRP3炎症小体的活化显著下降,从而证明了GBP1水解GTP产生GMP是沙眼衣原体感染巨噬细胞过程中NLRP3炎症小体活化的必要条件(图3A)。

图2 NLRP3炎症小体活化途径
启动阶段(左侧):PAMP或IFN作用于细胞后,通过激活TRIF诱导 NF-κB和IRF3信号转导途径级联放大以及激活干扰素信号通路,导致炎症小体相关基因,如:NLRP3、caspase-1前体和caspase-11前体以及I型干扰素的表达水平上调。激活阶段(右侧):(1) 经典NLRP3炎症小体活化的过程:PAMPs、DAMPs、微粒、晶体和ATP等NLRP3活化胞外信号以及K+外排、Ca2+内流、溶酶体破坏、线粒体活性氧的产生、氧化线粒体DNA释放以及CL-外排等NLRP3活化胞内信号介导的经典NLRP3炎症小体活化过程;(2) 非经典NLRP3炎症小体活化的过程:LPS被caspase-11/4/5前体蛋白识别后,导致caspase-11/4/5活化,而且caspase-11/4/5可以通过非经典途径活化NLRP3炎症小体。经典和非经典的NLRP3炎症小体通路激活后,都可以活化caspase-1,诱导IL-1β和IL-18的分泌以及切割GSDMD诱导细胞焦亡。根据文献[30]修改绘制。
3.2.2 GBP1促进非经典途径炎症小体活化
在众多GBP家族成员中,研究者认为GBP1在非经典途径活化炎症小体中发挥了关键作用。2020年,Wandel等[24]以及Santos等[41]在HeLa细胞中的研究分别指出:GBP1作为胞质内的PRR结合鼠伤寒沙门氏菌()外膜的LPS,招募GBP2、GBP3和GBP4在细菌表面形成一个信号平台,进而招募caspase-4到此平台,GBP1、GBP3、caspase-4和LPS通过相互作用,引起caspase-4介导的非经典途径炎症小体活化、细胞焦亡以及IL-18分泌。其中,GBP1可能通过其GTPase结构域结合LPS的脂质A和/或内核,caspase-4的CARD与LPS的脂质A结合。以上研究均指出GBP1是第一个覆盖鼠伤寒沙门氏菌表面的GBP,并导致GBP2、GBP3和GBP4的募集。因此,GBP1是引起革兰氏阴性菌非经典途径炎症小体活化的关键分子(图3B)。
3.3 GBP2
GBP2分子量约为67 kDa,高表达于单核细胞、淋巴细胞、NK细胞等多种免疫细胞中。GBP2已被报道与弓形虫、单核细胞增生李斯特菌、新凶手弗朗西斯菌()等感染性疾病相关[42,43]。在促进炎症小体活化的研究中,GBP2除了上述提到的在鼠伤寒沙门氏菌感染中受GBP1招募组成信号平台进而促进非经典途径炎症小体活化外[24,41,44],Meunier等[43]和Man等[45]的研究都表明GBP2在小鼠的巨噬细胞中可以促进经典途径AIM2炎症小体活化,该基因敲除后AIM2炎症小体活性明显受到抑制,IL-1β、IL-18和LDH水平显著降低,小鼠抵御感染的能力明显下降。除此之外,Yang等[46]采用大肠杆菌()外膜囊泡(outer membrane vesicles,OMVs)感染小鼠巨噬细胞,发现敲除后,细胞caspase-1的活化和IL-1β的分泌显著下降,提示GBP2促进了大肠杆菌OMVs通过经典途径活化炎症小体。
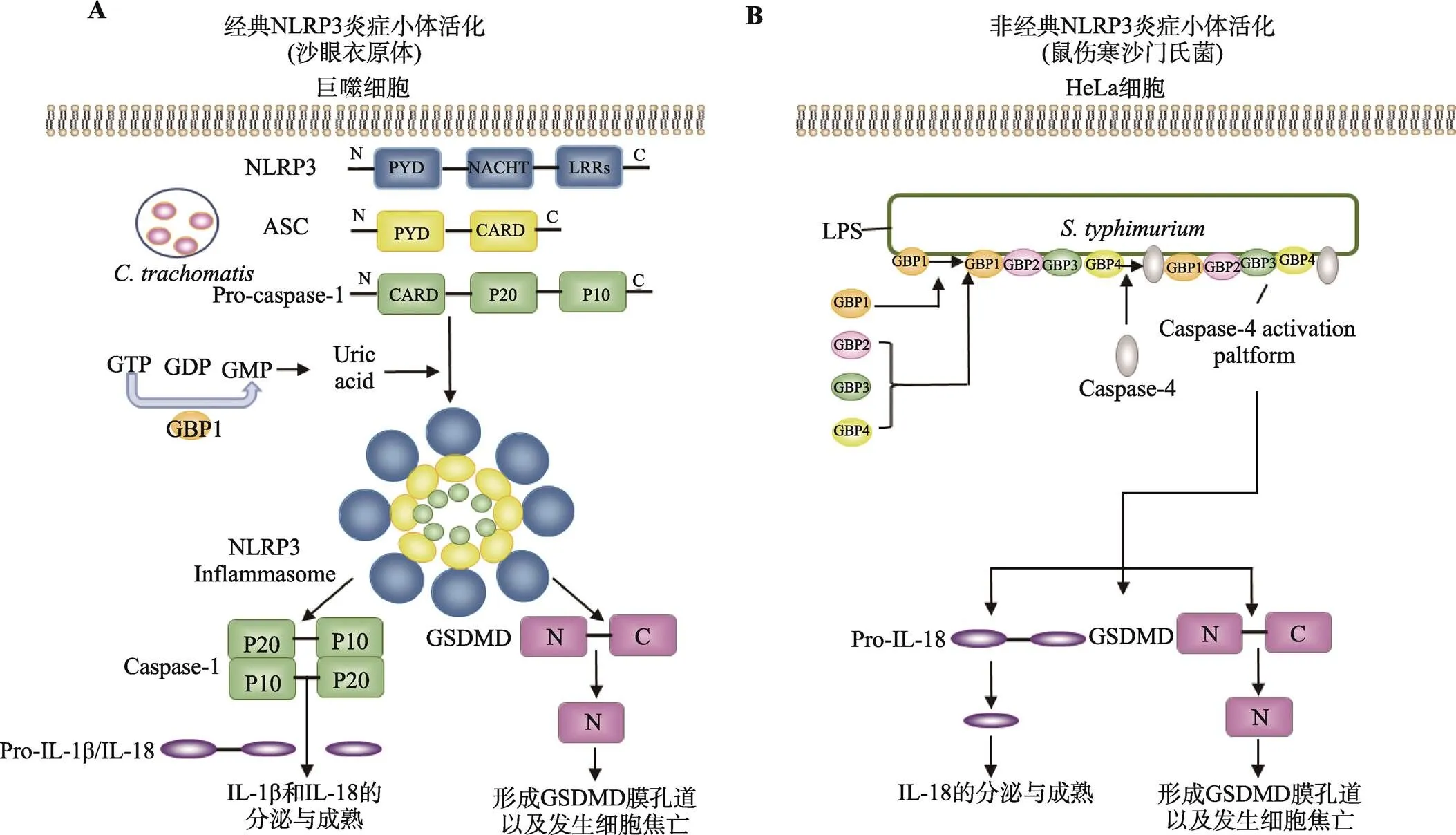
图3 GBP1通过经典和非经典途径活化炎症小体示意图
A:GBP1水解GTP后产生GMP,GMP被进一步分解代谢为尿酸,通过经典途径活化NLRP3炎症小体;B:GBP1识别鼠伤寒沙门氏菌表面LPS,招募GBP2、GBP3和GBP4,然后引起caspase-4介导的非经典途径炎症小体活化。根据文献[24,40,41]修改绘制。
3.4 GBP5
GBP5分子量约为66 kDa,高表达于单核细胞、巨噬细胞等单个核细胞。目前研究发现,GBP5在宿主抗病毒和细菌感染中发挥了重要作用,与HIV-1型病毒、弓形虫、单核细胞增生李斯特菌和鼠伤寒沙门氏菌等感染性疾病相关[5,13,47]。在结核病中,Sweeney等[48]通过转录组学分析发现,与健康人群、结核潜伏感染人群和其他肺部疾病人群相比,266个基因转录水平在结核病患者中差异显著,且由、(dual specificity phosphatase 3)和(Krüppel-like factor 2)基因组成的组合具有较好的结核病诊断效力。Costa等[49]和Satproedprai等[50]也发现基因的表达水平在结核病患者和其他患者之间存在显著差异。尽管如此,GBP5参与宿主抵抗结核分枝杆菌感染的具体机制尚不清楚。此外,多项研究指出GBP5在不同细菌感染中可以通过经典和非经典途径活化炎症小体。
3.4.1 GBP5促进经典途径炎症小体活化
Shenoy等[13]发现在LPS或鼠伤寒沙门氏菌等刺激下,GBP5可以促进巨噬细胞中NLRP3-ASC炎症小体的组装。其中,GBP5和NLRP3的pyrin结构域(pyrin domain,PYD)之间的相互作用促进ASC聚合,而基因敲除后小鼠的IL-1β、IL-18以及caspase-1水平显著下降。此外,Meunier等[43]发现GBP5是感染小鼠巨噬细胞中重要的AIM2炎症小体激活剂,并促进胞浆细菌溶解,而基因敲除小鼠在该菌感染后,AIM2炎症小体活性明显受到抑制,IL-1β、IL-18水平显著下降。Man等[45]在对于感染小鼠巨噬细胞的研究中,也得到了GBP5促进AIM2炎症小体活化的一致结果,并且发现:在野生型小鼠巨噬细胞中GBP5被募集并包裹,限制在胞内复制,促进细胞杀伤,而基因敲除小鼠以上功能均明显下降。
3.4.2 GBP5促进非经典途径炎症小体活化
Cerqueira等[51]在对布鲁氏杆菌()的研究中发现:位于小鼠3号染色体的GBP家族成员(GBP1、GBP2、GBP3、GBP5和GBP7)参与caspase-11对LPS的识别,促进后续的caspase-11和GSDMD介导的非经典途径炎症小体活化。在此基础上,他们通过siRNA敲低技术进一步确定了GBP5是上述家族成员中促进caspase-11对LPS识别的关键分子,可显著影响IL-1β的分泌和LDH的释放。
由此可见,当病原体入侵机体时,GBP家族在参与炎症小体激活和诱导细胞焦亡中发挥了重要的作用。
4 GBP家族在不同病原体感染过程中的调控作用
GBP家族在不同类型的病原体感染中通过多种调控机制影响疾病的发生和发展,现将主要的调控机制在表2中进行总结。
在细菌感染中,GBP家族主要通过调控炎症小体活化和细胞吞噬发挥作用:在嗜肺军团菌()、鼠伤寒沙门氏菌、福氏志贺菌()、新凶手弗朗西斯菌、单核细胞增生性李斯特单胞菌、布鲁氏杆菌等细菌入侵细胞后,GBP蛋白通过促进炎症小体活化,进而增强宿主的免疫应答;在BCG感染中,mGBP1和mGBP10,通过将吞噬细胞氧化酶或抗菌肽传递到含有BCG的吞噬体中,对胞内菌起到杀伤作用。
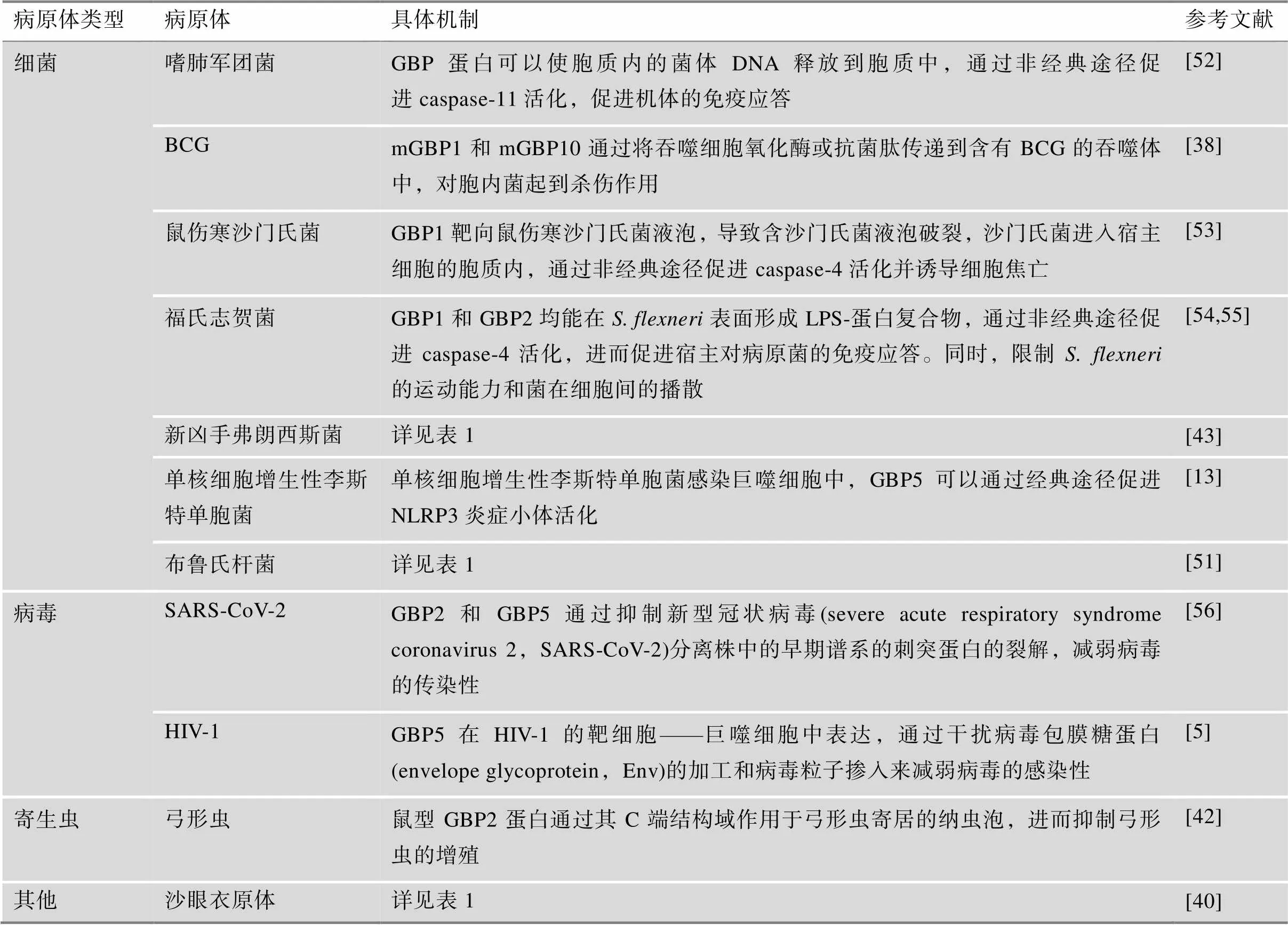
表2 GBP蛋白在不同病原体感染中的调控机制
在病毒感染中,GBP蛋白通过抑制SARS-CoV-2病毒刺突蛋白的裂解或者干扰HIV-1病毒Env的加工和病毒粒子掺入来减弱病毒的感染性。
在其他病原体感染中,例如弓形虫和沙眼衣原体感染中,GBP蛋白通过靶向弓形虫纳虫泡,抑制弓形虫增殖,或在沙眼衣原体感染细胞中通过经典途径活化NLRP3炎症小体引发感染细胞的焦亡。
由此可见,在不同类型的病原体感染中,GBP蛋白通过不同的途径在宿主细胞内发挥着抵抗病原体感染的作用。
5 结语与展望
GBP家族在病原体感染宿主后,通过经典和/或非经典途径激活炎症小体,进而在导致细胞焦亡的过程中发挥着重要作用。此外,GBP蛋白可以通过不同的作用途径抑制病原体增殖,如破坏吞噬体膜、将吞噬细胞氧化酶传递到含有病原体的液泡膜等。尽管如此,对GBP蛋白靶向含病原体的液泡膜的作用,以及GBP蛋白激活炎症小体具体机制的研究还存在许多尚未解决的问题。例如:调节GBP蛋白与膜结构相结合的具体机制是什么;除了干扰素诱导GBP蛋白表达,是否存在其他调节GBP蛋白的表达水平和活性的因素;不同类型的干扰素对GBP蛋白发挥作用是否具有不同的调节能力;影响GBP蛋白翻译后修饰的具体机制及翻译后修饰对GBP蛋白发挥功能起到的影响等。对这些问题的探讨将有助于深入了解GBP蛋白在宿主防御过程中的生物学功能。
[1] Kutsch M, Coers J. Human guanylate binding proteins: nanomachines orchestrating host defense., 2021, 288(20): 5826–5849.
[2] Macmicking JD. IFN-inducible GTPases and immunity to intracellular pathogens., 2004, 25(11): 601–609.
[3] Martens S, Howard J. The interferon-inducible GTPases., 2006, 22: 559–589.
[4] Man SM, Place DE, Kuriakose T, Kanneganti TD. Interferon-inducible guanylate-binding proteins at the interface of cell-autonomous immunity and inflammasome activation., 2017, 101(1): 143–150.
[5] Krapp C, Hotter D, Gawanbacht A, Mclaren PJ, Kluge SF, Stürzel CM, Mack K, Reith E, Engelhart S, Ciuffi A, Hornung V, Sauter D, Telenti A, Kirchhoff F. Guanylate binding protein (GBP) 5 is an interferon-inducible inhibitor of HIV-1 infectivity., 2016, 19(4): 504–514.
[6] Kim BH, Chee JD, Bradfield CJ, Park ES, Kumar P, Macmicking JD. Interferon-induced guanylate-binding proteins in inflammasome activation and host defense., 2016, 17(5): 481–489.
[7] Randow F, Macmicking JD, James LC. Cellular self-defense: how cell-autonomous immunity protects against pathogens., 2013, 340(6133): 701–706.
[8] Hagar JA, Powell DA, Aachoui Y, Ernst RK, Miao EA. Cytoplasmic LPS activates caspase-11: implications in TLR4-independent endotoxic shock., 2013, 341(6151): 1250–1253.
[9] Praefcke GJK. Regulation of innate immune functions by guanylate-binding proteins., 2018, 308(1): 237–245.
[10] Schwemmle M, Staeheli P. The interferon-induced 67-kDa guanylate-binding protein (hGBP1) is a GTPase that converts GTP to GMP., 1994, 269(15): 11299–11305.
[11] Ghosh A, Praefcke GJK, Renault L, Wittinghofer A, Herrmann C. How guanylate-binding proteins achieve assembly-stimulated processive cleavage of GTP to GMP., 2006, 440(7080): 101–104.
[12] Cui W, Braun E, Wang W, Tang JH, Zheng YY, Slater B, Li N, Chen C, Liu QX, Wang B, Li X, Duan YK, Xiao YJ, Ti RJ, Hotter D, Ji XY, Zhang L, Cui J, Xiong Y, Sauter D, Wang ZF, Kirchhoff F, Yang HT. Structural basis for GTP-induced dimerization and antiviral function of guanylate-binding proteins., 2021, 118(15): e2022269118.
[13] Shenoy AR, Wellington DA, Kumar P, Kassa H, Booth CJ, Cresswell P, Macmicking JD. GBP5 promotes NLRP3 inflammasome assembly and immunity in mammals., 2012, 336(6080): 481–485.
[14] Resh MD. Trafficking and signaling by fatty-acylated and prenylated proteins., 2006, 2(11): 584–590.
[15] Konstantinopoulos PA, Karamouzis MV, Papavassiliou AG. Post-translational modifications and regulation of the RAS superfamily of GTPases as anticancer targets., 2007, 6(7): 541–555.
[16] Tretina K, Park E S, Maminska A, Macmicking J D. Interferon-induced guanylate-binding proteins: guardians of host defense in health and disease., 2019, 216(3): 482–500.
[17] Britzen-Laurent N, Bauer M, Berton V, Fischer N, Syguda A, Reipschläger S, Naschberger E, Herrmann C, Stürzl M. Intracellular trafficking of guanylate-binding proteins is regulated by heterodimerization in a hierarchical manner., 2010, 5(12): e14246.
[18] Honkala AT, Tailor D, Malhotra SV. Guanylate-binding protein 1: an emerging target in inflammation and cancer., 2019, 10: 3139.
[19] Syguda A, Bauer M, Benscheid U, Ostler N, Naschberger E, Ince S, Sturzl M, Herrmann C. Tetramerization of human guanylate-binding protein 1 is mediated by coiled-coil formation of the C-terminal alpha-helices., 2012, 279(14): 2544–2554.
[20] Olszewski MA, Gray J, Vestal DJ. In silico genomic analysis of the human and murine guanylate-binding protein (GBP) gene clusters., 2006, 26(5): 328–352.
[21] Kresse A, Konermann C, Degrandi D, Beuter-Gunia C, Wuerthner J, Pfeffer K, Beer S. Analyses of murine GBP homology clusters based on in silico, in vitro and in vivo studies., 2008, 9: 158.
[22] EMBL-EBI. https://www.ebi.ac.uk/pdbe/pdbe-kb/proteins/ P32455/structures.
[23] Nei M, Gu X, Sitnikova T. Evolution by the birth- and-death process in multigene families of the vertebrate immune system., 1997, 94(15): 7799–7806.
[24] Wandel MP, Kim BH, Park ES, Boyle KB, Nayak K, Lagrange B, Herod A, Henry T, Zilbauer M, Rohde J, Macmicking JD, Randow F. Guanylate-binding proteins convert cytosolic bacteria into caspase-4 signaling platforms., 2020, 21(8): 880–891.
[25] Corte-Real J V, Baldauf H M, Abrantes J, Esteves P J. Evolution of the guanylate binding protein (GBP) genes: emergence of GBP7 genes in primates and further acquisition of a unique GBP3 gene in simians., 2021, 132: 79–81.
[26] Li G, Zhang JY, Sun Y, Wang H, Wang YQ. The evolutionarily dynamic IFN-inducible GTPase proteins play conserved immune functions in vertebrates and cephalochordates., 2009, 26(7): 1619–1630.
[27] Agostini L, Martinon F, Burns K, Mcdermott MF, Hawkins PN, Tschopp J. NALP3 forms an IL-1beta- processing inflammasome with increased activity in Muckle-Wells autoinflammatory disorder., 2004, 20(3): 319–325.
[28] Lugrin J, Martinon F. The AIM2 inflammasome: sensor of pathogens and cellular perturbations., 2018, 281(1): 99–114.
[29] Cai X, Chen JQ, Xu H, Liu SQ, Jiang QX, Halfmann R, Chen ZJJ. Prion-like polymerization underlies signal transduction in antiviral immune defense and inflammasome activation., 2014, 156(6): 1207–1222.
[30] Swanson KV, Deng M, Ting JPY. The NLRP3 inflammasome: molecular activation and regulation to therapeutics., 2019, 19(8): 477–489.
[31] Sharma D, Kanneganti TD. The cell biology of inflammasomes: mechanisms of inflammasome activation and regulation., 2016, 213(6): 617–629.
[32] Yi YS. Dual roles of the caspase-11 non-canonical inflammasome in inflammatory bowel disease., 2022, 108: 108739.
[33] Yi YS. Caspase-11 non-canonical inflammasome: a critical sensor of intracellular lipopolysaccharide in macrophage- mediated inflammatory responses., 2017, 152(2): 207–217.
[34] Shi JJ, Zhao Y, Wang YP, Gao WQ, Ding JJ, Li P, Hu LY, Shao F. Inflammatory caspases are innate immune receptors for intracellular LPS., 2014, 514(7521): 187–192.
[35] Yi YS. Functional crosstalk between non-canonical caspase-11 and canonical NLRP3 inflammasomes during infection-mediated inflammation., 2020, 159(2): 142–155.
[36] Kayagaki N, Stowe IB, Lee BL, O'Rourke K, Anderson K, Warming S, Cuellar T, Haley B, Roose-Girma M, Phung QT, Liu PS, Lill JR, Li H, Wu JS, Kummerfeld S, Zhang J, Lee WP, Snipas SJ, Salvesen GS, Morris LX, Fitzgerald L, Zhang YF, Bertram EM, Goodnow CC, Dixit VM. Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling., 2015, 526(7575): 666– 671.
[37] Shi JJ, Zhao Y, Wang K, Shi XY, Wang Y, Huang HW, Zhuang YH, Cai T, Wang FC, Shao F. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death., 2015, 526(7575): 660–665.
[38] Kim BH, Shenoy AR, Kumar P, Das R, Tiwari S, Macmicking J D. A family of IFN-gamma-inducible 65-kD GTPases protects against bacterial infection., 2011, 332(6030): 717–721.
[39] Selleck EM, Fentress SJ, Beatty WL, Degrandi D, Pfeffer K, Virgin HW 4th, Macmicking JD, Sibley LD. Guanylate-binding protein 1 (Gbp1) contributes to cell-autonomous immunity against Toxoplasma gondii., 2013, 9(4): e1003320.
[40] Xavier A, Al-Zeer MA, Meyer TF, Daumke O. hGBP1 coordinates Chlamydia restriction and inflammasome activation through sequential GTP hydrolysis., 2020, 31(7): 107667.
[41] Santos JC, Boucher D, Schneider LK, Demarco B, Dilucca M, Shkarina K, Heilig R, Chen KW, Lim RYH, Broz P. Human GBP1 binds LPS to initiate assembly of a caspase-4 activating platform on cytosolic bacteria., 2020, 11(1): 3276.
[42] Degrandi D, Kravets E, Konermann C, Beuter-Gunia C, Klümpers V, Lahme S, Rasch E, Mausberg AK, Beer- Hammer S, Pfeffer K. Murine guanylate binding protein 2 (mGBP2) controls Toxoplasma gondii replication., 2013, 110(1): 294–299.
[43] Meunier E, Wallet P, Dreier RF, Costanzo S, Anton L, Rühl S, Dussurgey S, Dick MS, Kistner A, Rigard M, Degrandi D, Pfeffer K, Yamamoto M, Henry T, Broz P. Guanylate-binding proteins promote activation of the AIM2 inflammasome during infection with Francisella novicida., 2015, 16(5): 476–484.
[44] Feng SY, Man SM. Captain GBP1: inflammasomes assemble, pyroptotic endgame., 2020, 21(8): 829–830.
[45] Man SM, Karki R, Malireddi RK, Neale G, Vogel P, Yamamoto M, Lamkanfi M, Kanneganti TD. The transcription factor IRF1 and guanylate-binding proteins target activation of the AIM2 inflammasome by Francisella infection., 2015, 16(5): 467–475.
[46] Yang JM, Hwang I, Lee E, Shin SJ, Lee EJ, Rhee JH, Yu JW. Bacterial outer membrane vesicle-mediated cytosolic delivery of Flagellin triggers host NLRC4 canonical inflammasome signaling., 2020, 11: 581165.
[47] Virreira WS, Niedelman W, Jensen KD, Rosowski EE, Julien L, Spooner E, Caradonna K, Burleigh BA, Saeij JPJ, Ploegh HL, Frickel EM. Determinants of GBP recruitment to Toxoplasma gondii vacuoles and the parasitic factors that control it., 2011, 6(9): e24434.
[48] Sweeney TE, Braviak L, Tato CM, Khatri P. Genome-wide expression for diagnosis of pulmonary tuberculosis: a multicohort analysis., 2016, 4(3): 213–224.
[49] Costa LLD, Delcroix M, Dalla Costa ER, Prestes IV, Milano M, Francis SS, Unis G, Silva DR, Riley LW, Rossetti ML. A real-time PCR signature to discriminate between tuberculosis and other pulmonary diseases., 2015, 95(4): 421–425.
[50] Satproedprai N, Wichukchinda N, Suphankong S, Inunchot W, Kuntima T, Kumpeerasart S, Wattanapokayakit S, Nedsuwan S, Yanai H, Higuchi K, Harada N, Mahasirimongkol S. Diagnostic value of blood gene expression signatures in active tuberculosis in Thais: a pilot study., 2015, 16(4): 253–260.
[51] Cerqueira DM, Gomes MTR, Silva ALN, Rungue M, Assis NRG, Guimaraes ES, Morais SB, Broz P, Zamboni DS, Oliveira SC. Guanylate-binding protein 5 licenses caspase-11 for Gasdermin-D mediated host resistance to Brucella abortus infection., 2018, 14(12): e1007519.
[52] Liu BCY, Sarhan J, Panda A, Muendlein HI, Ilyukha V, Coers J, Yamamoto M, Isberg RR, Poltorak A. Constitutive interferon maintains GBP expression required for release of bacterial components upstream of pyroptosis and anti-DNA responses., 2018, 24(1): 155-168.
[53] Fisch D, Bando H, Clough B, Hornung V, Yamamoto M, Shenoy AR, Frickel EM. Human GBP1 is a microbe- specific gatekeeper of macrophage apoptosis and pyroptosis., 2019, 38(13): e100926.
[54] Dickinson MS, Kutsch M, Sistemich L, Hernandez D, Piro AS, Needham D, Lesser CF, Herrmann C, Coers J. LPS-aggregating proteins GBP1 and GBP2 are each sufficient to enhance caspase-4 activation both in cellulo and in vitro., 2023, 120(15): e2078939176.
[55] Wandel MP, Pathe C, Werner EI, Ellison CJ, Boyle KB, von der Malsburg A, Rohde J, Randow F. GBPs inhibit motility of Shigella flexneri but are targeted for degradation by the bacterial ubiquitin Ligase IpaH9.8., 2017, 22(4): 507–518.
[56] Mesner D, Reuschl AK, Whelan MVX, Bronzovich T, Haider T, Thorne LG, Ragazzini R, Bonfanti P, Towers GJ, Jolly C. SARS-CoV-2 evolution influences GBP and IFITM sensitivity., 2023, 120(5): e2082390176.
Advances in the regulation of inflammasome activation by GBP family in infectious diseases
Shuting Quan1, Weiwei Jiao1,2, Fang Xu3,2, Lin Sun1,2, Hui Qi1,2, Adong Shen1,2
Guanylate-binding proteins (GBPs) are a subfamily of interferon-inducible proteins that undertake distinct roles in the the context of bacteria, virus, chlamydia and parasites infections. These proteins exert a notable influence on the progression and outcomes of infectious diseases. Within the realm of host cell-autonomous immunity against pathogens, GBPs have been identified as the regulators of pyroptosis through canonical and noncanonical inflammasome activation pathways. In this review, we summarize the structure and evolution of GBP family members, the canonical and noncanonical inflammasomeactivation pathways, the roles of GBPs in regulating inflammasome activation, and the mechanisms of GBPs affecting infections induced by different pathogens. We hope to provide new basic research clues for the pathogenesis and diagnosis and treatment of infectious diseases.
guanylate-binding proteins; infectious disease; inflammasome; canonical inflammasome activation; noncanonical inflammasome activation
2023-06-15;
2023-08-22;
2023-09-14
国家自然科学基金项目(编号:81871617,81701971,82172280,82100010)、中国科学院病原微生物与免疫学重点实验室开放课题(编号:CASPMI202201)、保定市科技计划(编号:2272P012)和北京市卫生健康委员会高层次公共卫生技术人才培养计划(编号:2022-3-041)资助[Supported by the National Natural Science Foundation of China (Nos. 81871617, 81701971, 82172280, 82100010), the CAS Key Laboratory of Pathogenic Microbiology and Immunology Open Project (No. CASPMI202201), Baoding Science and Technology Plan (No. 2272P012), and the Training Plan for High-Level Public Health Technical Talents of Beijing Municipal Health Commission (No. 2022-3-041)]
全舒婷,博士研究生,专业方向:儿内科。E-mail: qst137@163.com
焦伟伟,博士,研究员,研究方向:呼吸感染疾病病原研究。E-mail: jiaowei310@163.com
全舒婷和焦伟伟并列第一作者。
綦辉,博士,研究员,研究方向:病原与宿主细胞相互作用。E-mail: qh20021983@163.com
申阿东,硕士,研究员,研究方向:呼吸感染疾病诊疗及发病机制研究。E-mail: shenad16@hotmail.com
10.16288/j.yczz.23-119
(责任编委: 谢建平)
