烟草NtMYB102转录因子基因克隆及生物信息学分析
2023-11-24平文丽孙计平郭梅燕张雪珂李雪君
平文丽,孙计平,郭梅燕,孙 焕,张雪珂,李雪君*
1.河南省农业科学院烟草研究所,河南省许昌市青梅路与永昌大道交叉口 4610002.烟草行业黄淮烟区烟草病虫害绿色防控重点实验室,郑州市金水区花园路116 号 4500023.项城市农业科学研究所,河南省周口市项城市光武大道 466200
转录因子(Transcription factors,TFs)又名反式作用因子,是一类可通过与DNA顺式作用元件结合激活或者抑制基因的转录从而调控植物生长发育的蛋白,在植物调控基因表达、响应外界刺激的过程中发挥重要作用[1]。植物中与响应生物胁迫和非生物胁迫密切相关的转录因子主要有MYB、bZIP、WRKY、NAC 和AP2/ERF 5 个家族[2-7]。其中,MYB转录因子家族成员最多。MYB 转录因子由位于N端的DNA 结合结构域(DNA binding domain)、调控激活结构域(Transcriptional activation domain)以及负调控区(Negative regulatory region)组成。根据包含保守结构域的数量,MYB 转录因子被分为1R-MYB、R2R3-MYB、R1R2R3-MYB 和4R-MYB 4类[3-6]。其中,R2R3-MYB类转录因子数量最多。研究发现,R2R3-MYB 类转录因子中的AtMYB102 可参与调控拟南芥对盐胁迫、干旱胁迫、机械伤害、渗透胁迫、菜青虫取食的响应,并能调控拟南芥正常生长与响应胁迫之间的动态平衡[6-14],水稻、番茄等其他植物中MYB102 也有相似功能。Zhu 等[15]采用农杆菌介导的遗传转化法将AtMYB102基因在拟南芥中过量表达获得过表达(MYB102-OX)株系,通过对比过表达株系和缺失突变体(myb102)株系接种蚜虫后内源乙烯含量、单株蚜虫数、NtMYB102基因及乙烯生物合成基因等的相对表达量,发现过表达AtMYB102基因可导致拟南芥易受蚜虫为害;Piao等[16]发现水稻中OsMYB102基因可通过下调脱落酸合成延缓叶片衰老,在拟南芥中过表达OsMYB102基因可导致拟南芥对盐胁迫和干旱胁迫更敏感;Zhang 等[17]在番茄中过表达SlMYB102基因,发现SlMYB102基因受渗透胁迫诱导表达后可提高番茄对盐胁迫的抗性。然而,烟草中NtMYB102基因的相关研究尚未见报道。为此,同源克隆NtMYB102基因,使用在线工具预测NtMYB102 蛋白的理化性质与结构域以及NtMYB102基因上游顺式作用元件;下载NCBI SRA数据库中转录组原始数据,分析烟草接种青枯雷尔氏菌(Ralstoniasolanacearum,青枯病病原菌)后NtMYB102基因的表达量,并采用实时荧光定量PCR(qRT-PCR)法分析烟草接种蚜虫后NtMYB102基因的相对表达量变化,以期为烟草抗病虫育种提供依据。
1 材料与方法
1.1 试验材料
序列克隆中使用的烟苗(烟草品种K326)于LRH-800-GSI 型光照培养箱(广东泰宏君科学仪器股份有限公司)中培养,条件设置为温度25 ℃,光照8 h/d。接种蚜虫试验中的供试烟苗(烟草品种中烟100)按照国家标准GB/T 25241.1—2010[18]中漂浮育苗的方法培养于河南省农业科学院烟草研究所育苗大棚中。
1.2 试验方法
1.2.1NtMYB102基因的克隆
在拟南芥信息资源中心(https://www.arabidopsis.org/)下载拟南芥AtMYB102 蛋白的氨基酸序列,并将下载的序列在NCBI 和茄科植物基因组数据库(https://solgenomics.net)中分别进行BLAST比对,获得与AtMYB102 蛋白相似度最高的烟草NtMYB102基因序列,根据序列设计NtMYB102基因特异引物102F(5'-ATGGGAAGAGCTCCTTGTTGTG-3')和102R(5'-GACTTACATAAATTCATTAGTGG-3')。使用RealPure 普通植物RNA 提取试剂盒[中科瑞泰(北京)生物科技有限公司]提取K326幼苗的mRNA后,使用All-in-One First-Strand Synthesis MasterMix(with dsDNase)反转录试剂盒(北京密码子生物科技有限公司)合成cDNA 并将其作为模板,以102F和102R 作为扩增引物,使用2×SanTaq PCR Mix 试剂盒[生工生物工程(上海)股份有限公司]进行PCR 扩增,采用琼脂糖凝胶电泳法检测PCR 产物。将PCR 产物送交生工生物工程(上海)股份有限公司,由该公司采用Sanger 测序法获取NtMYB102基因的CDS序列。
1.2.2NtMYB102基因及编码蛋白的生物信息学分析
使用在线工具Translate(https://web.expasy.org/translate)将NtMYB102基因的CDS 序列翻译为蛋白序列,并使用在线工具ProtParam(https://web.expasy.org/protparam/)和在线工具ProtScale(https://web.expasy.org/protscale/)分析蛋白理化性质。从茄科植物基因组数据库中下载NtMYB102基因上游2 000 bp 的序列。使用在线工具NNPP(Neural Network Promoter Prediction,https://fruitfly.org/seq_tools/promoter.html)分析NtMYB102基因上游2 000 bp 的转录起始位点;使用在线工具NSITE-PL(http://www.softberry.com/berry.phtml?topic=nsitep&group=programs&subgroup=promoter)与顺式作用元件数据库PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分别分析NtMYB102基因上游2 000 bp 的启动子顺式作用元件。使用在线工具 SignalP 6.0 (https://services.healthtech.dtu.dk/services/SignalP-6.0)预测蛋白信号肽。使用在线工具TMHMM(https://services.healthtech.dtu.dk/services/TMHMM-2.0/)预测跨膜结构域。使用在线工具Motif search(https://www.genome.jp/tools/motif/)和在线工具InterProScan(https://www.ebi.ac.uk/interpro/about/interproscan/)分析蛋白的结构域、基序(Motif)和所属家族。其中,在线工具Motif search 的检索范围为Pfam、NCBI-CDD、Prosite profile 3 个网站。使用蛋白结构预测软件Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2)、在线工具PredictProtein(https://predictprotein.org)和SWISS MODEL(https://swissmodel.expasy.org)分析蛋白二级结构和3D 结构。使用在线工具NetPhos 3.1(https://services.healthtech.dtu.dk/services/NetPhos-3.1/)预测蛋白磷酸化修饰位点。从茄科植物基因组数据库及本氏烟基因组数据库(http://benthgenome.qut.edu.au/)下载获得番茄、茄子、马铃薯和本氏烟等茄科植物的MYB102 蛋白序列,并采用最大似然(Maximum Likelihood)法使用MEGA 11.0 软件构建系统进化树。
1.2.3 烟草接种青枯雷尔氏菌后NtMYB102基因的表达量分析
使用SRA-Toolkit 软件(https://github.com/ncbi/SRA-tools)从NCBI SRA 数据库中下载抗烟草青枯病品种岩烟97 和感烟草青枯病品种红花大金元接种青枯雷尔氏菌后的转录组数据(SRA ID 为SRP423092)。将原始数据转换为标准的FASTQ格式文件后,使用fastp软件对数据进行质控[19]。使用HISAT2 软件将质控后的数据映射至烟草参考基因组,参数设置参考文献[20]。使用SAMtools 软件对映射结果进行格式转换、排序,并使用StringTie 软件对转录本进行组装和量化[21-22];使用StringTie 软件的Python 脚本prepDE.py(https://ccb.jhu.edu/software/StringTie/dl/prepDE.py)获得原始reads 计数[22]。使用Ballgown 软件计算标准化的基因表达量[TPM(Transcripts Per Million)值][23]。提取转录组数据中NtMYB102基因的TPM 值,分析烟草接种青枯雷尔氏菌后12、24、36 和120 h 感病品种和抗病品种中NtMYB102基因的表达量与0 h 的差异。
1.2.4 烟草接种蚜虫后NtMYB102基因的相对表达量分析
供试烟苗(中烟100)在育苗大棚中采用漂浮育苗法培养至3~4 片真叶时,移栽到花盆中培养,每盆1 株,接种18 株。至7~8 片真叶时,选择整齐一致的烟苗,外罩防虫网(孔径0.15 mm),在烟苗最顶部的3 片叶上接种蚜虫,每株接种4 龄无翅成蚜20 头。在接种蚜虫后0、6、12 和24 h 取接种叶片,分析NtMYB102基因的相对表达量变化,试验设置3 次生物学重复,RNA 提取使用TaKaRa MiniBEST Universal RNA Extraction Kit 试剂盒(日本TaKaRa公司)、cDNA 合成使用PrimeScriptTMRT Reagent Kit反转录试剂盒(日本TaKaRa 公司)。根据ABI 7500 Fast 型实时荧光定量PCR 仪(美国Applied Biosystems 公司)操作说明及TB Green®PremixEx TaqTM试剂盒(日本TaKaRa 公司)的说明书进行实时荧光定量PCR 分析。以NtActin基因作为内参,采用2-△△CT法[24]计算NtMYB102基因相对表达量。用于分析NtMYB102基因相对表达量的引物序列为q-F(5'-GCTGGACTTCAAAGGTGTGG-3')和q-R(5'-GCAGCAATAGCAGACCACTT-3')。使用DPS 14.5 软件对相对表达量进行方差分析,采用LSD 法进行数据间差异显著性检验。
2 结果与分析
2.1 NtMYB102基因的克隆
以K326幼苗cDNA为模板进行PCR扩增后,采用琼脂糖凝胶电泳法检测PCR 产物,发现PCR 产物的长度约为1 100 bp(图1)。Sanger 测序的结果表明,NtMYB102基因CDS 序列全长1 131 bp,序列与NCBI和茄科植物基因组数据库中一致。

图1 NtMYB102基因CDS区的琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis map for CDS region in NtMYB102 gene
2.2 NtMYB102基因编码蛋白的理化性质
使用在线工具Translate 将NtMYB102基因的CDS 区翻译为蛋白,发现该基因无内含子,编码的蛋白由376 个氨基酸组成。使用在线工具ProtParam 对NtMYB102 蛋白基本理化性质进行分析,发现该蛋白分子量为42.817 kDa,理论等电点为5.77,分子式为C1859H2874N534O596S18,由5 881个原子组成,不稳定指数为50.35,在植物体内为不稳定的蛋白。根据在线工具ProtScale对NtMYB102蛋白疏水性的分析结果,NtMYB102蛋白的亲水区域(疏水性标度值为负值)多于疏水区域(疏水性标度值为正值),表明NtMYB102蛋白是一种亲水蛋白(图2)。

图2 NtMYB102蛋白的疏水性预测结果Fig.2 Predicted hydrophobicity of NtMYB102 protein
2.3 NtMYB102基因启动子和顺式作用元件预测
使用在线工具NNPP 对NtMYB102基因转录起始位点进行预测,发现NtMYB102基因启动子序列为5'-ATCCTCCCTATATATATACCCCCTCCCCTTAT TCTTAATCTCCAGCAATA-3',其中加下划线的T为转录起始位点。使用在线工具Nsite-PL及数据库PlantCare 对NtMYB102基因上游2 000 bp 顺式作用元件进行预测,发现在NtMYB102基因的上游存在多个转录因子结合位点。其中,-1 607 bp 至-1 614 bp 为依赖 ABA 的胁迫响应元件 ABRE(TACGTGGC);-1 577 bp 至-1 585 bp 及-188 bp至-196 bp 为与防御和胁迫相关的响应元件TC-rich repeats(GTTTTCTTAC);-1 304 bp至-1 310 bp为参与调控植物抗病相关基因表达的元件GCC-box(AGCCGCC);-521 bp 至-526 bp 为响应水分胁迫、盐胁迫、渗透胁迫及ABA 的元件Myba(CGGTTG);-205 bp 至-210 bp 为真菌诱导响应元件W-box(TTGACC)。
2.4 NtMYB102蛋白的信号肽和结构域预测
在线工具SignalP 6.0 对NtMYB102 蛋白的预测结果表明,该蛋白不存在信号肽。在线工具TMHMM 对跨膜结构的预测结果表明,NtMYB102蛋白无跨膜区。使用在线工具Motif search 和InterProScan 对NtMYB102 蛋白的结构域、基序和所属家族进行分析,结果如图3所示。Prosite profile网站中检索到1 个具有DNA 结合位点特征的HTH_MYB motif,NBCI-CDD 网站中检索到9 个具有DNA 结合功能的SANT/MYB motif,Pfam 网站中检索到4个具有DNA结合功能的Myb_DNA-bingding motif。在线工具InterProScan对NtMYB102蛋白的分析发现,该蛋白为DNA结合蛋白,属于MYB 家族,具有2 个Myb_DNA-binding保守结构域。

图3 NtMYB102蛋白的结构域及基序预测结果Fig.3 Predicted domains and motifs of NtMYB102 protein
2.5 NtMYB102蛋白二级结构和3D结构预测
使用Phyre2软件对NtMYB102蛋白的二级结构和3D结构进行预测,发现该蛋白存在α螺旋,无β折叠链;蛋白的3D 结构中有多个螺旋结构(图4)。使用在线工具PredictProtein 和SWISS MODEL 对NtMYB102 蛋白的二级结构和3D 结构的预测结果与Phyre2软件的预测结果一致。

图4 NtMYB102蛋白的二级结构和3D结构Fig.4 Secondary structure and 3D structure of NtMYB102 protein
2.6 NtMYB102蛋白磷酸化修饰位点预测
对NtMYB102 蛋白的磷酸化位点进行预测,发现该蛋白存在大量可被磷酸化的位点(图5)。其中,评分最高的3 个磷酸化位点为位于第71、355 和347 个氨基酸的丝氨酸,评分分别为0.998、0.996 和0.994 分。NtMYB102 蛋白可能通过上述位点发生磷酸化修饰的方式参与细胞内信号转导、调控基因的转录表达。
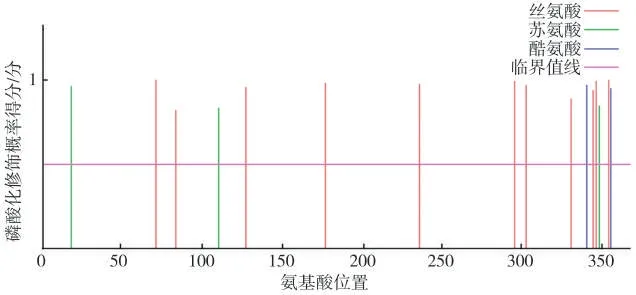
图5 NtMYB102蛋白中磷酸化位点的预测结果Fig.5 Predicted phosphorylation sites in NtMYB102 protein
2.7 NtMYB102蛋白氨基酸序列同源性比对和系统进化分析
对NtMYB102 蛋白序列以及本氏烟、茄科其他近缘种(辣椒、茄子等)和棉属植物等的MYB102 同源蛋白氨基酸序列进行多重序列比对并构建系统进化树,发现NtMYB102 蛋白与本氏烟中NbMYB102 蛋白的亲缘关系最近,与辣椒和茄子等其他茄科作物MYB102 蛋白的亲缘关系较近,与拟南芥、大豆、棉花和茶树等其他植物的亲缘关系较远(图6)。
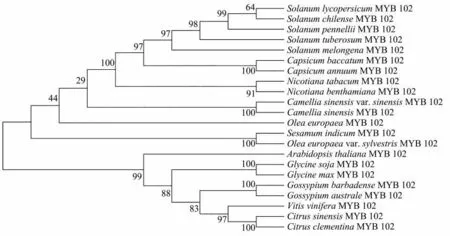
图6 MYB102蛋白的系统进化树Fig.6 Phylogenetic tree of MYB102 protein
2.8 烟草接种青枯雷尔氏菌后NtMYB102基因的表达量变化
接种青枯雷尔氏菌后,抗病和感病烟草品种的NtMYB102基因表达量(TPM 值)变化如图7 所示。抗病烟草品种岩烟97 接种青枯雷尔氏菌后12 hNtMYB102基因的表达量高于0 h,但差异未达显著水平;接菌后24、36 和120 hNtMYB102基因的表达量均低于0 h。其中,接菌后36 hNtMYB102基因的表达量与0 h 比差异显著(P<0.05)。感病品种红花大金元接种青枯雷尔氏菌后12和24 hNtMYB102基因的表达量高于0 h。其中,接菌后24 hNtMYB102基因的表达量与0 h差异达显著(P<0.05)水平;接菌后36和120 hNtMYB102基因的表达量与0 h无显著差异。
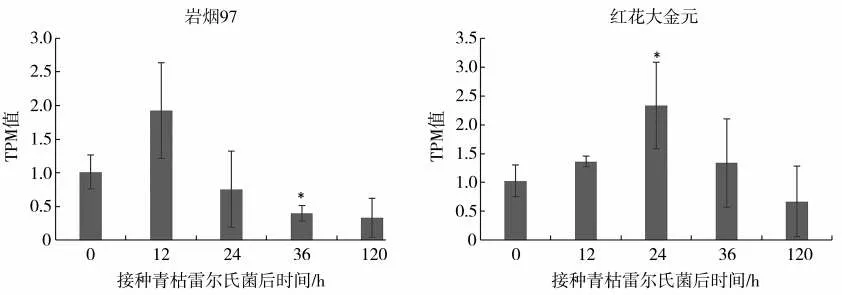
图7 接种青枯雷尔氏菌后岩烟97及红花大金元中NtMYB102基因表达量Fig.7 Expression level of NtMYB102 gene in Yanyan 97 and Honghuadajinyuan after being infected by R.solanacearum
2.9 烟草接种蚜虫后NtMYB102基因的相对表达量变化
采用实时荧光定量PCR 法分析烟草接种蚜虫后NtMYB102基因的相对表达量,发现接种4龄无翅成蚜后6、12 和24 h,烟草NtMYB102基因的相对表达量均极显著(P<0.01)高于0 h(图8)。接种后6 h,NtMYB102基因的相对表达量为4.58;接种后12 h,相对表达量为5.00;接种后24 h,相对表达量为6.46。接种后24 h,NtMYB102基因的相对表达量极显著(P<0.01)高于接种后0、6 和12 h;接种后6 和12 h 的相对表达量间无显著差异。综上,NtMYB102基因能够在接种蚜虫后6~24 h 快速响应,相对表达量显著上调,表明该基因在转录水平响应蚜虫取食,可能参与烟草抗虫性的调控。

图8 接种蚜虫后烟草NtMYB102基因的相对表达量Fig.8 Relative expression of NtMYB102 gene in tobacco after aphids infestation
3 讨论
本研究中发现NtMYB102基因上游2 000 bp 包含了多种响应逆境胁迫以及调控植物中与病原菌侵染诱导和防御相关基因的顺式作用元件(ABRE、TC-rich repeat、GCC box、BREB 和W-box),表明该基因可能受病原侵染和逆境胁迫的诱导,这与拟南芥、水稻和番茄等植物中关于MYB102基因功能研究的结果一致[25-27]。根据对NCBI SRA 数据库中转录组原始数据的分析结果,抗烟草青枯病品种接种青枯雷尔氏菌后36 h,NtMYB102基因的表达量显著(P<0.05)低于0 h,这与刘彻等[28]的研究结果一致。接种青枯雷尔氏菌后,抗病和感病烟草品种NtMYB102基因的表达量变化趋势不同,表明NtMYB102基因是抗病和感病烟草品种中响应病原菌侵染的差异表达基因,可能在调控烟草对青枯病抗病性中起重要作用。后续研究可采用基因组编辑技术对NtMYB102基因的表达量进行精准调控,验证NtMYB102基因功能,然后使用基因组编辑技术对感青枯病烟草品种进行定向改良。此外,中烟100 接种蚜虫后6、12 和24 h,NtMYB102基因的相对表达量持续上调,且均显著(P<0.05)高于0 h,该趋势与拟南芥被蚜虫取食后AtMYB102基因的表达变化规律一致[15],推测NtMYB102基因可能参与烟草响应蚜虫取食,可作为抗蚜虫育种的候选基因。
4 结论
从烟草K326中克隆了拟南芥AtMYB102的同源基因NtMYB102。烟草NtMYB102基因的CDS 全长1 131 bp,编码376 个氨基酸。生物信息学分析结果表明,NtMYB102基因的上游2 000 bp 存在多个响应胁迫、响应真菌诱导和与防御相关的顺式作用元件。接种青枯雷尔氏菌后36 h,抗病烟草品种中NtMYB102基因的表达量显著下调,表明该基因可能在烟草响应青枯雷尔氏菌侵染中起调控作用。烟草接种蚜虫后6~24 h,NtMYB102基因的相对表达量显著提高,表明该基因可能在烟草响应蚜虫取食中起调控作用。
