烟草番茄环纹斑点病毒快速检测试纸条的研制及应用
2023-11-24夏振远卢灿华黄昌军马俊红刘春明盖晓彤
姜 宁,夏振远,卢灿华,黄昌军,马俊红,刘春明,盖晓彤*
1.云南省烟草农业科学研究院,昆明市五华区圆通街33 号 6500212.云南省烟草公司红河州公司,云南省红河州弥勒市温泉路 652399
番茄环纹斑点病毒(tomatozonatespotvirus,TZSV)属于正番茄斑萎病毒属(Orthotospovirus),是正番茄斑萎病毒属的一个新种,于2005 年在我国云南省的番茄和辣椒产区中被发现,由Dong 等[1]分离并正式命名。TZSV 自然条件下可侵染番茄(Lycopersicumesculentum)、辣椒(Capsicumannuum)、普通烟草(Nicotianatabacum)、马铃薯(Solanum tuberosum)、文殊兰(Crinumasiaticum)、蜘蛛兰(Hymenocallislittoralis)、鸢尾(Iristectorum)、鬼针草(Bidenspilosa)等20多种植物,目前主要分布在我国的云南、广西等地[1-8]。TZSV 主要以西花蓟马(Frankliniellaoccidentalis)、棕榈蓟马(Thripspalmi)、烟蓟马(T.tabaci)等多种蓟马为介体,通过持久增殖型的方式进行传播,同时还可以通过嫁接和汁液摩擦传播[1,9-12]。该病毒可引起多种经济作物斑萎病,常与其他病毒复合侵染加重症状,严重时甚至绝收,给农业生产带来较大经济损失[13-14]。TZSV 在寄主上引起的症状主要与品种、寄主生育时期、环境条件等因素有关。受TZSV侵染的烤烟烟株在发病初期,叶片上会出现同心环纹或细小坏死斑点,随后坏死范围扩大,叶片上出现大量坏死环斑或连片坏死,主叶脉扭曲,植株顶芽坏死萎蔫,在团棵期以前发病的烟株常整株坏死[13,15-16]。根据于海芹等[2]的报道,云南省烟草斑萎病发病烟株中,27%以上由TZSV 引起,TZSV 已成为云南烟区烟草斑萎病的主要病原,严重影响烤烟生产。然而,其在烟草上引起的症状与番茄斑萎病毒(tomato spotted wilt virus,TSWV)等正番茄斑萎病毒属病毒在烟草上引起的症状相似,通过肉眼难以辨别。目前,检测TZSV 的方法主要有电子显微镜检测[17]、分子生物学检测[4,18]、血清学检测等[19-21]。电镜检测、分子生物学检测,以及血清学检测中的酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)检测耗时长,且需要专业检测设备和技术娴熟的专业人员,成本高,不适合田间病害的快速检测[22]。目前,国内科研人员制备了TZSV 的单克隆抗体[19-21],并在此基础上制备了TZSV 的胶体金免疫层析试纸条(colloidal gold immunochromatographic strip,GICA),然而目前国内外市场上并没有商品化的TZSV检测试纸条。为此,制备了TZSV N蛋白单克隆抗体,并研制了能够快速检测TZSV 的胶体金试纸条,旨在实现烟叶生产中TZSV的快速检测鉴定,为烟草斑萎病的有效防控提供技术支持。
1 材料与方法
1.1 材料、试剂和仪器
试剂耗材:酵母提取物、胰蛋白胨、异丙基-β-D-硫代半乳糖苷[IPTG(英国OXOID公司)];BL21 感受态(自制);预染蛋白Marker、蛋白浓度定量试剂盒(上海生工生物工程有限公司);牛血清白蛋白BSA(美国Merck 公司);碳酸氢钠、无水碳酸钠、氯化钠、氯化钾、十二水合磷酸二氢钠、磷酸二氢钾、碳酸钾、Tris、柠檬酸、氯金酸、柠檬酸三钠、蔗糖、海藻糖、氢氧化钠、吐温-20、甲醇等(国产分析纯);NC膜(德国Sartouris公司)。
仪器:超声波细胞破碎仪(美国Branson 公司);全温度振荡培养箱(上海旻泉仪器有限公司);高速冷冻离心机、低温高速离心机、可调微量加样器、小型台式离心机(德国Eppendorf公司);恒温磁力搅拌器(上海司乐仪器有限公司);恒温鼓风干燥箱(德国Binder 公司);纯水仪(美国Millipore 公司);水平摇床(太仓华利达实验设备有限公司);pH 计(瑞士Mettler Toledo 公司);喷金划膜机、切条机、压卡机、封口机(杭州峰航科技有限公司)。
病毒材料:采自云南植烟区玉溪、红河、昆明、丽江、临沧、普洱、文山、昭通、曲靖等州(市)的田间发病烟叶样品131个,样品经PCR检测为TZSV阳性后用于试纸条的检测。烟草花叶病毒(tobacco mosaic virus,TMV)、马铃薯Y 病毒(potato virus Y,PVY)、TSWV、南美红辣椒脉斑驳病毒(chilli veinal mottle virus,ChiVMV)、黄瓜花叶病毒(cucumber mosaic virus,CMV)、烟草脉带花叶病毒(tobacco vein banding mosaic virus,TVBMV)等均由本课题组纯化保存。
1.2 方法
1.2.1 TZSVN基因蛋白表达和纯化
序列合成:根据TZSV 云南分离物N基因序列(GenBank Accession number NC_010489),优化密码子,合成并克隆到载体pET28a,得到质粒pET28a-TZSV-N,序列由上海生工生物工程股份有限公司合成。质粒pET28a-TZSV-N 转化大肠杆菌BL21(DE3),并筛选阳性克隆。
蛋白表达:固体平板上挑取pET28a-TZSV-N 单克隆菌落接入5 mL LB 液体培养基(卡那质量浓度50 μg/mL),37 ℃培养12~14 h。次日,菌种以1∶50(体积比)接入LB 液体培养基(卡那质量浓度50 μg/mL),37 ℃培养至OD值0.4~0.6,加入IPTG至终浓度0.8 mol/L,25 ℃诱导表达6 h,菌液8 000 r/min、4 ℃离心(5810R,德国Eppendorf 公司)15 min,并收集菌体。
菌种裂解:加入100 mL 破碎液进行超声破碎。裂解条件:冰浴、功率60%、超声2 s、间隔2 s、时间15 min。超声破碎后12 000 r/min、4 ℃离心15 min,并收集上清液和沉淀。
上清液纯化:收集的上清液利用高亲和性Ni 树脂进行纯化,并收集穿出液、洗脱液,由SDS-PAGE检测纯化效果。
1.2.2 杂交瘤细胞和单克隆抗体制备
将表达纯化的蛋白与等体积的弗氏佐剂混合乳化均匀,成油包水状态,用于免疫小鼠试验。将乳化后的蛋白免疫4只BALB/c小鼠,皮下免疫3次,间隔28 d,最后经间接ELISA 检测效价[23]。细胞融合参照赵丹丹等[24]的方法,最后一次免疫14 d 后腹腔注射抗原进行加强免疫,3 d后进行细胞融合。将融合好的细胞进行96 孔铺板,用HAT 培养液进行培养,3 d后更换并改用HT培养液培养。10 d后,取细胞培养上清液进行检测。使用有限稀释法对阳性孔进行克隆,直到得到的克隆均为阳性,最终获得杂交瘤细胞。
提前7 d在小鼠腹腔中注射矿物油,将一定数量的杂交瘤细胞注射入小鼠腹腔,10 d左右收集腹水,4 000 r/min 离心15 min,上清液即为单克隆抗体腹水。参照尚海丽等[25]的方法进行单克隆抗体纯化。以间接ELISA方法对纯化后抗体进行效价检测[23]。
应用小鼠抗体亚型检测试剂盒(美国Proteintech公司)对抗体进行亚型检测。应用双抗夹心的金标方法筛选可以配对的抗体对。
1.2.3 TZSV胶体金快速检测试纸条制备
参照魏梅生等[26]的方法,采用柠檬酸三钠还原方法制备胶体金。TZSV 胶体金快速检测试纸由样品垫、金标垫、硝酸纤维素膜、吸水垫(吸收垫)和背板组成;样品垫、金标垫、硝酸纤维素膜和吸水垫依次叠加粘贴在背板上,各组分间相互叠加2.5 mm;金标垫上包被有胶体金标记的抗TZSV单克隆抗体(由10#杂交瘤细胞产生);硝酸纤维素膜上设有检测线(Test line,T线)和质控线(Control line,C线),检测线包被有抗TZSV病毒单克隆抗体(由55#杂交瘤细胞产生),质控线包被有抗鼠IgG二抗。
质控线包被的抗鼠IgG 二抗的质量浓度为1 mg/mL。样品垫的大小为3 mm×15 mm,金标垫的大小为3 mm×3 mm,硝酸纤维素膜的大小为3 mm×28 mm,吸收垫的大小为3 mm×19 mm。检测线与质控线间的间距为6.0 mm~6.5 mm。
在底板上依次粘贴样品垫和固定有胶体金标记的TZSV单克隆抗体的金标垫、硝酸纤维素膜以及吸收垫,切条机裁切成3 mm 宽,获得TZSV 胶体金快速检测试纸条。
1.2.4 检测方法
准备待测样品液,取200 μL 待测液加入1.5 mL离心管,取试纸条将有样品垫的一端插入离心管,接触待测液,5 min 左右判断结果。若C 线显色而T 线未显色,则结果为阴性;若C 线和T 线均显色,结果为阳性;若C线和T线均未显色或T线显色而C线未显色,则结果无效。
1.2.5 试纸条性能评价试验
1.2.5.1 灵敏度测试
将0.1 g 感染TZSV 的烟草叶片充分研磨,加入1 mL 0.1 mol/L PBS作为病毒汁液的10倍稀释液,依次配制102、103、104、105倍的病毒汁液稀释液。
1.2.5.2 特异性测试
将含TMV、PVY、CMV、TVBMV、ChiVMV、TSWV和TZSV的发病叶片制备成10倍病毒汁液稀释液,分别取200 μL用TZSV快速检测试纸条检测。
1.2.5.3 田间样品检测
田间采集疑似烟草斑萎病的样品,提取RNA,RT-PCR 鉴定其中的TZSV,所用引物为TZSV N 基因特异性引物。上游引物TZSV-N(5'-3'):TTAAAA AGACAGATCATTGCTGCT;下游引物TZSV-NR(5'-3'):ATGTCTAACGTCCGGAGTTTAAC,参考尹跃艳等[27]的方法设计。用TZSV 试纸条对所有TZSV RT-PCR 检测为阳性的样品进行测试,并计算两种检测方法的符合度。
1.2.5.4 稳定性测试
将制备好的TZSV快速检测试纸条密封后在4、25、37 ℃3个温度条件下保存,并在第0、1、2、3、4、5、6个月后取出,分别检测TZSV阳性样品和健康烟叶(阴性对照),并检测其稳定性。
2 结果与分析
2.1 TZSV云南省株系N蛋白原核表达
对TZSV云南株系N蛋白序列的亲疏水性、信号肽、跨膜域、基本结构等进行理论评估,为了更好地进行原核表达,对该基因序列进行了密码子优化(图1)。优化后的序列与原序列相比,核苷酸同源性为77.6%,而氨基酸序列完全一致。采用基因合成的方式构建质粒并克隆到表达载体pET28a上,进一步转化到大肠杆菌感受态细胞(BL21)。
融合蛋白经过纯化,可在上清液中大量表达,经验证在200~500 mmol/L 咪唑的洗脱下可最大量纯化该融合蛋白。SDS-PAGE 电泳分析在理论分子量35 kDa 相应位置出现明显条带,初步确定融合蛋白成功得到了纯化(图2)。
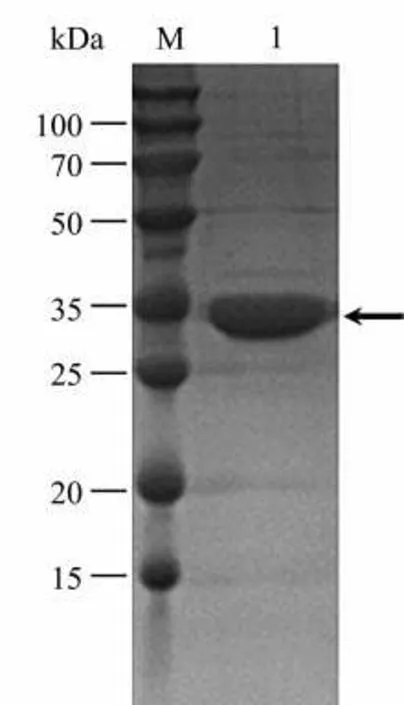
图2 SDS-PAGE检测纯化后的重组TZSV N蛋白Fig.2 Purified recombinant TZSV N protein after SDS-PAGE test
2.2 TZSV单克隆抗体制备
取4 只6 周龄雌性BALB/c 小鼠,在第0、13、33天共进行3次免疫。每次每只小鼠抗原免疫用量为25 μg,初次免疫用等量弗氏完全佐剂乳化,皮下多点注射。第2次免疫用等量弗氏不完全佐剂乳化,皮下多点注射,第3次免疫用等量生理盐水混合,腹腔注射。第2 次免疫后20 d 尾静脉采血,通过间接ELISA 法测抗体效价,以此确定小鼠体内是否有抗体生成。比较4只小鼠的效价,选择抗体效价较高的小鼠用于细胞融合。融合前3 d 用抗原直接加强免疫1次。
共获得阳性单克隆杂交瘤细胞株55 株(1#~55#)。收集杂交瘤细胞,制备并收集小鼠腹水,田间采集的TZSV阳性样品以103倍病毒汁液稀释液为待测样品,采用间接ELISA法测定抗体效价,效价最高可达1∶1 024 000。抗体类型及亚类鉴定结果表明,55 个单抗中有54 个单抗类型为IgG1,1 个单抗类型为IgG2b,所有单克隆抗体均为κ轻链。选择其中能够高效分泌TZSV 单抗且效价高的9#、10#、45#和55#杂交瘤细胞进行后续试验。
2.3 TZSV试纸条性能测试
按照1.2.3 的方法制备TZSV 快速检测试纸条。首先对试纸条灵敏度进行检测。经测试,10#单抗标金/55#单抗喷膜抗体组合检测效果最好。利用田间发病的TZSV 阳性烟叶样品进行灵敏度检测。结果(图3)显示,10#单抗标金/55#单抗喷膜的试纸条灵敏度最佳,在病毒汁液稀释104倍时T 线仍清晰可见,病毒汁液稀释105倍时隐约有线。

图3 TZSV试纸条灵敏度检测Fig.3 Sensitivity evaluation on test strips for TZSV
以阳性的TMV、PVY、CMV、TVBMV、ChiVMV、TSWV 和TZSV 发病叶片作为待测样品对TZSV 试纸条特异性进行检测,结果见图4。由图4 可见,试纸条仅对TZSV样品有阳性反应,其他病毒阳性样品检测结果均为阴性,表明TZSV试纸条具有良好的特异性。
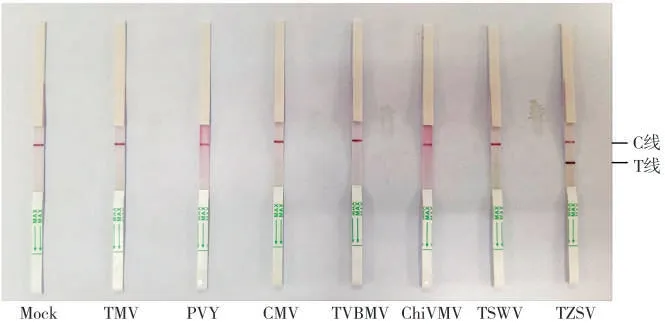
图4 TZSV试纸条特异性检测Fig.4 Specificity evaluation on test strips for TZSV
田间采集疑似烟草斑萎病的烟草样品,提取RNA,通过RT-PCR 鉴定其中的TZSV。鉴定为TZSV 阳性的131 个烟草样品用本研究中制备的TZSV快速检测试纸条进行检测,其中126个样品经试纸条检测为阳性,符合率为96.2%。
TZSV 试纸条稳定性评价。将试纸条置于4、25、37 ℃环境条件下保存6个月,期间每隔1个月取出试纸条检测阴性对照和TZSV 阳性样品,结果见表1。在稳定性评价6 个月时间内,试纸条在3 种温度条件下均保持良好的稳定性,无假阳性和假阴性出现。

表1 不同温度条件下TZSV试纸条稳定性检测结果①Tab.1 Stability evaluation results of test strips for TZSV at different temperatures
3 讨论
烟草斑萎病已成为影响我国西南烟区烤烟生产的重要病毒病,其病原是以TSWV 和TZSV 为主的多种正番茄斑萎病毒属病毒[2]。不同病毒引起的烟草斑萎病症状类似,仅凭肉眼难以区分。此外,苗期的烟草斑萎病检测对于育苗质量监测尤为重要。目前市场上已有TSWV的快速检测产品,但没有TZSV的快速检测试纸条。我国已有科研人员制备了TZSV单克隆抗体并制备了TZSV快速检测试纸条,但其对烟草病汁液的检测限介于1∶810~1∶2 430,且并未对田间自然发病的TZSV烟叶样品进行检测[19-21]。本研究中制备的TZSV 快速检测试纸条检测TZSV阳性烟草叶片病汁液可稀释10 000 倍(质量体积比),灵敏度高,可在5 min内实现田间发病烟草斑萎病样品的快速检测。本研究中制备的TZSV 快速检测试纸条检测结果与RT-PCR 检测结果的吻合率为96.2%,少量RT-PCR检测结果为TZSV阳性的样品,TZSV试纸条检测结果为阴性,这说明试纸条检测的灵敏度略低于RT-PCR。由于病毒在叶片上分布不均,这一结果也可能与不同采样烟叶部位病毒含量差异有关。根据云南省烟草斑萎病病原组成特点,下一步可尝试制备同时检测TSWV 和TZSV 的多重检测试纸条。本研究中制备的TZSV 快速检测试纸条可对田间烟叶和烟田周边杂草上的TZSV 实现快速检测,基于其较高的灵敏度,本研究中制备的TZSV 单抗和快速检测试纸条具有检测传毒昆虫蓟马是否带毒的潜力,但还需进一步验证。
4 结论
①获得了TZSV 单克隆抗体。②制备了TZSV胶体金快速检测试纸条,可在5 min内完成烟草病毒的检测。③试纸条检测阳性TZSV 的烟草病汁液的灵敏度高,可稀释10 000 倍(质量体积比)。同时与烟草上常见的TMV、PVY、CMV 和TSWV 等病毒没有交叉反应,可特异性地检测田间烟叶样品中的TZSV。
