骨化三醇常规疗法与冲击疗法对维持性血液透析继发性甲状旁腺功能亢进症患者外周血PTH、Notch1水平和血管钙化的影响Δ
2023-11-24王忠祥庄雪明宗刚军徐东升
王忠祥,庄雪明,张 烨,宗刚军,徐东升
(中国人民解放军联勤保障部队第九〇四医院急诊科,江苏 无锡214044)
继发性甲状旁腺功能亢进症(secondary hyperpara-thyroidism,SHPT)是维持性血液透析(MHD)及慢性肾脏疾病患者常见的并发症,主要由于体内钙磷代谢紊乱引起甲状旁腺代偿性增生及全段甲状旁腺激素(PTH)分泌增加[1-2]。SHPT临床可表现为高PTH水平、高钙或低钙血症、持续性高磷等症状,进而导致骨骼、精神及神经系统、血液系统及心脑血管等疾病发生风险增加,严重影响患者生活质量和预后[3]。SHPT患者通常存在血管钙化,既往研究结果显示,高PTH水平与血管钙化程度有关[4]。骨化三醇是维生素D3经肝脏和肾脏代谢后最重要的活性产物,可抑制甲状旁腺细胞的增殖,同时促进肠道对钙的吸收,抑制PTH的分泌,并调节骨质的钙化,是治疗SHPT的重要药物[5-6]。但活性维生素D给药剂量不当可增加钙磷负荷,容易引起血管钙化,增加心血管事件发生风险,增加患者死亡风险,造成患者预后不佳。Notch1信号通路与血管生成、血管钙化有关,其参与心血管疾病、动脉硬化等多种病理过程[7]。既往研究结果显示,Notch1参与血管钙化发生过程[8]。但是,目前尚无研究分析SHPT患者外周血Notch1水平变化。基于此,本研究采用骨化三醇冲击疗法治疗SHPT患者,分析其对患者外周血PTH、Notch1水平及其血管钙化的影响。
1 资料与方法
1.1 资料来源
选取2019年4月至2022年4月我院收治的尿毒症行MHD治疗并发SHPT患者84例作为观察对象。纳入标准:经影像学检查确诊为尿毒症;符合SHPT相关诊断标准[9];行MHD透析时间≥6个月;免疫功能正常;对本研究使用药物无过敏禁忌证。排除标准:原发性甲状旁腺功能亢进症者;存在严重消化系统障、呼吸系统障碍者;入组3个月未接受维生素D治疗者;存在重要脏器功能障碍者;存在恶性肿瘤者;治疗前合并严重高钙血症者;临床资料不完整者。根据数字表法随机分为常规组(n=42)和观察组(n=42)。常规组患者中,男性23例,女性19例;年龄35~72岁,平均(51.34±6.77)岁。观察组患者中,男性26例,女性16例;年龄36~74岁,平均(52.71±6.83)岁。观察组与常规组患者的临床资料具有可比性。本研究已就研究内容和研究目的与患者及其家属详细沟通,并获得知情同意书。我院医学伦理委员会已批准本项研究开展(批准号:20180307)。
1.2 方法
1.2.1 透析方案:采用HDM99XP型血液透析机(德国IBP公司)进行标准血液透析治疗,1次4 h,1周3次。
1.2.2 骨化三醇治疗方案:两组患者入院后应用碳酸钙或醋酸钙控制血钙和血磷。常规组患者口服骨化三醇软胶囊(规格:0.25 μg)0.25~0.50 μg,1日1次,透析当晚顿服。观察组根据患者PTH水平给予不同剂量骨化三醇,PTH为300~500 pg/mL的患者口服骨化三醇软胶囊(规格同上)0.50 μg,1日1次;PTH>500~1 000 pg/mL的患者口服骨化三醇软胶囊(规格同上)2~4 μg,1周2次;PTH>1 000 pg/mL的患者口服骨化三醇软胶囊(规格同上)4~6 μg,1周2次;透析当晚顿服。根据患者PTH水平调整剂量,直至以最小剂量维持PTH在目标值范围(150~300 pg/mL)。持续治疗6个月。
1.3 观察指标
(1)临床症状:治疗前后,采用问卷调查方式记录患者自觉骨痛、皮肤瘙痒、四肢无力和关节痛等临床症状发生情况。(2)血钙、血磷、PTH和Notch1 mRNA:患者治疗前后清晨空腹静脉血5 mL,离心分离取上清液。采用BIOBASE博科全自动生化仪检测血清中血钙、血磷水平。采用化学发光法检测PTH水平。采用实时荧光逆转录聚合酶链反应(PCR)检测外周血Notch1 mRNA表达,采用密度梯度离心法提取外周血单个核细胞(PBMC),提取RNA提取试剂盒提取PBMC中总RNA,逆转录为cDNA,Notch1上游引物5′-GCCTTCGTGCT CCTGTTCTTTGT-3′,下游引物5′-GGCTCTCTCCGCTTCTTCTT GCT-3′,内参β-actin上游引物5′-GGGACCTGACTGACTA CCTC-3′,下游引物5′-TCATACTCCTGCTTGCTGAT-3′,实时定量PCR仪检测系统扩增产物,以2-△△Ct表示Notch1基因的相对表达量。(3)冠状动脉钙化和心脏瓣膜钙化:①冠状动脉钙化,采用Brilliance 64排128层螺旋CT扫描患者冠状动脉,并使用其自带钙化积分软件计算冠状动脉钙化积分(CACS),CACS=钙化面积×CT峰值系数,以CT值≥130 Hu作为钙化判定阈值,0分为<130 Hu,1分为130~199 Hu,2分为>199~299 Hu,3分为>299~399 Hu为,4分为≥399 Hu。②采用彩色多普勒超声诊断仪检测心脏瓣膜钙化程度,参照改善全球肾脏病预后组织指南推荐的诊断标准[10],当心脏彩超检测发现主动脉瓣、二尖瓣瓣膜或二尖瓣环存在>1 mm的强回声,则判定为心脏瓣膜钙化。(4)不良反应:统计患者治疗期间不良反应(皮肤瘙痒、恶心呕吐和便秘)发生情况。
1.4 疗效评定标准
显效:PTH水平较治疗前下降幅度>75%;有效:PTH水平较治疗前下降幅度为40%~75%;无效:PTH水平较治疗前下降幅度<40%[11]。总有效率为显效率和有效率之和。
1.5 统计学方法
2 结果
2.1 观察组与常规组SHPT患者临床疗效比较
观察组患者的临床总有效率为95.24%,高于常规组的80.95%,差异有统计学意义(χ2=4.086,P=0.043),见表1。

表1 两组患者临床疗效比较[例(%)]
2.2 观察组与常规组SHPT患者治疗前后临床症状缓解情况比较
治疗前,观察组和常规组SHPT患者临床症状(骨痛、皮肤瘙痒、四肢无力和关节痛)发生率比较,差异无统计学意义(P>0.05);治疗后,观察组患者骨痛、皮肤瘙痒、四肢无力和关节痛等症状的发生率明显低于常规组,差异均有统计学意义(P<0.05),见表2。
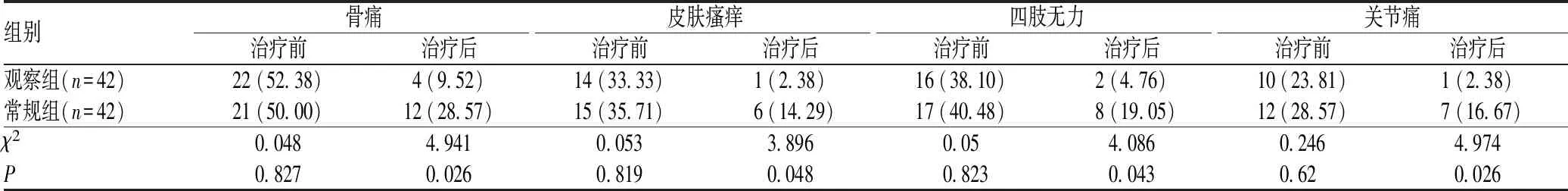
表2 两组患者治疗前后临床症状缓解情况比较[例(%)]
2.3 观察组与常规组SHPT患者治疗前后外周血血钙、血磷、PTH和Notch1 mRNA水平比较
两组患者治疗前血钙、血磷、PTH和Notch1 mRNA水平比较,差异均无统计学意义(P>0.05);治疗后,观察组患者血钙水平高于常规组,血磷、PTH和Notch1 mRNA水平低于常规组,差异均有统计学意义(P<0.05),见表3。
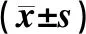
表3 两组患者治疗前后外周血血钙、血磷、PTH和Notch1 mRNA水平比较
2.4 观察组与常规组SHPT患者治疗前后CACS和心脏瓣膜钙化率比较
治疗前,两组患者CACS、心脏瓣膜钙化率的差异均无统计学意义(P>0.05);治疗后,观察组患者CACS、心脏瓣膜钙化率低于常规组,差异均有统计学意义(P<0.05),见表4。
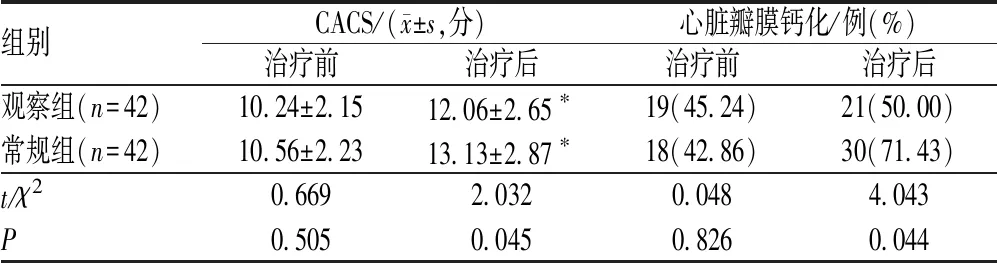
表4 两组患者治疗前后CACS和心脏瓣膜钙化率比较
2.5 观察组与常规组SHPT患者不良反应发生情况比较
两组患者皮肤瘙痒、恶心呕吐、便秘等不良反应总发生率比较,差异无统计学意义(χ2=0.124,P=0.724),见表5。

表5 两组患者不良反应发生情况比较[例(%)]
3 讨论
SHPT是指各种原因导致的低钙血症,刺激甲状旁腺增生肥大,分泌过多PTH的临床综合征,多见于肾功能不全和骨软化患者[12-13]。低钙血症、高磷血症以及1,25二羟维生素D3缺乏是导致SHPT发生的重要原因,临床应用活性维生素D治疗MHD患者,可有效纠正钙磷代谢紊乱,降低SHPT发生风险。但有关活性维生素D的使用剂量尚存在争议。
本研究结果发现,观察组患者的总有效率明显高于常规组,说明相比于常规疗法,骨化三醇冲击疗法疗效更明显。既往有研究结果显示,采用骨化三醇冲击疗法治疗MHD继发SHPT患者,疗效明显提高[14],与本研究结果基本一致。治疗后,观察组患者骨痛、皮肤瘙痒、四肢无力和关节痛等症状发生率明显低于常规组,说明相比于常规疗法,骨化三醇冲击疗法可明显改善患者临床症状。临床采用活性维生素D治疗SHPT以提高血钙水平,并减少PTH分泌为主要目的。本研究进一步发现,治疗后,观察组SHPT患者的血钙水平高于常规组,血磷和PTH水平低于常规组,说明采用活性维生素D治疗MHD继发SHPT患者可有效改善钙磷紊乱,减低PTH水平。骨化三醇属于非选择性活性维生素D受体激动剂,是骨和钙代谢最具有生物学作用的维生素D代谢产物,可促进患者对钙、磷的吸收能力,抑制PTH过度分泌,已成为临床治疗SHPT常用的补充钙剂[15]。PTH是甲状旁腺细胞合成和分泌的激素,与降钙素、维生素D一起调节人体的钙磷代谢,具有升高血钙、降低血磷及调节骨代谢的作用[16]。PTH调节分泌主要受血钙的影响,当血钙持续降低时,易导致甲状旁腺增生,进而使PTH分泌增加。既往研究结果显示,活性维生素D可有效抑制PTH分泌[17]。有研究结果显示,大剂量骨化三醇冲击治疗MHD伴SHPT患者的血清PTH水平明显低于常规剂量治疗者[18],与本研究结果一致,说明根据患者PTH水平给予相应骨化三醇治疗可有效降低血清PTH水平。
血管钙化是一个类似于骨发育和软骨形成的主动调节过程,是多因素共同参与的多环节病理过程,并与骨骼矿物化的生理学特征相似[19]。本研究结果发现,治疗后,观察组患者的CACS、心脏瓣膜钙化率均低于常规组。研究结果显示,高血钙、高血磷是MHD患者发生冠状动脉钙化的独立危险因素,通过控制血磷、血钙水平可缓解血管钙化的发展进程[20]。本研究结果提示,活性维生素D治疗MHD继发SHPT患者,可通过纠正钙磷代谢抑制血管钙化。本研究结果还发现,治疗后,观察组患者外周血Notch1 mRNA水平低于常规组。Notch1信号通路是高度保守的信号转导通路,其被认为与血管钙化有关。既往研究结果显示,外周血单个核细胞Notch1表达水平是影响患者冠脉钙化严重程度的独立危险因素[21]。PTH通过激活Notch1通路导致慢性肾病大鼠心脏瓣膜钙化,推测PTH与Notch1存在一定联系[22]。基于此,结合本研究结果,推测活性维生素D可通过调节Notch1表达水平抑制PTH分泌,进而影响SHPT患者血管钙化程度。本研究中,两组患者不良反应发生率的差异无统计学意义(P>0.05),说明活性维生素D辅助治疗MHD继发SHPT具有一定的安全性。
综上所述,相比于常规治疗法,骨化三醇冲击疗法疗效明显,可改善临床症状,有效调节钙磷代谢,抑制血管钙化,降低PTH、Notch1水平,且具有一定的安全性。但本研究纳入的样本量较小,且样本来源单一,可能存在一定的数据偏差,今后需扩大样本量联合多家研究中心进一步验证本研究观点。
