基于网络药理学和体外实验分析莪术醇抗胶质瘤的作用机制*
2023-11-23韩庆亮郑慧军
韩庆亮,张 慧,杜 康,郑慧军
(1.河南中医药大学第二临床医学院,河南 郑州 450000;2.河南中医药大学第二附属医院神经外科)
源自神经上皮的肿瘤统称为脑胶质瘤(Glioma),占颅脑肿瘤的40.0 %~50.0 %,是最常见的颅内恶性肿瘤。胶质瘤具有病程发展迅速,恶性程度高,手术难以完全切除且容易复发的特点[1]。胶质瘤的复发是降低胶质瘤切除患者的术后生存率的最大原因。在胶质瘤的临床医治疗程中,目前公认的提高患者术后生存率且具有价值的临床方法是术后辅助化疗。在临床上,常用于胶质瘤术后化疗的药物为替莫唑胺,由于肿瘤细胞基因产生变异,逐步会产生耐药性,很大水平上下降了替莫唑胺的疗效[2]。
莪术醇(Curcumol)是从中药莪术挥发油中提取出来的单体化合物,因其抗菌、抗氧化、抗炎、抗癌等特性而被广泛研究,莪术醇的治疗作用仍不断涌现。最近的研究表明,莪术醇对多种实体瘤如乳腺、结直肠、头颈部和肺腺癌具有抗癌作用[3]。潜在的抗肿瘤机制揭示了抑制与细胞增殖、存活、抗凋亡、侵袭和转移相关的几种信号通路(NF-κB、MAPK、PI-3K/AKT和GSK-3β)[4-5]。莪术醇对多种肿瘤有着较好抑制作用,但其抗胶质瘤的作用机制尚不完全明确。
中药的网络药理学为基于网络生物学和多向药理学研究药物在疾病过程中的保护作用及其可能机制提供了新的方法,使探索医学生物网络、进一步阐明人类复杂网络系统成为可能。药物和药物靶点网络的构建不仅为阐明药用植物与疾病的关系提供了一个前瞻性的框架,而且在一定程度上促进了药物的研究、开发和改进[6-7]。因此,本研究通过网络药理学分析莪术醇抗胶质瘤的生物医学靶点及作用机制,明确其成分及相关性质,旨在为进一步药理研究提供参考,为临床治疗及药物研发提供新的视角。
1 材料与方法
1.1网络药理学研究
1.1.1莪术醇化学成分靶点预测 在PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)中,以莪术醇的CAS号(4871-97-04)为关键词进行搜索,查找莪术醇的SDF结构,并下载保存。利用Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/)和TCMSP数据库(https://tcmspw.com/tcmsp.php)搜索莪术醇的潜在靶点,去除重复的靶点,最终合并得到莪术醇的潜在作用靶点。
1.1.2胶质瘤靶点数据库的构建 将“malignant glioma”作为关键词在GeneCareds(https://www.genecards.org/)和OMIM(https://omim.org/)数据库中分别检索出恶性胶质瘤靶点,去除重复的靶点,最终得到胶质瘤的潜在作用靶点。
1.1.3莪术醇-胶质瘤潜在靶点及相互作用网络图构建 将莪术醇的潜在靶点和胶质瘤的作用靶点导入Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/),取交集最终获得“莪术醇-胶质瘤”的交集靶点并绘制韦恩图。将交集靶点导入String数据库(https://cn.string-db.org//),选择物种为“Homo sapiens”,最小相互作用分数设置为0.700,然后获得蛋白互作关系,导出保存为TSV格式的文件。将TSV导入Cytoscape 3.7.2软件绘制蛋白互作网络(PPI)。将得到的TSV文件导入到Cytoscape 3.7.2软件中,利用Network Analyzer功能进行可视化分析。
1.1.4KEGG通路分析和GO分析 使用Metascape(https://metascape.org/)数据库,根据莪术醇-胶质瘤潜在靶点,进行基因本体论(GO)生物学功能注释和京都基因与基因组百科全书(KEGG)通路富集分析,筛选出前10名GO生物学功能和具有代表性的15条KEGG通路。
1.1.5分子对接 为了从分子水平阐明莪术醇的作用模式,我们将莪术醇化合物对接至蛋白口袋。从PubChem数据库下载莪术醇的3D结构,将其作为配体。RCSB PBD数据库(https://www.rcsb.org/)下载关键靶点的受体蛋白三维结构。运用AutoDock vina 1.5.7进行半柔性对接。选取对接结合能量最低的构象用于对接结合模式分析,并使用PyMOL软件(https://PyMOL.org/2/)进行作图。结合能<-5 kcal·mol-1表明结合活性较好,数值越小说明药物小分子与靶蛋白受体结合越稳定。
1.2体外实验验证
1.2.1药材、试剂和仪器 莪术醇(上海艾汇生物科技有限公司,产品批号CC110546,纯度:98 %);胎牛血清(FBS)、MEM培养基均购自美国Gibco公司,产品批号依次是1982146,2041879,MTT试剂盒(武汉博士德生物工程有限公司,批号AR1156),兔抗PI3K、AKT、p-AKT单克隆抗体(Abcam公司),全波长酶标仪(Thermo Fisher公司)。
1.2.2细胞培养与处理 U87细胞株购自上海中国科学院细胞库,进行传代培养。细胞接种于含10 % FBS和MEM(青霉素、链霉素混合液)培养基中,置于37 ℃,5 % CO2细胞培养箱中培养。每2~3 d 换新培养基1次,细胞融合至80 %左右时进行消化传代,当细胞处于对数生长期时,留取细胞进行相关实验操作。
1.2.3检测莪术醇对细胞增殖的影响 取对数生长期的胶质瘤U87细胞,加入不同浓度的莪术醇的培养箱中培养14 d,结晶紫溶液染色后于显微镜下行各组细胞集落计数。
1.2.4MTT法检测U87细胞增殖 取对数生长期的胶质瘤U87细胞悬液接种于96孔板内,37 ℃、5 % CO2培养24 h、分别用不同浓度的莪术醇(50、100、200 μmol·L-1)处理24 h、48 h、72 h后,在培养结束时分别每孔滴加20 μL的0.5 % MTT溶液(20 μL)后继续孵育4 h;吸弃上清液,每孔加入150 μl DMSO,震荡约10 min使结晶产物充分溶解。酶标仪在490 nm波长测定OD值。细胞活性(%)=实验组OD值/空白对照组OD值×100 %。每组重复4次,取平均值。
1.2.5Western blot检测PI3K,AKT,p-AKT蛋白表达水平 将U87细胞用药物(50、100、200 μmol·L-1)处理48 h后,加入蛋白裂解液冰浴条件下裂解,用BCA蛋白浓度测定试剂盒测定总蛋白浓度后,用SDS-PAGE电泳分离蛋白并转移到PVDF膜,TBST洗膜后,用5 %脱脂奶粉封闭1.5 h,加入蛋白特异性一抗稀释液[PI3K(1∶1 000),AKT(1∶1 000),p-AKT(1∶1 000)单克隆抗体4 ℃孵育过夜,相应二抗进一步孵育1.5 h,化学发光仪显影后用Image J检测条带强度。计算各蛋白相对表达量(目的蛋白积分吸光度值/β-actin积分吸光度值)。

2 结果
2.1网络药理学部分
2.1.1莪术醇作用靶点和恶性胶质瘤靶点的确认 使用Pubchem数据库确认莪术醇的结构,通过Swiss Target Prediction数据库和TCMSP数据库,借助Uniprot数据库,对化合物预测产生的靶点进行筛检与检查,剔除重复、非人源与不规范的靶点,最终只得到了102个靶点。借助OMIM、Genecards数据库,以“malignant glioma”为关键词,去除重复靶点,共获得恶性胶质瘤靶点4 821个。
2.1.2关键靶点的网络构建与分析 莪术醇作用靶点与恶性胶质瘤相关靶点韦恩图,见图1。从图1可见,对莪术醇作用靶点和恶性胶质瘤靶点进行交互处理,得到67个共同靶点;利用STRING数据库,进一步构建了莪术醇作用靶点与交互靶点的网络图(图2)。从图2可见,67个交互靶点包括MAPK1、EGFR、MAPK8、MAPK14、JAK3等。且这些靶点与炎症通路、细胞凋亡和增殖分化等有密切关系。对这67个靶点进行网络拓扑学分析,得出莪术醇抗恶性胶质瘤作用靶点的相互关系(图3)。拓扑学分析结果见表1(仅列度值前10靶点)。这些分析结果表明,莪术醇对胶质瘤的作用是多方面的。

表1 莪术醇抗胶质瘤作用靶点的拓扑学分析结果(度值排名前10)

图1 莪术醇靶点与胶质瘤靶点韦恩图

图3 莪术醇抗胶质瘤关键靶点的KEGG通路富集分析
2.1.3莪术醇与胶质瘤互作靶点的GO与KEGG通络富集分析 使用Metascape数据库,根据莪术醇与胶质瘤互作靶点,进行GO生物学功能注释和KEGG通路富集分析(P<0.05)。GO富集结果显示,在细胞生物学过程中,莪术醇抗胶质瘤功能主要集中在对无机物的反应、系统过程的调节、分泌的调节、细胞对含氮化合物的反应、蛋白质磷酸化、突触信号传递、对激素的反应、细胞分泌的调节、化学突触传递、顺行跨突触信号传递。分子功能主要富集在蛋白丝氨酸/苏氨酸/酪氨酸激酶活性、蛋白激酶活性、磷酸转移酶活性,醇类为受体、蛋白丝氨酸/苏氨酸激酶活性、蛋白丝氨酸激酶活性、蛋白酪氨酸激酶的活性、G蛋白偶联腺苷受体活性、非跨膜蛋白酪氨酸激酶活性、G蛋白偶联阿片类受体的活性等方面,在细胞组分主要富集在突触后、轴突、突触膜、神经元细胞体、树突、树突树、细胞体、膜筏、膜微域、突触后膜等。见图4。

图4 莪术醇抗胶质瘤关键靶点的GO生物功能富集分析
KEGG通路分析显示,与胶质瘤相关的主要有癌症通路、神经活性配体-受体信号通路、PI3K-Akt信号通路、FoxO信号通路、JAK-STAT信号通路、神经变性-多发性疾病通路、鞘脂信号通路、孕激素介导的卵母细胞成熟、催乳素信号通路、神经营养素信号通路、生长激素合成、分泌和作用、EGFR酪氨酸激酶抑制剂耐药等。功能分析数据显示,这些预测的靶点调节细胞增殖、分化、凋亡。这表明莪术醇主要可能通过PI3K-Akt、JAK-STAT、MAPK信号通路来调控胶质瘤的生物学过程。KEGG富集分析结果按照-log10(P值)排序,选取前10条目,绘制气泡图(图3)。其中P值越小,提示越可能是莪术醇抗胶质瘤主要作用机制。
2.1.4分子对接 利用AutoDock vina 1.5.7对核心靶点蛋白与莪术醇化合物进行分子对接,用PyMOL可视化(表2, 图5);根据两者结合能评价其结合稳定性,结合能越小结合越稳定;当结合能<-5.0 kcal/mol,表明结合活性良好,结合能<-7.0 kcal/mol,表明结合较稳定。

表2 各配体受体最低结合能
2.2体外实验部分
2.2.1莪术醇对U87细胞生长状态的影响 随着莪术醇浓度增加,细胞数量有减少趋势,表明莪术醇可抑制肿瘤细胞增殖。见图6。
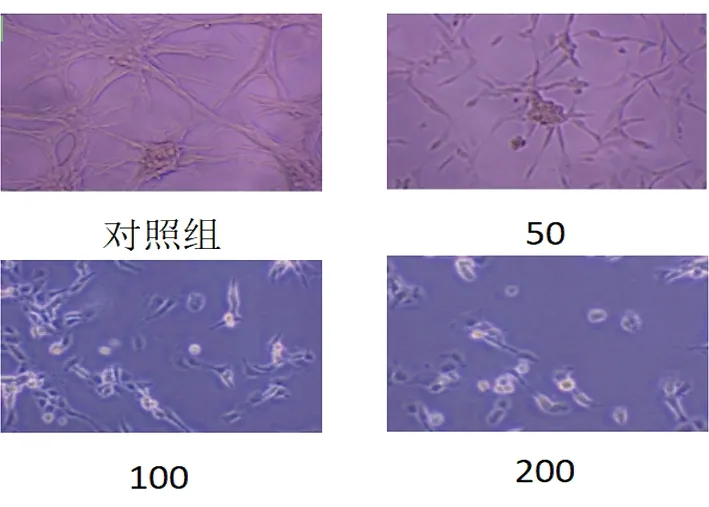
图6 莪术醇对U87细胞生长的影响比较
2.2.2莪术醇抑制胶质瘤U87细胞增殖 结果显示,与对照组比较,在莪术醇浓度为50 μmol/L时,其增殖抑制活性增强,呈时间浓度依赖性(P<0.01)。细胞增殖抑制率见表3。

表3 不同浓度莪术醇作用不同时间对U87细胞增殖的影响(n=4,%)
2.2.3莪术醇对U87细胞PI3K/AKT信号通路的影响 Western blot结果显示,不同浓度的莪术醇处理U87细胞48 h后,细胞内PI3K,p-AKT,AKT的蛋白表达水平见表4、图7。随着莪术醇浓度的增加,与对照组相比,U87细胞中p-AKT蛋白表达下降(P<0.01),呈浓度依赖关系。

表4 莪术醇作用48 h后PI3K、Akt、p-Akt蛋白表达量(n=4)

图7 莪术醇处理后PI3K,p-AKT,AKT蛋白表达水平的变化
3 讨论
胶质瘤是神经系统最常见的恶性肿瘤,占成人颅内肿瘤的45 %~50 %,在儿童恶性肿瘤中仅次于白血病,是十大恶性肿瘤中最难治疗的肿瘤之一。胶质瘤具有病程发展迅速,恶性程度高,手术难以完全切除且容易复发的特点。我国传统的中医中药有着自己独特的治疗优势和治疗特点,从而在现代对肿瘤的治疗中发挥着愈来愈重要的作用。研究发现莪术醇在抗肿瘤方面起到了积极作用,具有包括抗肿瘤作用在内的多种药理活性,但是莪术醇在抗胶质瘤方面的研究较少。为了研究莪术醇抗胶质瘤方面的作用机制,本研究利用网络药理学,通过构建“药物-活性成分-靶点”“核心靶点互作”等网络,多方面、多层次深入研究莪术醇治疗胶质瘤的潜在靶点及作用机制,并进行实验验证。通过构建“药物-活性成分-靶点”网络发现MAPK1、MAPK14、EGFR、MAPK8、JAK3是其潜在的关键治疗靶点。GO功能分析数据显示,这些预测的靶点调节细胞增殖、分化、凋亡。从实验中可以得出不同浓度的莪术醇作用于U87细胞,p-AKT表达水平相对于对照组水平下降明显,呈浓度依赖关系,这表明莪术醇对PI3K/AKT信号通路有着抑制作用。
MAPK1、MAPK8、MAPK14都属于MAP激酶家族。MAP激酶又称细胞外信号调节激酶(ERK),是多种生化信号的整合点,参与多种细胞过程,如增殖、分化、转录调控和发育。这种激酶的激活需要上游激酶的磷酸化。MAPK8激酶被各种细胞刺激激活,并靶向特定的转录因子,因此介导响应细胞刺激的早期基因表达。肿瘤坏死因子α(TNF-α)激活该激酶是TNF-α诱导的细胞凋亡所必需的[8]。该激酶还参与紫外线辐射诱导的细胞凋亡,这被认为与细胞色素C介导的细胞死亡途径有关,对该基因的小鼠对应物的研究表明,该激酶在T细胞增殖中起关键作用[9]。通过Xu[10]研究,可知MAPK8通过MAPK信号通路介导对替莫唑胺的耐药和胶质母细胞瘤细胞的凋亡,这表明莪术醇亦可以调控胶质瘤的凋亡,以及降低化疗药物的耐药性。在LI[11]的研究中,关键靶点MAPK8可以通过调节免疫炎症反应来调控胶质瘤的发生发展。Luo[12]研究表明可通过MAPK8消融对胶质瘤细胞凋亡和铁死亡的影响。Wang[13]表明MAPK8基因还可以预测多形性胶质母细胞瘤存活率。MAPK14激酶被各种环境压力和促炎细胞因子激活,主要是通过MAP激酶激酶(MKK)对其进行磷酸化,或者由MAP3K7IP1/TAB1蛋白与该激酶的相互作用触发其自身磷酸化。该激酶的底物包括转录调节因子ATF2、MEF2C和MAX、细胞周期调节因子CDC25B和肿瘤抑制因子p53,这表明该激酶在应激相关转录和细胞周期调节以及基因毒性应激反应中的作用[14]。炎症刺激可激活MAPK,而P38MAPK也可以调节TNF、IL-1和IL-6等致炎因子以及IL-12等抗炎因子的生成,影响生物体内致炎与抗炎因素的平衡,从而决定炎症反应的进程[15]。
EGFR蛋白是一种跨膜糖蛋白,是表皮生长因子受体家族中的一员,EGFR作为细胞表面蛋白可与配体如表皮生长因子(EGF)结合,EGFR可被激活,由单体转化为二聚体以及发生自体酪氨酸磷酸化,激活后的EGFR可以再磷酸化下游蛋白,包括调控细胞存活的PI3K-AKT-mTOR信号通路和调控细胞增殖的RAS-RAF-MEK-ERK信号通路,EGFR的突变和表达水平的升高与多种癌症相关,其中肺癌最为常见[16]。因此EGFR作为胶质母细胞瘤和其他胶质瘤的临床标志物,可通过磷酸果糖激酶-1激活PI3K来增强或促进肿瘤细胞的增殖与脑肿瘤的发生[17]。在Erira[18]的研究中可知EGFR在PI3K/AKT/PTEN通路的改变在胶质瘤的发生和恶性进展中可能很重要。
JAK3基因所编码的蛋白是一种受体酪氨酸激酶,是Janus激酶家族的一员,JAK3主要表达在免疫细胞中,在被白介素激活后通过酪氨酸磷酸化传递信号。JAK/STAT是一条非常重要的信号通路,许多细胞因子如IFN、IL-2等和生长因子如EGF、CSF等都通过该信号传导途径诱导细胞的增殖、分化和凋亡[19]。JAK/STAT的激活与肝癌、胃癌密切相关。JAK3可激活下游的信号转导和转录激活因子3(STAT3),STAT3在调节抗肿瘤免疫反应中发挥着核心作用,STAT3在肿瘤生态系统内的癌症和非癌细胞中都被广泛过度激活,并在抑制关键免疫激活调节因子的表达和促进免疫抑制因子的产生方面发挥重要作用[20-21]。下调SOCS3基因表达可使JAK/STAT通路失活而减弱胶质母细胞瘤(glioblastomas,GBM)的血管生成[22]。Ventero等[23]发现信号JAK/STAT转导通路与克服GBM辐射抗性有关。也有研究结果[24]表明,降低胶质瘤细胞中p-STAT3的表达水平对胶质瘤细胞的迁移和侵袭有明显的抑制作用。
KEGG富集分析得到的共同靶基因富集程度最高的信号通路为PI3K/Akt/mTOR信号通路。该信号通路可在多种细胞生理活动中发挥作用,如:细胞的代谢、增殖、生长、凋亡等基本的生理活动[25]。PI3K在人类癌症中的致病作用已被证明,在来自结肠癌和卵巢癌的细胞系中发现了PI3K的调节因子的突变,促进了科学家们对其在其他类型肿瘤中的研究。PI3K/Akt/mTOR信号通路在包括GBM在内的大多数高级别脑肿瘤中已被证实,PI3K通路的激活参与肿瘤由低级向高级转移。PI3K通路在胶质瘤中的作用最有力的证据是PI3K通路关键因子的激活不仅与GBM患者的生存期降低有关[26],而且还导致更多的侵袭性胶质细胞,从而产生更侵袭性的胶质瘤和对放疗的抵抗[27]。目前专家与学者的共识是“下游分子Akt会使细胞膜上的靶蛋白发生磷酸化,并调节细胞生长相关的蛋白激酶代谢”。正如富集分析所显示的,它与共同靶基因的功能、细胞定位和生物过程相一致,分子对接验证得出关键核心靶点的受体蛋白都能与核心活性成分较稳定地自发结合,由此可以推测,莪术醇可能作用于MAPK1、MAPK14、EGFR、MAPK8、JAK3的受体,从而达到治疗胶质瘤的效果。由此可见,莪术醇治疗胶质瘤的机制预测结果具有一定的可靠性。
在这项基于药理学网络的研究中,我们研究了莪术醇在胶质瘤中的潜在治疗机制。结果突出了莪术醇抗胶质瘤的炎症反应、对细胞增殖与凋亡和免疫影响,其余主要下调p-AKT蛋白来抑制PI3K/AKT通路。此外,我们为莪术醇治疗胶质瘤提供了多个潜在的靶点,这可能有助于开发新的治疗策略。然而,莪术醇抗胶质瘤的深入机制仍需要进一步阐明。
