MR-DTI参数评估神经内镜手术与微创钻孔引流术治疗中等量基底节区脑出血
2023-11-23崔述坤高祥亮杜国良宋建抢
刘 彬 崔述坤 高祥亮 张 刚 杜国良 宋建抢
沧州市中心医院,河北 沧州 061000
基底节区是高血压脑出血中最常见的发病部位之一,且基底节区脑出血起病急骤、病理进展较快,具有较高的致残率及致死率,是危害人类生命安全的重大疾病之一[1-2]。目前,神经内镜手术与微创钻孔引流术是中等量基底节区脑出血患者治疗的常用术式,在减少手术创伤的同时,可实现脑血肿的快速清除,进而减少脑血肿压迫颅内神经及颅内组织,改善患者预后[3-4]。而关于神经内镜手术与微创钻孔引流术在中等量基底节区脑出血治疗中的效果比较及预后评估报道较少,本研究分析神经内镜手术与微创钻孔引流术在中等量基底节区脑出血治疗中的优缺点,为后续临床术式的合理选择提供理论依据。
1 资料与方法
1.1 临床资料选取沧州市中心医院神经外科2022-01—2022-06 收治的基底节区脑出血患者80例,其中女38 例,男42 例,年龄49~72(57.63±4.02)岁。纳入标准:(1)均符合《中国脑出血诊治指南(2019)》[5]中脑出血的临床诊断;(2)头颅CT 扫描发病部位均为基底节区;(3)中等量基底节区脑出血,血肿量40 mL 左右;(4)均接受磁共振弥散张量成像技术(MR-DTI)检查;(5)均为高血压病人,入院舒张压>90 mmHg(1 mmHg=0.133 kPa)、收缩压>140 mmHg;(6)入院格拉斯哥昏迷指数(GCS)评分5~13 分;(7)临床资料完整且研究经院内医学伦理委员会审批。排除标准:(1)颅内肿瘤;(2)颅脑外伤;(3)颅内脑血管畸形;(4)痴呆、癫痫等精神类疾病史;(5)合并脑疝;(6)静脉血栓、肿瘤等非高血压脑出血;(7)合并肝、肾等重要器官衰竭或身体素质极差无法耐受手术;(8)凝血功能检测异常或入院前持续使用抗血小板药、抗凝药等超过1周;(9)临床资料缺失。分为内镜组(40 例)和钻孔组(40 例)。80例患者分为内镜组(40 例)和钻孔组(40 例),2 组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。见表1。
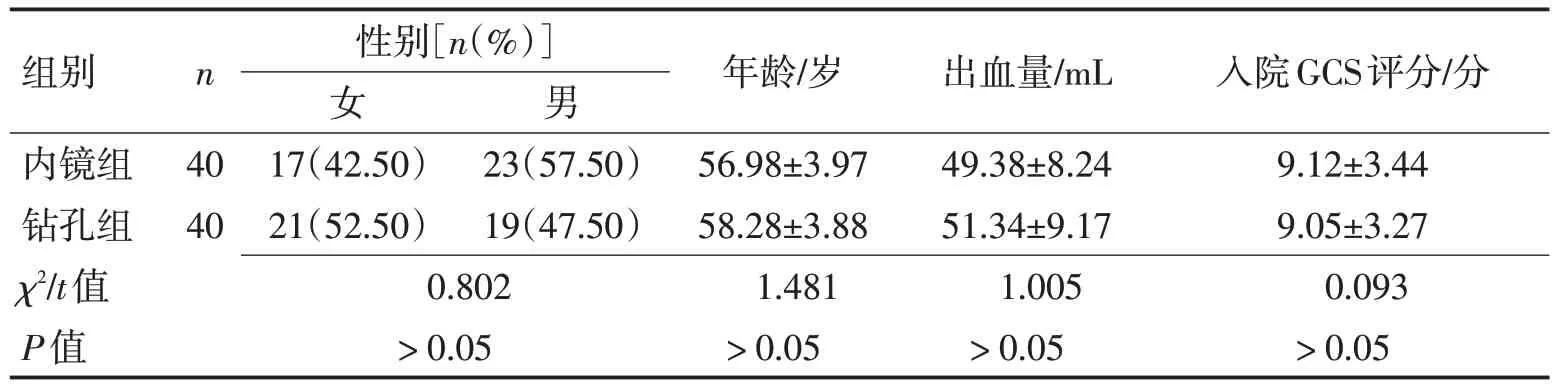
表1 2组患者一般资料比较Table 1 Comparison of general information of patients in the two groups
1.2 手术方法内镜组采用神经内镜手术治疗:术前行气管插管全身麻醉。依据术前CT 定位血肿位置选择手术切口部位,沿血肿长轴设计手术入路,做发际线内弧形切口,逐层分离皮肤、肌肉及骨膜。使用颅钻做直径3 cm的骨窗,悬吊硬膜,电凝止血。采用Y 型切口将硬膜剪开,使用脑穿刺针探测血肿部位,并沿穿刺针置入0°神经内镜及透明工作鞘。吸引器吸出血肿,血肿腔壁内吸附紧密血块不可强行清除以避免继发出血,并对腔壁内活动性出血点进行电凝止血。清除大部分可见血肿后,使用常温生理盐水冲洗血肿腔,无活动性出血后缓慢撤出工作套筒,贴敷止血材料。逐层缝合手术创口,术毕。术后予以预防感染、控制水电解质平衡等常规治疗。钻孔组采用微创钻孔引流术治疗:术前局部麻醉。依据术前CT定位血肿位置选择手术切口部位,切开头皮,分离骨膜。使用颅钻钻一骨孔,十字切开脑硬膜,使用F12带芯颅脑外引流管穿刺血肿至血肿最大层面中点,见暗红色血液自引流管流出后拔除内芯,采用20 mL 注射器缓慢抽取血肿,术中控制血肿抽吸力度以避免继发出血,不做勉强吸除。距离切口约3cm处做皮下潜行后固定引流管。术后6 h复查头CT,将尿激酶5万U溶于5 mL生理盐水,经引流管向血肿腔注射,关闭引流管3 h后打开引流管,引流血肿,尿激酶注射频率1次/d,维持注射3 d。术后予以预防感染、控制水电解质平衡等常规治疗。
1.3 MR-DTI 检查术前及术后3 个月,行MR-DTI检查,采集MR-DTI单次激发自旋回波-平面回波时间224 s,使用PRIDE 软件分析获取各向异性分数(fractional anisotropy,FA)图,参考对应层面T2W1图,在FA图上血肿下方达到脚区椎体束行程区双侧对位,设置感兴趣区(region of interest,ROI),重复测量FA 3次,取中位数。
1.4 观察指标(1)根据MR-DTI 检查结果,比较2组的FA 值;(2)手术相关指标:记录2 组患者术中出血量、手术时间、血肿清除率;(3)并发症发生率:记录2组患者术后2周内颅内感染、再出血、肺部感染、消化道出血发生率;(4)预后评估:术后、随访3个月,记录患者病死率,并采用格拉斯哥预后评分(Glasgow coma scale,GOS)[6]标准对2 组预后进行评估,GOS 总分5 分,1 分为死亡,2 分为植物生存仅有睁眼等微小反应,3分为重度残疾但意识清醒,4分为轻度残疾可独立生活,5分为恢复良好或仅存轻度缺陷;(5)2组患者术前及术后第1天影像学观察比较。
1.5 统计学方法所有数据采用SPSS 23.0 进行统计学分析,计量资料以均数±标准差(±s)表示,采用t检验。计数资料以率(%)表示。采用Pearson相关性分析法分析FA值与GOS评分的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 2 组患者术前及术后影像学比较术后第1 天复查头CT,神经内镜手术组患者的血肿残存率明显低于钻孔引流组,见图1。术后3 个月MRI-DTI 影像学直观显示,神经内镜手术组患者患侧残存神经纤维束较术前更为稀疏,而钻孔引流组患者患侧残存神经纤维束较术前变化不明显,见图2。

图1 2组患者术前及术后影像Figure 1 Preoperative and postoperative imaging pictures of different surgical
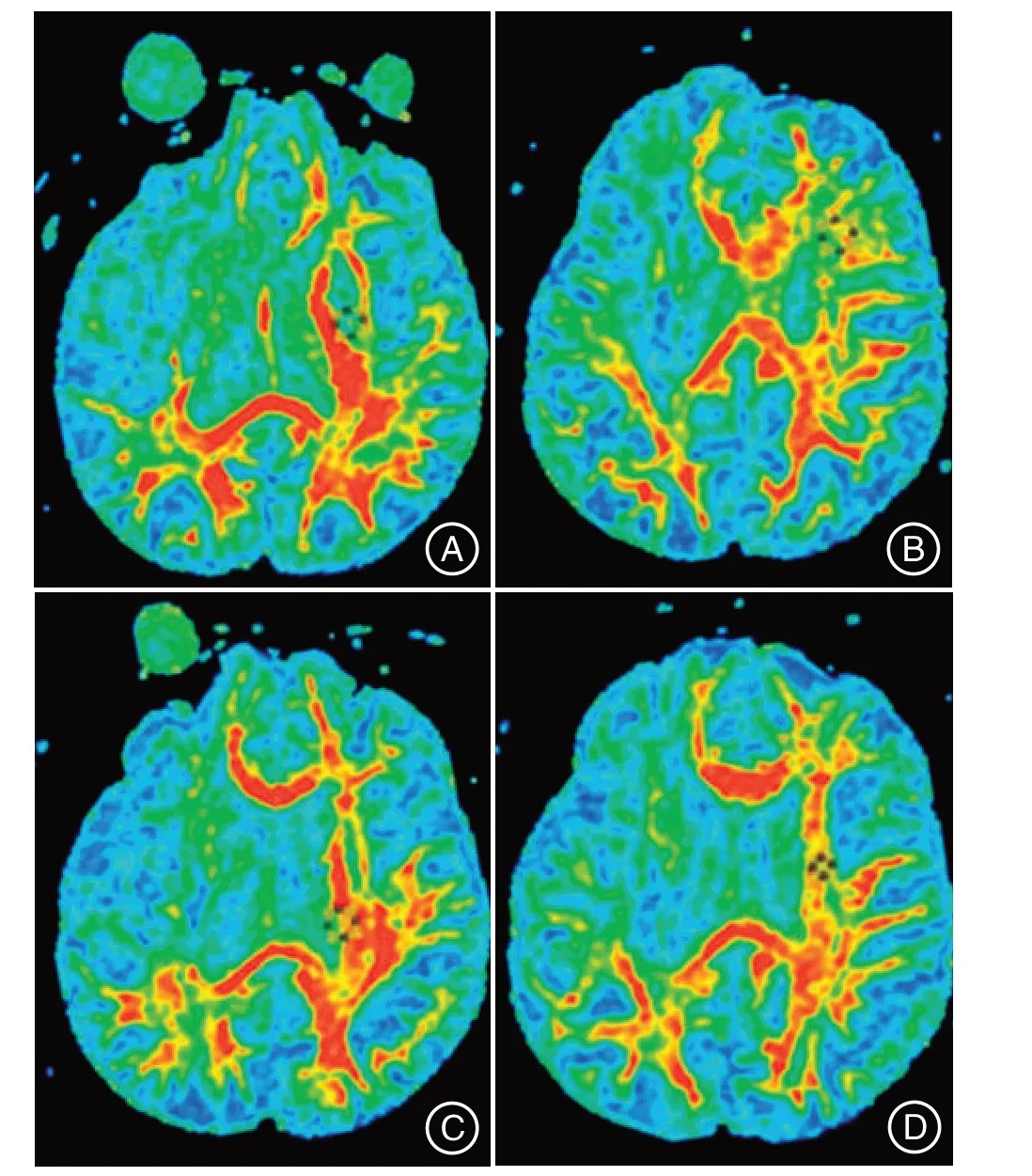
图2 2组患者术前及术后3个月MR-DTI影像Figure 2 Images of MR-DTI before and 3months after operation in the two groups
2.2 2组患者术前及术后FA值比较2组术后患侧FA值均低于术前(P<0.05),内镜组低于钻孔组(P<0.05),见表2。
表2 2组患者术前及术后FA值比较 (±s)Table 2 Comparison of FA values before and after operation in the two groups (±s)
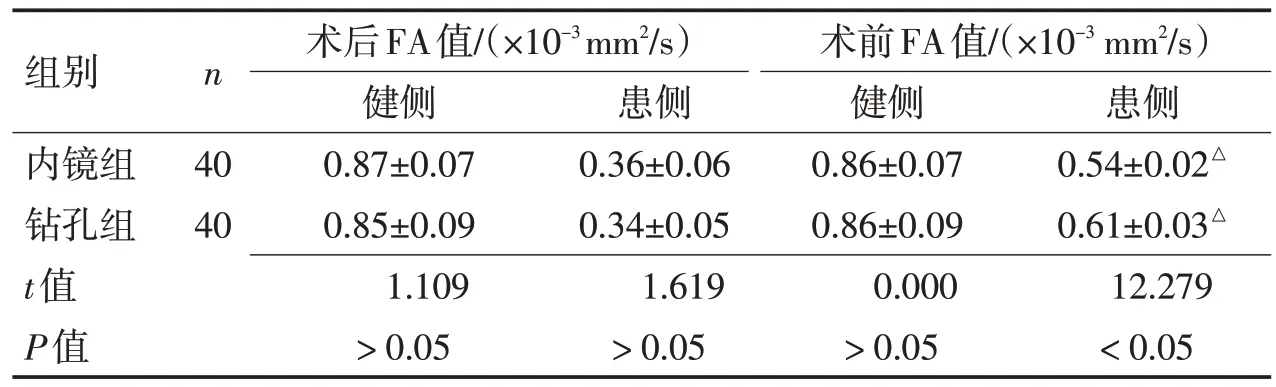
表2 2组患者术前及术后FA值比较 (±s)Table 2 Comparison of FA values before and after operation in the two groups (±s)
注:与术前相同部位比较,△P<0.05。
组别内镜组钻孔组t值P值n 术后FA值/(×10-3mm2/s)健侧0.87±0.07 0.85±0.09 1.109>0.05术前FA值/(×10-3 mm2/s)健侧0.86±0.07 0.86±0.09 0.000>0.05患侧0.54±0.02△0.61±0.03△12.279<0.05 40 40患侧0.36±0.06 0.34±0.05 1.619>0.05
2.3 2组患者手术相关指标比较内镜组术中出血量、手术时间、血肿清除率均高于钻孔组(P<0.05),见表3。
表3 2组患者手术相关指标比较 (±s)Table 3 Comparison of surgery-related indicators between the two groups of patients (±s)
组别内镜组钻孔组t值P值n 40 40术中出血量/mL 61.04±8.95 10.29±2.14 34.879<0.05手术时间/min 104.63±18.59 29.86±7.48 23.599<0.05血肿清除率/%88.39±15.42 71.06±7.59 6.377<0.05
2.4 2组患者术后并发症发生率比较内镜组颅内感染发生率低于钻孔组(P<0.05);2组再出血、肺部感染、消化道出血及总并发症发生率比较差异无统计学意义(P>0.05),见表4。
2.5 2 组患者术后病死率及GOS 评分比较2组术后病死率比较差异无统计学意义(P>0.05);内镜组GOS评分低于钻孔组(P<0.05),见表5。
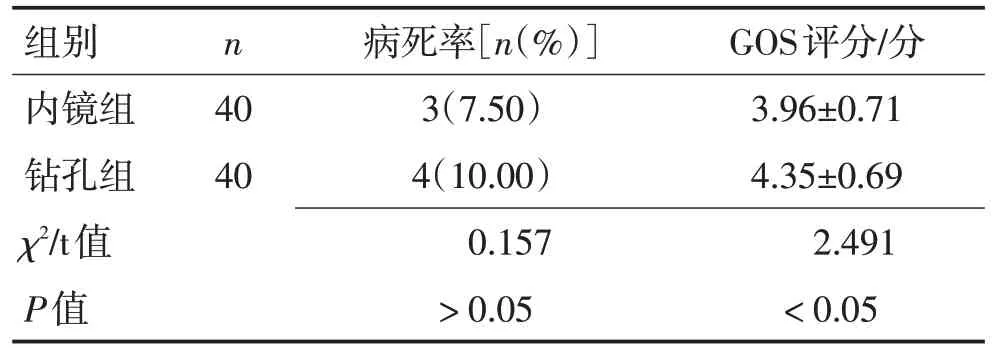
表5 2组患者术后病死率及GOS评分比较Table 5 Comparison of postoperative mortality and GOS scores between the two groups
2.6 FA 值与GOS 评分的相关性分析Pearson 分析显示,FA 值与GOS评 分 呈 显 著 正 相 关(r=0.572,P<0.05),见图3。
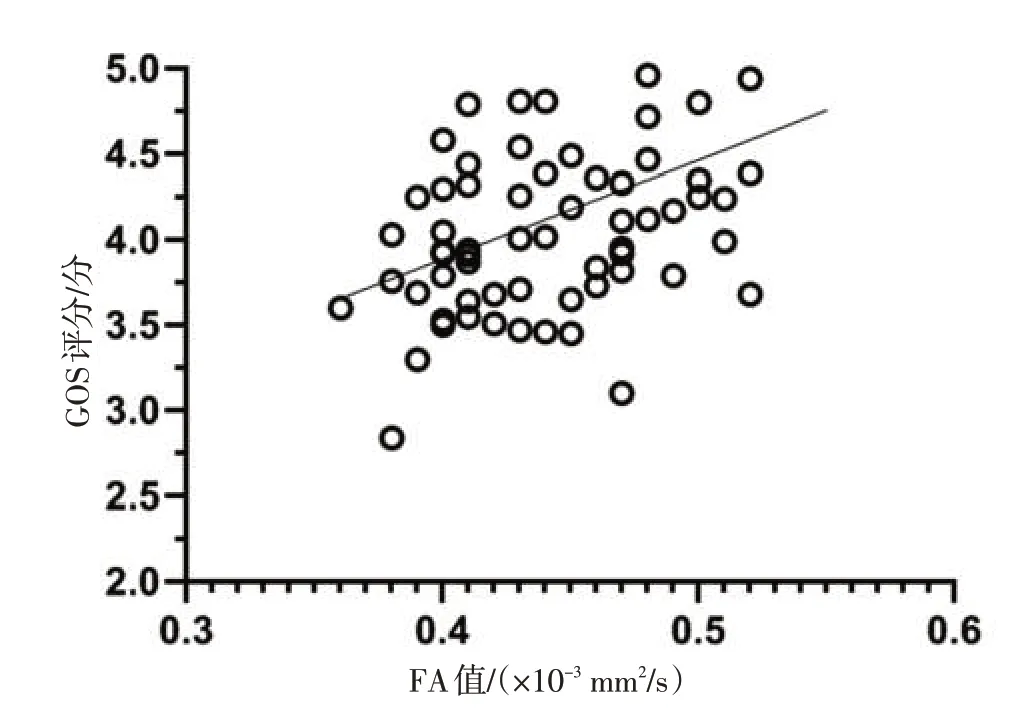
图3 FA值与GOS评分的相关性分析Figure 3 Correlation analysis between FA value and GOS score
3 讨论
基底节区脑出血后,短期内可形成颅内血肿,压迫颅内组织和神经,进而导致颅内血液循环及脑细胞代谢异常,且血凝块可诱导凝血酶的聚集、炎症因子的降解等,加重神经损伤,诱导病理进展、迁延预后[7-10]。此外,相关研究提出,基底节区脑出血后脑组织缺血性坏死、脑水肿、血肿分解产物等病理性改变均可引起颅内皮质脊髓束(corticospinal tract,CST)的继发性损伤,且CST状态与神经功能恢复密切相关[11-12]。因此,早期研究中部分国内学者认同外科积极治疗基底节区脑出血的目的在于尽早解除脑血肿对CST 的过度压迫,从而控制基底节区脑出血的病理生理进展或最大程度的缩短病理进展时间,改善预后。
神经内镜手术是基底节区脑出血治疗中常用的微创手术之一,可借助内镜技术实现脑血肿部位的清晰勘测,兼顾清除血肿、降低颅内压等优点,可尽快解除脑血肿对CST 压迫损伤[13-15]。微创钻孔引流术相对于神经内镜手术,术中切口更小,具有手术时间短、出血量少、操作简便等优点,更有助于促进患者术后恢复[16-18]。此外,DTI 是活体评估CST 状态的影像学方法,以活体组织中水分子的弥散运动的各项特异性为理论基础,可准确评估脑出血后脑血肿压迫所致的CST 损伤,同时可在一定程度上反映患者神经功能恢复情况[19-22]。其中FA是DTI检测中水分子弥散的各项异性与总弥散张量之比,可反映神经纤维束的致密性和髓鞘完整性,FA 值越小提示神经纤维损伤程度愈加严重[23]。本研究结果显示,内镜组术后患侧FA值低于钻孔组,提示内镜组患者术中CST损伤更为严重。内镜组术中出血量、手术时间、血肿清除率均高于钻孔组,表明神经内镜手术应用于中等量基底节区脑出血治疗中,术中出血量更大且手术时间更长,但血肿清除率明显高于微创钻孔引流术治疗方案。研究分析,针对长轴为主的基底节区血肿,内镜勘测下存在一定的视野盲区,可能是导致血肿清除不彻底的原因[24-25]。此外,神经内镜手术应用于基底节区脑出血治疗中,术中电凝止血及血肿清除均不可避免的会对CST造成损伤,虽实现了血肿的大面积清除,但可能对患者术后神经功能恢复造成不利影响[26-28]。本研究中,钻孔组术后3 个月患者的FA 值高于内镜组,术后3 个月GOS评分高于内镜组,且FA值与GOS评分呈显著正相关,进一步证实了上述分析。但微创钻孔引流术同样存在缺陷,该术式无法做到及时有效的止血,对于CT影像中漩涡征明显的患者,该术式可能导致患者术后出血的风险更高,且随着出血风险增加可能进一步引起颅内感染等连锁反应。本研究结果显示,钻孔组中术后颅内感染发生率15.00%,而内镜组术后出血发生率仅2.50%,提示基底节区脑出血患者应用微创钻孔引流术后很可能会增加颅内感染风险。因此,针对发病时间<6 h的基底节区脑出血患者,可优先选择神经内镜手术。但本研究中2组患者的病死率及总并发症发生率比较差异无统计学意义,进一步表明神经内镜手术及微创钻孔引流术应用于中等量基底节区脑出血患者的治疗中整体安全性均良好。
神经内镜手术治疗,有助于提高患者脑血肿清除率,但术中创伤较大,而微创钻孔引流术应用于中等量基底节区脑出血治疗中,术中创伤更小,更有助于促进患者恢复。MR-DTI 定量参数可用于评估中等量基底节区脑出血患者的神经功能且与预后密切相关。
利益冲突:所有作者均声明不存在利益冲突
