沙库巴曲缬沙坦联合伊伐布雷定治疗老年左室射血分数降低型心力衰竭的疗效及对左心室重构的影响
2023-11-23刘静付红晋辉王中明曾辉韩风杰杭晓阳周庆庆朱艳霞郑海军
刘静 付红 晋辉 王中明 曾辉 韩风杰 杭晓阳 周庆庆 朱艳霞 郑海军
新乡医学院附属焦作市人民医院心内科(河南焦作 454002)
《2014中国心力衰竭诊断和治疗指南》[1]指出,血管紧张素转化酶抑制剂(ACEI)+β受体阻滞剂+醛固酮受体拮抗剂,合称“金三角”,应作为治疗慢性射血分数降低型心力衰竭(HFrEF)患者首选的基本治疗方案。随后的临床实践证实,虽然此方案在一定程度上能缓解HFrEF患者的临床症状及改善心功能,但HFrEF患者的1年全因病死率仍超过20 %[2]。因此,HFrEF的治疗亟需探寻新的干预靶点和治疗药物。已有临床研究[3]证实,沙库巴曲缬沙坦作为全球首个血管紧张素受体和脑啡肽酶双重抑制剂(ARNI),可改善心功能,预防或逆转心室重构,降低HFrEF患者的心衰住院率和病死率,疗效优于“金三角”。然而,心室重构由多种机制多种因素共同作用的结果,目前研究[4-5]关于ARNI治疗心室重构多是从单一或少数指标进行观察,从多个作用途径着眼、多种指标系统观察逆转心室重构作用机制的相关研究少见报告。因此,本研究以伊伐布雷定+曲美他嗪为对照,旨在观察沙库巴曲缬沙坦+伊伐布雷定+曲美他嗪对于老年HFrEF患者的心功能、心室重构、神经内分泌因子、心肌能量代谢、炎性因子、心肌纤维化水平的影响。随访6个月内不良心血管事件,回顾治疗前上述指标与心功能和心室重构指标的相关性,探讨上述相关指标治疗前水平对6个月后不良心血管事件预测价值。
1 对象与方法
1.1 研究对象入选标准:(1)年龄≥ 60岁;(2)HFrEF符合《2018中国心力衰竭诊断和治疗指南》[6]的诊断标准;(3)美国纽约心脏病协会(NYHA)心功能分级Ⅱ-Ⅳ级,左心室射血分数(LVEF)≤ 40%,且时间超过3个月;(4)静息窦性心率≥ 75次/min;(5)认知功能正常,治疗依从性良好;(6)患者及家属知情本研究内容并签署知情同意书。本研究经焦作市人民医院医学伦理委员会审核批准(编号:201912)。排除标准:(1)合并急性心肌梗死、心肌炎、心包疾病、心脏瓣膜病、肥厚型心肌病及限制型心肌病、先天性心脏病、急性失代偿期心力衰竭、恶性心律失常、心动过缓、严重低血压或心源性休克;(2)既往冠脉搭桥术、心脏移植术或安装起搏器;(3)合并严重肝肾功能障碍、严重急慢性感染、甲状腺功能异常、血液系统疾病、自身免疫系统疾病、凝血功能障碍及恶性肿瘤;(4)高钾血症;(5)近2个月内应用过糖皮质激素或免疫抑制剂,对本研究所用药物过敏;(6)合并精神异常或认知功能障碍,无法沟通交流者;(7)用药过程中因出现严重不良反应(如症状性低血压、血管神经性水肿等)而停药,未按照研究方案接受治疗、中途自行退出或临床资料不全。2020年1月至2022年6月,在焦作市人民医院心内科住院部选取148例冠心病或高血压并发HFrEF患者进行前瞻性研究,按照随机数表法将患者分为两组:对照组72例,男44例,女28例;年龄(72.7 ± 6.4)岁;体质量指数(25.1 ± 2.5)kg/m2;合并症:糖尿病23例,高血压38例;原发病:缺血性心脏病39例,高血压心脏病33例;NYHA心功能分级:Ⅱ级25例,Ⅲ级38例,Ⅳ级9例。观察组72例,男40例,女32例;年龄(73.4 ± 5.2)岁;体质量指数(25.3 ± 2.1)kg/m2;合并症:糖尿病25例,高血压35例;原发病:缺血性心脏病42例,高血压心脏病30例;NYHA心功能分级:Ⅱ级27例,Ⅲ级35例,Ⅳ级10例。
1.2 治疗方法两组HFrEF患者均给予抗心力衰竭的规范化治疗,包括去除诱因、调节饮食与生活方式、卧床休息、合理吸氧、硝酸酯类药物扩张冠状动脉、利尿剂、降脂、抗血小板聚集等。对正在服用ACEI或血管紧张素Ⅱ受体阻滞剂(ARB)的患者需停药36 h进行药物洗脱。对照组患者给予曲美他嗪片(南京正科医药股份有限公司,国药准字H20083803)口服,20 mg/次,3次/d,饭后服用;盐酸伊伐布雷定片(可兰特,Les Laboratoires Servier Industrie,H20150217)起始剂量2.5 mg/次,2次/d。根据心率调整用量,最大剂量7.5 mg/次,2次/d。使患者静息心率控制在60次/min左右,不宜低于55次/min。观察组在对照组治疗方案的基础上加服沙库巴曲缬沙坦钠片(Novartis Pharma Schweiz AG,批准文号H20170362),起始剂量50 mg/次,2次/d。如收缩压≥ 95 mmHg,根据患者耐受情况每2 ~ 4周剂量逐渐加倍,直至达到目标计量200 mg/次,2次/d,并以该剂量维持用药。密切监测血压,每月检测肾功能、血钾等。两组均连续治疗6个月。
1.3 观察指标
1.3.1 临床疗效治疗6个月后参照《欧洲心脏病学会心力衰竭协会2019指南》[7]标准评定疗效:显效:呼吸困难症状明显改善,NYHA心功能分级提高≥ 2级;有效:呼吸困难症状有所缓解,NYHA心功能分级提高1级;无效:呼吸困难症状无变化甚至加重,NYHA心功能分级未提高甚至加重。总有效率=(显效+有效)例数/总例数×100%。
1.3.2 超声检测分别于治疗前及治疗6个月后,由同一位经验丰富超声专业医师按照《中国成年人超声心动图检测指南》,采用德国西门子ACUSON SC2000彩色多谱勒超声诊断系统,于心尖四腔切面应用Simpson “双平面”法,测量左心室舒张末期室间隔厚度(IVSTd),左心室收缩末期后壁厚度(LVPWTs),左心室质量(LVM,g) = 0.8 ×1.04 × [(LVEDD + LVPW + IVST)3- LVEDd3] +0.6;体表面积(m2) = 0.006 1 × 身高(cm) + 0.012 8× 体质量(kg) - 0.152 9[1];并根据Devereux[8]校正公式计算左心室心肌质量指数(LVMI,g/m2) = LVM(g)/体表面积(m2);(2)心功能指标:测量左心室收缩末期内径(LVESd),左心室舒张末期内径(LVEDd),并计算心排血指数(CI)(L/min/m2) = 每分心输出量(L/min)/体表面积(m2);心肌能量代谢指标:左室收缩末期圆周室壁应力(cESS)、心肌能量代谢(MEE)水平根据心脏超声检测结果进行计算,cESS ={收缩压 × (LVESD/2)2× [1 + (LVESD/2+ LVPWTs)2/(LVESD/2 + LVPWTs/2)2]}/[(LVESD/2+ LVPWTs)2- (LVESD/2)2],MEE = cESS × LVET× LVSV × 心率 × 4.2 × 10-4。MEE = cESS × LVET ×LVSV × 心率 × 4.2 × 10-4。LVET:左心室射血时间;LVSV:左室每搏输出量。每项指标取连续3个心动周期的平均值。
1.3.3 血液检测分别于治疗前后采集两组患者晨起空腹肘静脉血10 mL,3 000 r/min离心10 min,分离留取血清,应用BK-1200全自动生化分析仪,均采用酶联免疫吸附法检测:(1)神经内分泌因子:血清氨基末端脑钠肽前体(NT-proBNP)水平,试剂盒由中国同位素公司生产;(2)炎性因子及心肌损伤指标:肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)及肌钙蛋白T(cTnT),试剂盒由上海酶联生物科技有限公司生产;(3)心肌纤维化指标:血清转化生长因子-β1(TGF-β1),试剂盒由武汉中美科技有限公司生产。
1.3.4 药物不良反应统计两组患者治疗期间的药物不良反应。
1.3.5 随访不良心脑血管事件随访治疗后6个月内两组患者新发不良心脑血管事件,包括脑卒中、急性冠脉综合征、心力衰竭(包括缓解后再发、原有心力衰竭无效或加重)、心源性死亡。
1.4 统计学方法采用SPSS 23.0软件对数据进行统计学析,正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验,同组治疗前、治疗后比较采用配对样本t检验;分类变量以计数资料以例(%)表示,比较采用χ2检验。本文数据均服从正态分布连续性数据采用Pearson相关性分析;利用受试者工作特征曲线(ROC)评估各指标对再发不良心脑血管事件的预测价值,以曲线下面积(AUC)和95%CI表示,依据约登指数获取各指标的最佳预测阈值、预测敏感度和特异度。以P< 0.05为差异有统计学意义。
2 结果
2.1 临床疗效经等级资料的秩和检验,观察组患者的临床疗效优于对照组(Z= -5.352,P=0.000);经卡方检验,观察组患者的治疗总有效率高于对照组(χ2= 4.765,P= 0.029)。见表1。

表1 两组患者临床疗效比较Tab.1 Comparison of clinical efficacy between the two groups 例(%)
2.2 心功能、心室重构、神经内分泌因子及心肌能量代谢指标治疗前,两组患者CI、LVMI、NTproBNP及MEE比较(均P> 0.05),差异均无统计学意义,具有可比性;治疗后,两组患者的CI均明显升高,LVRI、LVMI、NT-proBNP及MEE均明显降低(均P< 0.01),观察组降低更显著(均P< 0.01)。见表2。
表2 治疗前后两组患者CI、LVMI、NT-proBNP及MEE比较Tab.2 Comparison of CI,LVMI,NT-proBNP and MEE between the two groups before and after treatment ±s

表2 治疗前后两组患者CI、LVMI、NT-proBNP及MEE比较Tab.2 Comparison of CI,LVMI,NT-proBNP and MEE between the two groups before and after treatment ±s
组别例数CI[L/(min·m2)]治疗前2.22 ± 0.21 2.21 ± 0.20 0.235 0.815对照组观察组t值P值72 72治疗后2.57 ± 0.23 2.76 ± 0.26-4.587< 0.001 LVMI(g/m2)治疗前129.96 ± 11.13 127.77 ± 13.58 1.062 0.290治疗后120.43 ± 9.71 110.82 ± 11.12 5.528< 0.001 NT-proBNP(ng/L)治疗前2152.8 ± 166.7 2180.7 ± 206.3-0.893 0.373治疗后526.68 ± 42.79 435.57 ± 46.25 12.270< 0.001 MEE(cal/min)治疗前145.24 ± 14.11 145.47 ± 18.33-0.086 0.932治疗后110.69 ± 10.29 88.04 ± 7.88 14.821< 0.001
2.3 炎性因子、心肌损伤及心肌纤维化指标治疗前,两组患者的TNF-α、IL-6、cTnT及TGF-β1水平比较(均P> 0.05),差异均无统计学意义,具有可比性;治疗后,两组患者的TNF-α、IL-6、cTnT及TGF-β1水平均明显降低(均P< 0.01),观察组降低更显著(均P< 0.01)。见表3。
表3 治疗前后两组患者TNF-α、IL-6、cTnT及TGF-β1水平比较Tab.3 Comparison of TNF- α,IL-6,cTnT,and TGF- β 1 levels between the two groups before and after treatment ±s
组别例数TNF-α(ng/L)治疗前28.04 ± 2.45 28.64 ± 3.10-1.301 0.195对照组观察组t值P值72 72治疗后16.93 ± 1.78 10.99 ± 1.16 23.623< 0.001 IL-6(ng/L)治疗前160.13 ± 15.15 160.10 ± 14.81 1.212 0.227治疗后86.18 ± 7.00 50.66 ± 5.73 33.334< 0.001 cTnT(ng/L)治疗前204.19 ± 21.17 198.44 ± 20.64 1.652 0.101治疗后140.80 ± 14.74 120.89 ± 12.05 8.870< 0.001 TGF-β1(μg/L)治疗前55.96 ± 5.92 57.03 ± 5.50-1.120 0.265治疗后43.90 ± 4.25 37.68 ± 3.33 9.772< 0.001
2.4 再发不良心脑血管事件随访治疗后6个月内,观察组患者心力衰竭再发率和不良心脑血管事件的再发率均低于对照组(χ2= 4.823、8.690,P= 0.028、0.003)。见表4。

表4 两组患者再发不良心脑血管事件比较Tab.4 Comparison of recurrence adverse cardiac and cerebrovascular events between the two groups例(%)
2.5 相关性分析经Pearson相关性分析,治疗前两组患者的CI、LVMI水平与NT-proBNP、MEE、TNF-α、IL-6、cTnT及TGF-β1水平呈极高度相关(均|r| > 0.90,P< 0.001)。见表5。
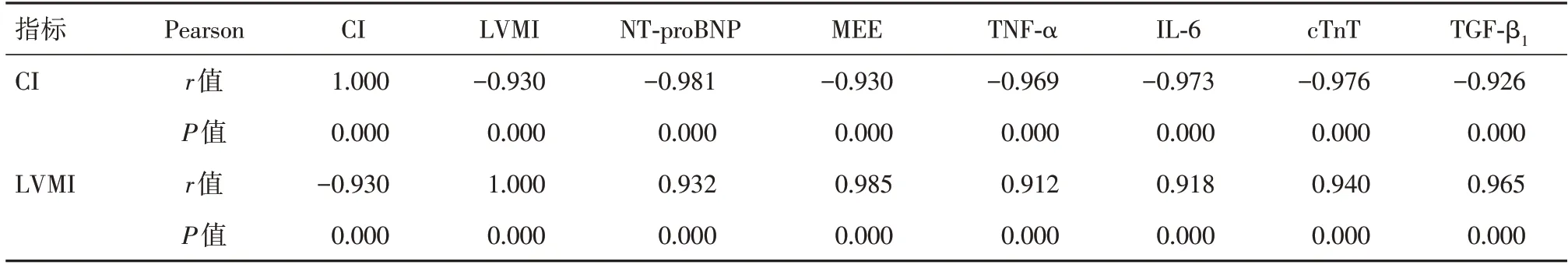
表5 治疗前两组患者的CI、LVMI水平与各因子水平的相关性分析Tab.5 Correlation analysis of CI,LVMI level and the level of each factor in the two groups before treatment
2.6 治疗前相关指标对不良心脑血管事件再发的预测随访治疗后6个月内两组患者共发生不良心脑血管事件28例,未发生不良心脑血管事件116例。利用ROC评估治疗前各指标对再发不良心脑血管事件的预测价值,按照AUC由高到底排序如下:NT-proBNP > cTnT > TNF-α > TGF-β1 >IL-6 > CI > MEE > LVMI。从表中可见,NT-proBNP和cTnT预测效能均较大,且NT-proBNP灵敏度(96.43%)最高,cTnT特异度(90.52%)较高,二者具有互补性,可联合用于临床预测。见表6、图1。

表6 各指标检测对再发不良心脑血管事件的预测效能比较Tab.6 Comparison of the predictive efficacy of each index test for recurrence adverse cardiac and cerebrovascular events
2.5 药物不良反应在治疗过程中,对照组患者出现恶心2例,便秘1例,心悸1例,头晕1例,视物模糊1例,共6例(8.33%);观察组患者腹胀2例,失眠2例,头痛1例,直立性的低血压1例,高钾血症1例,共7例(9.72%);两组患者药物不良反应发生率比较,差异无统计学意义(χ2= 0.085,P= 0.771)。两组患者的药物不良反应均较轻微,多为一过性表现,或经对症治疗不良反应消失,未影响继续用药。
3 讨论
目前虽然有多个研究已经证实沙库巴曲缬沙坦能够改善心功能和逆转心室重构[9-10],但关于其如何通过神经内分泌双调节来发挥逆转心脏重构作用的研究较少。Pearson相关分析结果显示,治疗前患者的CI与LVMI水平与cTnT、TNF-α、TGF-β1、IL-6、NT-proBNP、TGF-β1、MEE水平均密切相关。分析原因,心室重构是HFrEF发生、进展的基础病理过程,该过程涉及心肌缺血损伤、氧化应激、炎症反应、神经内分泌系统激活、心肌细胞凋亡、心肌纤维化、心肌能量代谢紊乱等诸多机制及多种细胞因子参与[11-12],因此,上述指标均是评估心功能与心室重构疗效及预后的重要指标。
目前临床主要通过超声心动图来评价心脏结构和心功能,心室重构后LVMI增大,CI降低[13]。本文结果显示,治疗6个月后,观察组患者CI升高及LVMI下降,改善优于对照组,说明沙库巴曲缬沙坦具有改善左心室收缩功能及逆转心室重构的作用。分析原因,沙库巴曲缬沙坦由沙库巴曲(脑啡肽酶抑制剂)和缬沙坦(血管紧张素抑制剂)组成,具有两个作用靶点:沙库巴曲通过抑制脑啡肽酶减少利钠肽的降解,提高体内脑钠肽水平,促进血管舒张,排钠利尿,减轻心脏负荷,抑制心肌肥厚和肾素和ALD的释放,降低心脏前后负荷,逆转心室重构[14-15];缬沙坦通过抑制肾素-血管紧张素-醛固酮系统,有效拮抗AT1及AngⅡ受体,扩张血管,抑制炎症、氧化应激反应及间质纤维化,改善心肌收缩力,提高左心室射血功能[16-17]。本研究结果同时显示,两组患者药物不良反应发生率比较无明显差异,提示联合沙库巴曲缬沙坦联合伊伐布雷定并未增加不良反应的发生,安全性好。
心力衰竭发生时,神经内分泌系统被过度激活,导致NT-proBNP、AngⅡ、ALD及NE等神经内分泌因子大量生成,均参与HFrEF的发展过程,导致血管及心脏靶器官发生继发性损伤,促进心肌重构[18]。其中,NT-proBNP是临床评价心力衰竭病情严重程度的重要指标[19];本研究结果显示,观察组患者的NT-proBNP、较对照组明显下降,表明沙库巴曲缬沙坦联合伊伐布雷定可显著抑制神经内分泌系统过度激活。
MEE是反映心肌能量代谢的重要指标。本研究结果显示,治疗前所有患者的MEE水平异常升高,并与心室重构指标(LVMI)呈正相关,与CI呈负相关,显示心肌能量代谢变化与HFrEF患者左心室重构相关,由此可以说明两者可能互相影响,心脏长时间超负荷耗能会促进心室重构进展,进而促进HFrEF进程[20]。从cESS的计算公式中包含LVESd,而MEE的计算公式包含cESS及LVET、LVSV等左心室重构指标,更进一步说明了肌能量代谢与心室重构的密切相关性。治疗后两组患者MEE水平明显减低,且观察组的降低较对照组更为明显,说明沙库巴曲缬沙坦联合伊伐布雷定降低了心肌的能量消耗水平。分析原因为沙库巴曲缬沙坦通过扩张冠状动脉,改善心肌缺血缺氧,减轻心脏负荷,联合伊伐布雷定通过减慢心率,减少心脏做功,同时不影响心肌收缩力及心脏传导,从而有效纠正心肌能量代谢紊乱状态。
HFrEF患者心肌细胞缺血或缺氧损伤产生自由基,诱发机体产生持续的炎症反应。炎性细胞分泌炎性因子,刺激可加速心肌变性或心肌细胞凋亡,心肌细胞肥大及纤维化,心肌细胞间质胶原沉积,最终导致心室重构[21]。其中TNF-α可诱导产生IL-6,其过表达可诱导心肌细胞的凋亡,刺激纤维母细胞增殖,加速心肌细胞外间质胶原沉积[22];IL-6过表达介导血管内皮细胞损伤,抑制心肌收缩,并促进心肌细胞的损伤与凋亡,促进心室重构[23-24]。cTnT为心肌损伤的特异性标志物,与心力衰竭的严重程度密切相关[25]。本研究中,治疗后两组患者炎性因子指标(TNF-α、IL-6)及心肌损伤指标(cTnT)水平均明显减低,且观察组的降低较对照组更为明显,说明沙库巴曲缬沙坦联合伊伐布雷定可有效拮抗HFrEF患者的机体炎症反应,具有心肌保护作用。
心肌细胞缺血、缺氧,诱发机体炎症反应,继而心肌细胞发生变性、坏死、凋亡,激活巨噬细胞生成和分泌多种活性生长因子,最终促使心肌成纤维细胞活化并异常增殖、胶原过度沉积及异常分布,造成心肌纤维化[26]。心肌纤维化发病机制复杂,多种细胞因子参与其病理过程。其中,转化生长因子β(TGF-β1)可刺激心肌细胞肥大,促进心肌成纤维细胞分泌Ⅰ、Ⅲ型胶原mRNA和纤维连接蛋自等细胞外基质蛋白合成,抑制基质降解,加速心肌纤维化[27];本研究中,治疗后两组患者TGF-β1水平明显减低,且观察组的降低较对照组更为明显,说明沙库巴曲缬沙坦联合伊伐布雷定可有效抑制HFrEF患者的心肌纤维化,阻滞心室重构的进展。
治疗后随访6个月,两组患者再发不良心脑血管事件共28例,未发生不良心脑血管事件共116例。采用治疗前上述相关指标的数据进行ROC绘图可以评价各指标对治疗6个月后再发不良心脑血管事件的预测价值,按照AUC由高到底排序如下:NT-proBNP > cTnT > TNF-α > TGF-β1 >IL-6 > CI > MEE > LVMI。其中NT-proBNP的AUC =0.995,cTnT的AUC = 0.942,具有较高预测价值,且NT-proBNP灵敏度(96.43%)最高,cTnT特异度(90.52%)较高,二者具有互补性,可联合检测用于早期临床预测。
综上所述,沙库巴曲缬沙坦钠联合伊伐布雷定治疗HFrEF可提高治疗总有效率,改善心功能,逆转心肌重构,安全性高。其机制可能与其抑制神经内分泌系统过度激活、降低心肌能量代谢、减轻炎症反应及心肌损伤、抑制心肌纤维化有关。本研究存在一定局限性,为单中心研究,样本量仍然较小,随访时间仍不够长,入选原发性疾病仅为缺血性心脏病和高血压性心脏病,入选对象仅为老年人,未对各种不同的原发病及其他年龄段患者进行分层研究,不能排除数据偏倚造成的影响。有待开展多中心、大样本、前瞻性研究来进一步验证沙库巴曲缬沙坦联合伊伐布雷定治疗HFrEF患者的疗效及安全性,并深入探讨其作用机制。
