HGF/c-Met信号通路与小鼠早期卵泡发育的相关性研究
2023-11-23黎明星李卓娴李康梅陈秀榕周艳平黄愉淋白琳吴展帅夏猛何国珍
黎明星 李卓娴 李康梅 陈秀榕 周艳平 黄愉淋 白琳 吴展帅 夏猛 何国珍
1广西中医药大学基础医学院(南宁 530200);2广西高发传染病中西医结合转化医学重点实验室(南宁 530200)
女性不孕症现已成为全球第三大疾病,其中女性卵源性不孕的病因主要为卵泡过度启动引发的多囊卵巢综合征(polycystic ovary syndrome,PCOS)以及原始卵泡启动障碍导致的卵巢早衰(premature ovarian failure,POF)或卵巢功不全(premature ovarian insufficiency,POI)[1]。据统计,约有1/100的40岁以下、1/1 000的20 ~ 30岁及1/10 000的20岁以下的妇女因卵巢早衰而提前绝经[2]。原始卵泡启动募集是卵泡发生的最关键环节,卵泡从受抑制的原始卵泡进入生长卵泡的过程称为原始卵泡启动募集或原始卵泡到初级卵泡的转变,该过程直接影响女性一生中能提供的卵子数。一旦原始卵泡池耗竭或启动募集障碍,可引起卵巢早衰或卵巢功能低下导致不孕。肝细胞生长因子(hepatocyte growth factor,HGF)为多肽生长因子,其受体为c-Met(HGF-receptor,也称c-Met),具备自主磷酸化活性[3]。HGF表达于卵巢中卵泡周围的间质细胞,可由卵泡膜细胞分泌[4],c-Met则多表达于上皮来源细胞,二者特异性结合后,可激发多条信号通路,发挥多种生物活性,参与调节胎盘滋养细胞、卵泡膜细胞、颗粒细胞等的发育与卵泡的成熟[5]。研究发现[4]HGF和c-Met 的mRNA在2 d的小鼠卵巢中表达,且HGF促进颗粒细胞增殖、腔前和早期腔卵泡的数量增加,同时HGF也可刺激FSH受体的表达,提示HGF可从多方面调控卵泡细胞功能,共同促进卵泡发育,而HGF/c-Met信号通路对早期卵泡发生的影响趋势鲜见报道。本课题组从HGF/c-Met信号通路为切入点,研究出生后不同鼠龄的小鼠卵巢中HGF/c-Met信号通路分子表达情况以及该信号通路的生物信息学分析,探讨HGF/c-Met信号通路与小鼠早期卵泡发育相关性和相关的分子机制,为后续研究HGF/c-Met信号通路启动原始卵泡募集的具体作用机制打下实验基础。
1 材料与方法
1.1 动物性成熟昆明(KM)雌性小白鼠30只,雄性小白鼠15只,由广西中医药大学动物实验中心提供(证号:2019-0004),饲养于广西中医药大学动物实验中心,恒温23 ~ 25 °C,12 h光照/12 h黑暗交替,自由采食饮水。
1.2 主要试剂及仪器HGF抗体(索莱宝科技有限公司,货号:K002383P);c-Met抗体(万类生物科技有限公司,货号:WL01758);辣根过氧化物酶(HRP)-羊抗兔IgG(美国abcam科技有限公司,货号:ab6721);多聚甲醛(上海国药集团,批号:20170413);Trizol regent(solarbio,R1100);RM2255型轮转式切片机(上海Leica仪器有限公司);低温离心机(eppendorf公司);超微量核酸检测仪(遂真公司);Veriti™ 96-Well Thermal Cycler(Applied Biosystems公司);7500实时荧光定量PCR系统(Applied Biosystems公司)。
1.3 小鼠卵巢组织采集雌性昆明小白鼠腹腔注射孕马血清促性腺激素(PMSG)保证同步发情,48 h后腹腔注射人绒毛膜促性腺激素(HCG)促排卵,以2∶1比例将雌鼠与性成熟雄鼠合笼,24 h后分笼。待母鼠生产后将胎鼠饲养至所需日龄(3、7、14、21 d)后处死,分离小鼠卵巢,存于-80 ℃冰箱。
1.4 免疫组织化学染色法检测4%多聚甲醛固定小鼠卵巢,取材、脱水、石蜡包埋并制成腊块。石蜡切片后脱蜡水化,EDTA-TRIS修复液进行抗原修复,PBS洗3次,3% ~ 5% H2O2-水(甲醇)溶液封闭内源性过氧化酶,PBS洗3次,一抗(20 μg/mL)覆盖切片,4 ℃孵育过夜;PBS洗3次,1∶100生物素标记的羊抗兔抗血清37 ℃孵育20 min,PBS洗3次,1∶400二抗4 ℃孵育60 min,PBS洗3次;DAB显色,苏木精复染,PBS返蓝,梯度酒精脱水;二甲苯透明;中性树胶封固。显微镜下读片,黄色为阳性表达。采用IPP 6.0(Image Pro Plus) 测量HGF、c-Met蛋白表达,分析灰度值。
1.5 Western blotting检测RIPA裂解小鼠卵巢,BCA法测蛋白含量。等量的蛋白质提取物在5×样品缓冲液中热变性,10%聚丙烯酰胺凝胶上分离后转移到PVDF膜上。封闭后,一抗HGF(1∶1 000),β-actin(1∶10 000),c-Met(1∶1 500)孵育,4 ℃摇床过夜。TBST清洗,二抗孵育。TBST清洗,显影,将目的蛋白条带与β-actin条带的灰度比值作为各目的蛋白的相对表达水平。
1.6 qPCR检测Trizol裂解小鼠卵巢,混匀,加入50%体积的氯仿,离心,取上层水相,加入等体积异丙醇,离心得到RNA沉淀,70%酒精洗涤、晾干、无菌无酶水溶解,RNA浓度及纯度检测、逆转录,所得cDNA干-20 ℃保存。Real-Time PCR扩增:逆转录产物cDNA作为扩增反应的模版,加入目的基因与内参引物进行扩增;扩增条件:预变性95 ℃,30 s;变性95 ℃,5 s;退火温度60 ℃,30 s;延伸72 ℃,15 s;循环次数40个。引物序列:HGF上游引物5'-TGATTCTTTCAGCCCGGCAT-3',下游引物5'-CGACATGAAGCAGGAGGAGG-3',c-Met上游引物5'-GCTCTGGAGGACAAGACCAC-3',下游引物5'-GGTGGGAGCCTTCATTGTGA-3,内参β-actin上游引物5'-CAGCCTTCCTTCTTGGGTAT-3',下游引物5'-TGGCATAGAGGTCTTTACGG-3'。数据采用2-ΔΔCT法进行分析,公式为:ΔCt=(Ct gene - Ct β-actin),ΔΔCt= (ΔCt treat - ΔCt control)。
1.7 HGF与c-Met的共同通路分析将HGF及c-Met输入于NCBI数据库(https://www.ncbi.nlm.nih.gov/)检索并获得其对应Gene ID后,将HGF、c-Met依托于DAVID数据库(https://david.ncifcrf.gov/)检索,将物种限定为Homo sapiens,进行基因本体(Gene Ontology)分析,其中涵括细胞组分(Cell Components)、分子功能(Molecular Function)、生物过程分析(Biological Process),同时进行了KEGG信号通路富集分析。相关结果可视化依托于微生信平台(http://www.bioinformatics.com.cn/)进行。
1.8 统计学方法采用 SPSS 19.0统计软件。数据以(±s)表示,组间比较采用单因素方差分析,同组前后比较采用配对样本t检验,组间比较采用独立样本t检验。以P< 0.05为差异有统计学意义。
2 结果
2.1 HGF和c-Met蛋白在小鼠卵巢中的空间和时间表达规律在3、7、14、21 d的小鼠卵巢中HGF及c-Met均有不同程度的表达,并具有一定空间和时间表达规律。
2.1.1 时间表达规律(1)HGF蛋白表达规律:HGF阳性表达的平均光密度值显示:3、7、14、21 d卵巢中HGF的表达随日龄的增加而升高,且21 d表达量最高,见图1;与3 d相比,7、14、21 d的HGF光密度差异有统计学意义(P< 0.05),见表1。(2)c-Met蛋白表达规律:c-Met阳性表达的平均光密度值显示:与HGF相比,c-Met的表达较弱且规律性不如HGF明显,在3、7、14、21 d卵巢中c-Met的表达总体上随日龄增加而升高,也在21 d表达量最高,但在7 d内的表达略微降低,见图1;与3 d相比,7、14、21 d小鼠卵巢c-Met的光密度差异有统计学意义(P< 0.05),见表1。
表1 不同日龄小鼠卵巢组织中HGF表达的平均光密度Tab.1 The average optical density of HGF expression in ovarian tissue of different days in mice ±s

表1 不同日龄小鼠卵巢组织中HGF表达的平均光密度Tab.1 The average optical density of HGF expression in ovarian tissue of different days in mice ±s
注:与3 d日龄组比较,*P < 0.05
日龄3 d 7 d 14 d 21 d c-Met平均光密度0.289 8 ± 0.044 42 0.259 1 ± 0.018 76*0.327 8 ± 0.075 23*0.330 8 ± 0.069 79*HGF平均光密度0.245 8 ± 0.092 42 0.333 3 ± 0.003 13*0.347 2 ± 0.034 68*0.418 2 ± 0.688 90*

图1 HGF和c-Met在早期小鼠卵巢组织中的表达位置Fig.1 The expression location of HGF and c-Met in early mouse ovarian tissues
2.1.2 空间表达规律(1)HGF蛋白表达规律:3 d和7 d卵巢中主要是原始卵泡,可见早期初级卵泡,HGF主要表达于卵母细胞胞质中,在卵泡细胞和卵泡周围的基质细胞胞质内可见少量表达;14 d原始卵泡数量减少,主要看到的是体积明显较大、卵泡细胞增生至多层的晚期初级卵泡,HGF在卵母细胞胞质内表达显著,卵泡细胞和卵泡周围的基质细胞内表达较3 d增强;21 d仍以晚期初级卵泡为主,开始出现含有卵泡腔、体积更大的次级卵泡,HGF在卵母细胞胞质内的表达相对于14 d更为强烈,且在颗粒细胞和基质细胞内表达增强。(2)c-Met蛋白表达规律:各日龄小鼠卵巢c-Met与HGF蛋白表达相似,3 d与7 d同样以大量密集的原始卵泡为主,少量的早期初级卵泡,但表达程度明显比同日龄卵巢HGF的表达弱;14 d主要是体积大且含有较多初级卵泡,表达较3、7 d明显增强,颗粒细胞层内也有明显的表达;21 d中c-Met的表达量最高。
2.2 HGF和c-Met蛋白在早期小鼠卵巢中的表达变化与3 d相比,HGF和c-Met蛋白在7、14、21 d卵巢中表达水平显著提高(P< 0.05),并随小鼠日龄的增加而上升,其中以21 d表达量最高(P<0.05),见图2。

图2 早期小鼠卵巢组织中HGF和c-Met蛋白的表达变化Fig.2 The expression of HGF and c-Met protein in early mouse ovarian tissue
2.3 HGF及c-Met的mRNA在早期小鼠卵巢中的表达变化qPCR结果显示,与3 d相比,HGF和c-Met的mRNA在7、14、21 d卵巢中表达水平显著上升(P< 0.05),且随小鼠日龄呈上升趋势,其中以21 d表达量最高,差异最显著(P< 0.05),见图3。

图3 早期小鼠卵巢HGF和c-Met的mRNA表达变化Fig.3 The expression of HGF and c-Met mRNA in early mouse ovarian tissue
2.4 HGF/c-Met的GO富集分析与KEGG通路分析利用DAVID数据库对HGF及c-Met进行了GO功能富集与KEGG通路富集。GO富集分析三大结果中仅有生物过程分析具有差异显著性(P< 0.05),包括过氧化氢介导的程序性细胞死亡的负调控(negative regulation of hydrogen peroxide-mediated programmed cell death)、肝细胞生长因子受体信号通路(hepatocyte growth factor receptor signaling pathway)、正趋化性(positive chemotaxis)、自噬的负调控(negative regulation of autophagy)、肝脏发育(negative regulation of autophagy)等,见图4,纵坐标所展示为GO功能的具体名称。

图4 GO功能富集分析Fig.4 GO functional enrichment analysis
KEGG富集到16条信号通路,其中15条具有显著差异性(P< 0.05),主要包括EGFR酪氨酸激酶抑制剂抵抗通路(EGFR tyrosine kinase inhibitor resistance)、Rap1信号通路(Rap1 signaling pathway)、Ras信号通路(Ras signaling pathway)、钙信号通路(Calcium signaling pathway)、MAPK 信号通路(MAPK signaling pathway)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)等。见图5,纵坐标所展示为通路的具体名称。
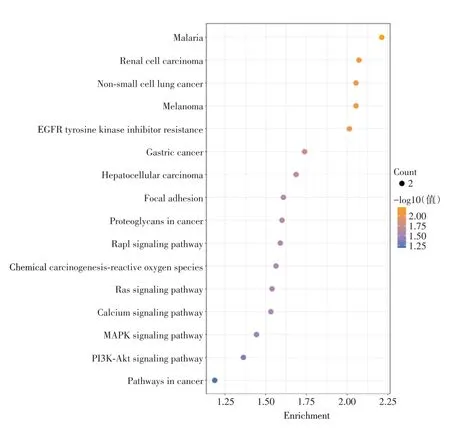
图5 KEGG通路富集分析Fig.5 KEGG pathway enrichment analysis
3 讨论
在哺乳动物的卵巢中,原始卵泡不断地被募集到发育卵泡库中。这些卵泡的特征是存在快速增殖的颗粒细胞和出现外层卵泡膜细胞。上皮源性颗粒细胞和间质源性卵泡膜细胞之间的相互作用对卵泡发育的协调至关重要。这些细胞间的相互作用主要是通过卵巢局部产生的各种生长因子调控作用。原始卵泡生长的启动和卵泡发生的早期阶段与促性腺激素无关,即使在垂体切除和促性腺激素分泌不足的动物中也可观察到卵泡生长。
HGF为间质来源的多效性生长因子,由α-链(69 kD)和β-链(34 kD)亚基组成。可由卵巢细胞(包括卵泡膜细胞、颗粒细胞等)分泌。c-Met属于受体酪氨酸激酶家族,是一种异源二聚体,由高糖基化的50 kD α亚基和跨膜的145 kD β亚基组成,主要通过二硫键连接[6]。c-Met为HGF的唯一受体,具备自主磷酸化活性和高亲和力,含细胞外配体结合区、细胞内胞质蛋白激酶结构区以及跨膜螺旋结构[7]。HGF可能在小鼠卵巢卵泡发育的早期阶段与后继卵泡发育过程中起一定作用,与其受体c-Met在颗粒细胞上的结合导致c-Met活化[4]。二者结合后形成的HGF/c-Met信号通路可调控原始卵泡发育、颗粒细胞增殖与分化,并通过促进卵母细胞生长、颗粒细胞增殖来调控卵泡闭锁环节,以延缓卵泡退化、闭锁与卵巢衰老[8]。UZUMCU等[9]研究表明HGF/c-Met信号通路可调控卵泡发育的各个主要阶段,包括类固醇生成、卵泡膜和颗粒细胞的生长以及颗粒细胞的凋亡。此外,HGF/c-Met信号通路参与调控原始卵泡库的激活,对原始卵泡库的维持有重要作用。
因此,本研究采用免疫组化、qPCR和WB检测小鼠卵巢HGF及c-Met的mRNA与蛋白表达的位置及水平,结果表明在3、7、14、21 d小鼠卵巢组织中均有HGF及其受体c-Met的表达,且蛋白水平和mRNA表达随日龄的增加呈不断增长趋势,在卵母细胞、基质细胞和颗粒细胞均有表达,这与SAHIN等[10]的研究结果,c-Met在成熟卵母细胞中的表达水平是未成熟卵母细胞的2倍相符,表明HGF不仅可以介导卵泡膜细胞和卵巢颗粒细胞的相互作用来促进卵泡发生和卵母细胞的成熟,同时也可以通过旁分泌直接作用在卵母细胞上,卵母细胞本身也可通过自分泌作用来促进卵泡发生以及卵母细胞的成熟。
生后3 ~ 21 d,是原始卵泡激活启动募集并发育到次级卵泡的阶段,即原始卵泡启动和早期卵泡发育的阶段,结合我们实验结果提示HGF/c-Met通路参与了原始卵泡启动和早期卵泡发育的过程,与早期卵泡发育过程具有一定的相关性。随着卵泡的不断发育,生后3、7、14、21 d小鼠卵巢HGF和c-Met的整体水平大致呈不断增长趋势,但表达程度略有不同,这可能与c-Met为HGF的唯一受体,但HGF并非c-Met的唯一配体,且c-Met可不依赖于HGF而被激活相关[11]。前期实验发现小鼠约在4周龄便有生殖能力,本次实验也证实21 d(3周)卵巢内开始出现次级卵泡,28 d(4周)可发育到成熟卵泡进行排卵而具有生殖能力。卵泡发育阶段分为促性腺激素非依赖时期与促性腺激素依赖时期,前者主要受多种局部卵巢因子和细胞因子等调控,而后者则以下丘脑-垂体-性腺轴调节为主。本实验结果HGF与c-Met的表达随着小鼠日龄的增加而呈不断升高的趋势,进一步说明HGF/c-Met通路参与调控卵泡发育的早期阶段。
通过HGF/c-Met的通路富集分析结果与相关文献检索分析结合,我们关注到HGF/c-Met所涉及通路中的PI3K-Akt信号通路。PI3K/Akt信号通路是细胞内的信号传导途径,可响应胞外信号而促进代谢、存活、增殖、生长及血管生成。近年来多有研究证实[12],PI3K/Akt信号通路和其下游效应分子所构建而成的通路在卵泡的形成、生成、排卵以及黄体化过程中都发生了变化,并参与并调控了卵母细胞的成熟,PI3K/Akt通路在卵泡发育及卵母细胞成熟中扮演了重要角色,但具体调控机制仍有待进一步探索。当HGF与c-Met相结合时,会引发c-Met胞质内的酪氨酸残基出现自身磷酸化,从而激活酪氨酸激酶,最终激活PI3K/Akt等信号通路[13]。提示HGF/c-Met通路调控卵泡发育的作用可能与PI3K/Akt信号通路的激活密切相关。
综上所述,HGF/c-Met通路可能通过自/旁分泌等途经参与调控了小鼠卵巢的早期卵泡发育过程,尤其是原始卵泡的激活和募集的调控,其具体的细胞内信号转导通路以及与其他卵巢局部因子的相互作用机制或与PI3K/Akt信号通路密切相关,为后续研究HGF/c-Met通路启动原始卵泡募集的具体机制打下实验基础,也为阐明女性卵源性不孕的具体机制提供研究基础。
