硬皮病肾危象诊治
2023-11-23荀翠平铁宁
荀翠平,铁宁
系统性硬化症(systemic sclerosis,SSc)是一种罕见的、免疫介导的炎症性疾病,可引起皮肤和血管系统的纤维化改变,最终影响全身多器官系统[1]。SSc的病理特征是不受控制的胶原沉积和以血管壁增厚及管腔缩窄为特征的广泛血管病变。SSc的确切发病机制尚不清楚,自身抗体的产生、淋巴细胞和成纤维细胞激活、血管增生、闭塞性微血管病变及组织纤维化可能起作用[2]。硬皮病肾危象(scleroderma renal crisis,SRC)是SSc危及生命的并发症,通常表现为急性高血压和急进性肾损伤,影响10%~15%的SSc患者[3]。在进展迅速的弥漫皮肤型SSc患者(11%)比局限皮肤型SSc患者(4%)更常见[3]。SRC可进一步细分为高血压型和正常血压型,分别占SRC病例的90%和10%[4]。SRC是SSc的主要死亡原因之一,随着血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitors,ACE-I)的出现,SRC的预后得到了显著改善,目前患者1年生存率为70%~82%,5年生存率50%~60%[5-6]。本文综述近年来关于硬皮病肾危象的相关文献,总结硬皮病肾危象的临床特点、风险因素及治疗进展,以期临床上提高对硬皮病肾危象的诊治水平。
1 SRC的定义及分类
1863年,Auspitz首次报道一例皮肤硬化的年轻锁匠死于进行性尿毒症,而当时并不认为两者之间有关联[7]。随后有学者提出用“进行性系统性硬化症”这个术语描述皮肤和肾血管的病变。1952年,Moore和Sheehan在描述3例死于尿毒症的系统性硬化症患者时,确定了具体的肾脏病变并创造了术语“硬皮病肾危象”描述这种恶性高血压和肾功能衰竭[7]。
典型的SRC包括3个特征:(1)急性肾损伤;(2)尿液异常或仅显示轻度蛋白尿;(3)突然发生的中度至重度高血压,通常伴血浆肾素活性升高[8]。SRC被定义为在SSc病程中新发的中重度高血压和/或迅速进展的肾功能损伤;新发高血压(高血压定义为血压高于140/90 mm Hg或收缩压升高30 mm Hg以上或舒张压升高20 mm Hg以上)必须是在之前24 h内至少测得过两次,相隔5 min以上;急性肾损伤定义为:血清肌酐在48 h内升高≥26.5 μmol/L(≥0.3 mg/dL),或7 d内血清肌酐增加至基线水平的1.5倍,或持续6 h尿量<0.5 mL/(kg·h)[9]。
表1总结了ISRCS(International Scleroderma Renal Crisis Survey)和EUSTAR(European Scleroderma Trials and Research group )专家建议的两组分类标准[4,10]。上述标准将SRC分为高血压和正常血压两类,也有学者认为这种分类可能并不合适,因为它忽略了一些特殊病理类型,认为区分狭义SRC(narrowly defined SRC,nd-SRC)和系统性硬化相关血栓性微血管病(SSc associated thrombotic microangiopathy,SSc-TMA)是很重要的,而SSc-TMA与既往服用类固醇和预后不良的相关性强于nd-SRC[11]。通常,ndSRC最初表现为血压显著升高和肾功能恶化,随后出现轻度血小板减少。相反,SSc TMA首先表现为严重的血小板减少,其次是血压升高和肾功能恶化。在确定适当的治疗干预措施和预后预测时,应考虑每种病理状况的参与程度。通过准确评估临床病程,确定TMA在每位患者中的作用,以及适当选择治疗方法,包括针对SSc-TMA的血浆置换(plasma exchange,PE)或抗补体治疗,以及针对nd-SRC的ACEI给药,可以改善SRC的预后[11]。
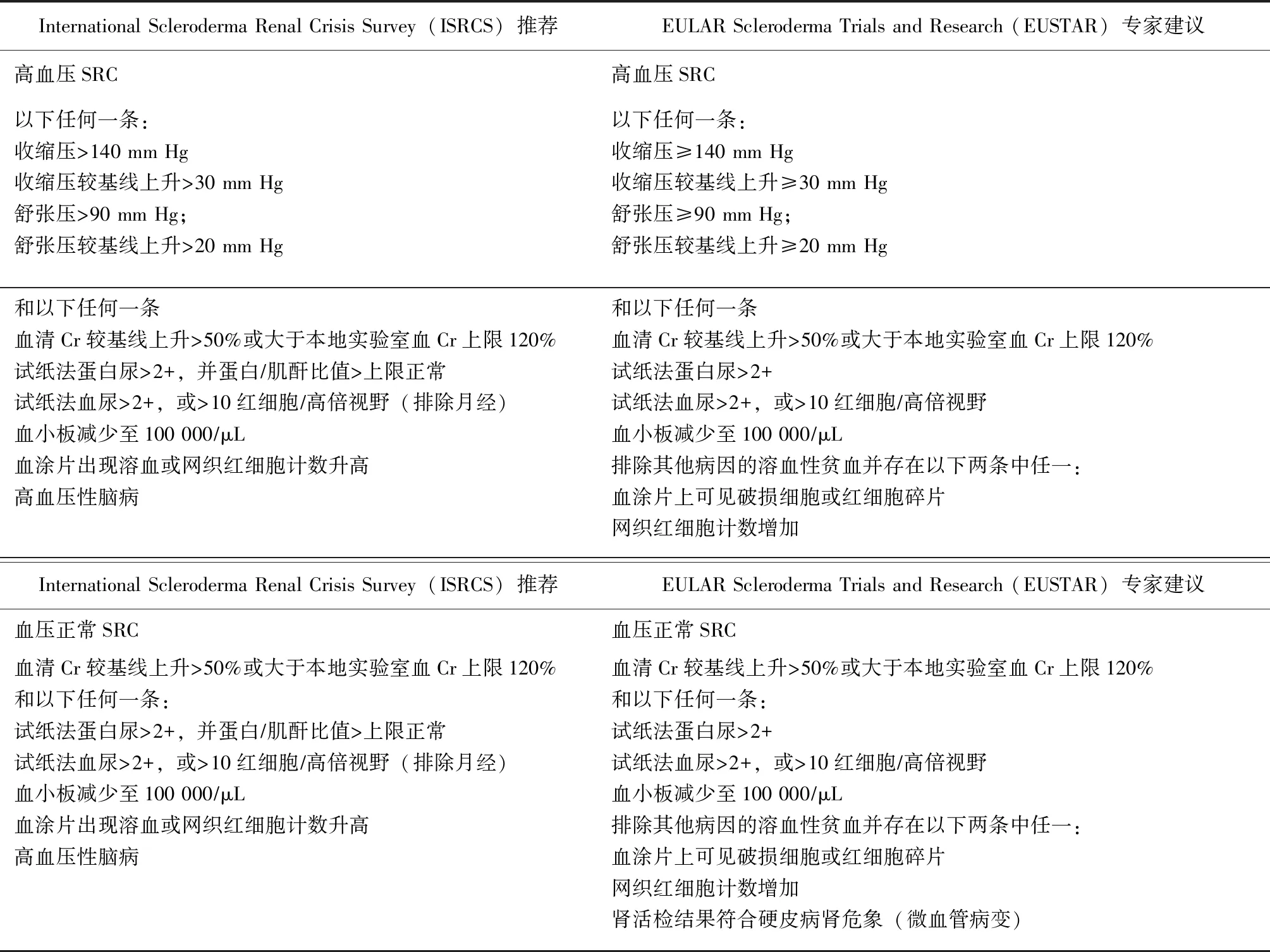
表1 ISRCS和EUSTAR专家建议的分类标准Table 1 Proposed definitions for scleroderma renal crisis
2 SRC的危险因素
许多危险因素可预测SRC的发生,识别这些风险因素对于早期发现和及时治疗SRC患者至关重要。据Steen[12]研究显示,20%~25%的弥漫皮肤型SSc患者发展为SRC,而局限皮肤型SSc患者只有1%。多数专家一致认为,快速进展的皮肤硬化是SRC的主要危险因素之一,大多数弥漫皮肤型SSc患者在发病7.5个月至4年时间内发展为SRC[6,13]。大量研究已经证实,大剂量糖皮质激素是SRC的危险因素[14-15],其他风险因素包括新发贫血、肌腱摩擦音或心脏事件(如心包积液或充血性心力衰竭)[16-17]。
糖皮质激素常用于短期控制SSc的炎症,但研究发现糖皮质激素的使用会增加SRC的风险。高剂量糖皮质激素(>30 mg/d)与正常血压型SRC具有相关性[18]。在对110例发生SRC的SSc患者的回顾性分析中发现,接受中等剂量糖皮质激素(每天15毫克强的松或等效药物)的患者在治疗后6个月内发生SRC的可能性更大[14]。随后在D-青霉胺临床试验的背景下进行的一项研究报告显示,当泼尼松剂量超过7.5 mg/d时,发生SRC的风险增加[19]。最后,对44项研究和93个病例报告的回顾研究发现,中到高剂量的糖皮质激素(例如,泼尼松15 mg/d)是SRC的一个危险因素[20]。因此,EULAR专家建议使用糖皮质激素治疗的SSc患者应仔细监测SRC的发展。
使用ACEI治疗SRC的临床改善促使人们想将其作为预防SRC的药物。在一项回顾性研究中显示,在SRC发病前使用ACE-I并没有带来有益的效果,相反,显示出肾功能不良的趋势[21]。欧洲抗风湿病联盟(European League Against Rheumatism,EULAR)硬皮病试验研究组(European Scleroderma Trials and Research group,EUSTAR)数据库最近的一项患者分析显示,在SRC发病前对SSc患者使用ACEI增加了SRC的发生风险[22],进一步分析表明ACEI是SRC患者的独立危险因素。在一项国际前瞻性队列研究中,Hudson等[10]研究表明,与未暴露患者相比,在SRC发病前暴露于ACE-I导致SRC发病后死亡风险增加两倍以上。人们对这一结果提出了许多解释,多数认为 ACE-I的使用可以掩盖高血压的发病,从而延迟SRC表现或表现为正常血压型SRC。因此,EULAR专家不支持预防性使用ACEI降低SRC的发病风险[23]。对于伴有系统性高血压的SSc患者,使用非ACEI类药物如钙通道阻滞剂治疗系统性高血压可能更可取。
一些自身抗体如抗拓扑异构酶抗体和抗RNA聚合酶III抗体与SRC有关。而与局限皮肤型SSc密切相关的抗着丝粒抗体并不与SRC相关[6]。研究显示,在多数弥漫皮肤型SSc患者中能够发现抗拓扑异构酶抗体和抗RNA聚合酶III抗体;且与28%~59%的SRC患者相关[6,24]。澳大利亚的一项研究显示,在大约16%的硬皮病患者中检测到了抗RNA聚合酶III抗体,其中20%的患者发展为SRC[25]。抗RNA聚合酶III抗体有相对更好的生存率,这类患者较少累及肺部,而累及肺部的患者预后相对更差[24]。意大利一项对46例SSc患者的病例得出结论,在SRC患者中检测到抗拓扑异构酶抗体的频率高于抗RNA聚合酶III抗体(65%vs.15%)[26]。在这项研究中显示,抗拓扑异构酶抗体与SRC的延迟发病和较高的死亡率有关。
3 SRC的治疗与监测
SRC是内科急症,ACEI的早期应用现已成为一种标准的治疗方法,并与良好的预后相关[5]。根据患者对ACEI的反应,可能需要增加其他降压药物治疗,以达到降低血压的目标。
3.1 血管紧张素转换酶抑制剂
ACE-I是治疗SRC的主要药物。ACEI通过竞争性抑制血管紧张素转化酶,使血管紧张素I不能转换为血管紧张素II,并能够减少缓激肽的降解,促使肾血管舒张。Steen等[27]报道,接受ACEI治疗的患者1年生存率为76%,而未接受ACE-I治疗的患者1年生存率为15%(P<0.001)。最近,两项回顾性研究分别包括91例和110例SRC患者,其中大部分患者接受ACEI或血管紧张素-1受体阻滞剂(ARBs)治疗,其生存率较高(1年时71%~82%,5年时59%~60%,10年时为42%~47%);43%未接受ACEI治疗的患者在SRC发病后的第一个月内死亡[6,21]。尽管患者越来越依赖于RRT,但随着ACEI的持续使用,肾功能恢复和最终停止RRT的可能性增加。基于这些有利的数据,EULAR专家建议在SRC治疗中早期应用ACEI。
与依那普利相比,短效ACEI具有起效快、作用时间短、60~90 min达到峰值的优点,可以快速滴定,而依那普利由于作用时间长(可达36 h)而不常用于急诊。对于没有中枢神经系统受累证据的高血压患者(如脑病、视神经乳头水肿),卡托普利的起始剂量为6.25~12.5 mg,以12.5~25 mg的剂量递增,每隔4~8 h递增一次,直到达到目标血压[28]。卡托普利的最大剂量是300~450 mg/d。对于有中枢神经系统受累迹象的高血压患者,采用相同的卡托普利剂量递增方案,并添加静脉药物控制血压快速升高。对于血压正常的SRC患者,开始给予卡托普利6.25 mg的剂量,如果耐受,在第二次给药时增加剂量至12.5 mg[28]。进一步的剂量增加必须小心完成,以防止低血压,并在患者住院期间进行滴定。对于那些血压在正常范围内但仍高于患者基线的患者,目标是将血压降低到先前的基线水平。ACEI启动后即使出现血清肌酐升高也不应减少或停止使用ACE-I,肌酐升高是由于SRC而不是ACEI,没有证据表明减少ACEI剂量可以改善肾功能。恶性高血压的及时控制至关重要,因为预后在很大程度上取决于持续肾缺血的及时改善[15]。Woodworth等[29]建议,在血压初步稳定后,应在SRC中使用长效ACEI,以避免卡托普利的不良反应(皮疹、细胞减少、低血压风险)。
3.2 其他降压药物
虽然理论上血管紧张素受体拮抗剂(angiotensin II receptor blockers,ARB)对SRC有效,但这些药物还没有得到充分的评估,疗效也不确定。虽然证据有限,但如果患者高血压对ACEi无反应,一致意见建议将这类药物作为二线药物[30](图1)。由于β受体阻滞剂和利尿剂对已经减少的外周血流灌注产生负面影响,因此在治疗SRC患者时大多不使用β受体阻滞剂和利尿剂。由于钙通道阻滞剂(calcium channel blockers,CCB)具有扩血管作用,对于雷诺现象有一定的改善,曾是SSc患者首选的降压药物,但其平滑肌松弛作用可能引起食管反流、增加误吸等风险,通常被推荐为SRC的三线降压药物。
3.3 内皮素受体拮抗剂
内皮素-1(endothelin-1,ET-1)是由血管内皮细胞产生的内源性肽,是一种有效的血管收缩剂和平滑肌细胞有丝分裂原之一,通过与特定受体亚型ETA(内皮素受体A)和ETB(内皮素受体B)的相互作用发挥作用,在肺动脉高压(pulmonary arteerialhypertension,PAH)的背景下得到了很好的研究[31];据报道,ET-1在SRC患者的肾小球、间质和血管中过度表达[32]。ETA和ETB在平滑肌和成纤维细胞上的激活都会导致血管收缩,并随后导致控制基质合成的修饰基因(如TGFβ和其他生长因子)的转录激活,从而导致血管重塑和纤维化[33]。
Penn等[34]研究发现,SRC患者发病时的血清ET-1水平与SSc-PAH患者相似,且显著高于那些没有PAH或SRC的患者。在同一研究中,通过对27例SRC患者的肾活检进行分析与评估发现,与对照组相比,ET-1在SSc患者肾组织中过度表达;在SRC患者中也发现ETA和ETB的高表达。在另一项组织学研究中[32],对SRC和其他肾病(如典型HUS、抗磷脂综合征和糖尿病)中ET-1的组织表达进行了评估,作者报告了与所有其他条件相比,ET1在SRC中的过度表达。
在一项针对6例患者的病例研究中,在SRC发病后6周内,将波生坦(双重ET-a和ET-B拮抗剂)加入ACE-I治疗6个月,与单独使用ACEI治疗的患者相比,使用ACEI和波生坦治疗的患者总体死亡率相似[34]。两组患者在停止RRT后肾功能均有改善,波生坦联合ACEI组的平均改善程度更大(无统计学意义)。考虑到这种联合治疗的安全性,需要更多的研究来评估ERA作为二线或补充治疗SRC的疗效。
3.4 其他治疗
一些研究也证实了经典补体途径激活在SRC发病机制中的作用。针对这一途径,有病例报告称,在难治性病例中使用Eculizumab(依库丽单抗,一种针对补体C5的人源化单克隆抗体)与ACE-I联合治疗,结果显示部分患者的肾功能恢复、溶血性贫血和血小板减少改善[35]。自20世纪80年代以来,血浆置换(plasma exchange,PE)被零星地用于某些SSc患者,认为PE可以清除血管收缩介质、自身抗体、促炎症和促纤维化细胞因子、免疫或血浆因子,这些因子可以激活肾素-血管紧张素系统。在40%~50%的SRC患者中,肾损害可发展为需要肾脏替代治疗(renal replacement therapy,RRT)的终末期肾病(end-stage renal disease,ESRD)[6,21]。许多患者在SRC发病后1年内可以停止RRT,对于RRT的需求可能只是暂时的。在最近一项对75例SRC患者进行的国际队列研究中,25%的患者在1年的随访中仍在接受RRT。 在法国一项长达26年的多中心回顾性研究中,共有34名SRC患者接受了肾移植[36]。患者在接受肾移植前接受RRT治疗的平均时间为45个月,移植后1年、3年和5年的患者生存率分别为100%、90.3%和82.5%,3例患者在移植后1、4和57个月时SRC复发。
3.5 SRC的监测
虽然对SRC没有明确的预防措施,但密切监测,尤其对高危人群的密切监测,是确保早期发现和治疗的关键。应采取定期在家中记录血压的形式(至少每周两次),如果血压持续升高超过130 mm Hg,应立即就医。出现头痛、视力改变、疲劳或呼吸困难等症状时更应高度重视,这些策略依赖性于患者的自主性,因此应病程早期对患者进行宣教以提高患者的自主性。
4 预后
在ACEI出现之前,SRC是SSc患者死亡的主要原因,通常发生在SRC发病后的1至3个月[37]。SRC患者的5年累积生存率从使用ACEI前的10%增加到使用这些药物后的65%[5,38]。尽管使用ACEI,SRC仍然是SSc常见的死亡原因之一。据EUSTAR数据库显示,SRC的发生是SSc患者3年死亡率的独立预测因子[39]。与不良预后相关的因素包括高龄、男性、充血性心力衰竭、血压控制不佳、糖皮质激素暴露、出现血清肌酐水平升高、血压正常的SRC、SRC发病前使用ACEI以及需要永久性RRT[10,21]。
综上,尽管ACEI的出现显著改善了SRC的预后,但它仍是SSc的潜在致命并发症。临床医生应该能够识别有风险的患者,并进行适当监测。新发性贫血、血小板减少、充血性心力衰竭、心律失常、心包积液和快速进行性皮肤增厚都是SRC的潜在预测因素,此类患者应避免使用中到大剂量糖皮质激素和环孢素。及时使用ACEi进行治疗能有效控制病情,并可能逆转病情进展,避免慢性肾功能衰竭的发展和过早死亡。
