福建和安徽茶树轮斑病菌的鉴定及对3种杀菌剂的敏感性
2023-11-22李庆雨刘姣姣张立新
李庆雨,邓 强,刘姣姣,张立新
福建和安徽茶树轮斑病菌的鉴定及对3种杀菌剂的敏感性
李庆雨,邓 强,刘姣姣,张立新*
(安徽农业大学植物保护学院,植物病虫害生物学与绿色防控安徽普通高校重点实验室,合肥 230036)
2017—2021年从福建和安徽茶区采集茶树轮斑病叶,利用组织分离法分离纯化菌株,通过形态学特征、多位点序列分析和柯赫氏法则对病原菌进行鉴定。结果发现分离获得的40株菌株的菌落形态特征不同,共存在4种类型;分生孢子形态特征相似,均为纺锤形、直或稍弯曲、中间3个细胞褐色,两端细胞透明。进一步对代表性菌株进行ITS、和基因的PCR扩增、测序和序列分析,将测试菌株分别鉴定为茶假拟盘多毛孢和山茶假拟盘多毛孢,其中由引致的茶树轮斑病在福建茶区为首次报道。利用菌丝生长速率法测试了不同来源的茶树轮斑病菌对3种常用杀菌剂的敏感性,结果表明测试菌株对苯醚甲环唑的敏感性均较高,EC50值分布在0.035 0 ~ 0.267 5 μg·mL-1;其次为戊唑醇和多菌灵,EC50值分布在0.126 3 ~ 1.582 6 μg·mL-1。在生产实践中可应用苯醚甲环唑和戊唑醇作为防治茶树轮斑病的优选药剂。
茶树;拟盘多毛孢;鉴定;聚类分析;药剂筛选
茶树(L.) O. Ktze.是热带与亚热带重要经济作物,其种子可以榨油,茶叶具有降脂减肥、降血糖、调节免疫、减缓衰老、预防心脑血管疾病等功效,在中国、印度、肯尼亚、斯里兰卡、越南、土耳其等地区广泛种植[1-2]。茶树轮斑病是茶树重要病害之一,可导致茶树叶片脱落,整株死亡,在降低茶叶产量的同时,严重影响了茶叶品质。目前该病害在世界各产茶区均有发现,在我国茶区的分布也相当普遍,浙江、江苏、安徽、江西、湖南、湖北、四川、贵州、云南、台湾等茶区皆有报道[3]。
目前研究者对中国茶园调查茶树轮斑病中,发现引起该病害的病原包括拟盘多毛孢属、假拟盘多毛孢属和新拟盘多毛孢属内的多个种类,且不同地区以及不同茶区的茶树轮斑病的病原菌种类不同。如贵州省两个不同茶区发生的茶树轮斑病分别由棕榈拟盘多毛孢和茶假拟盘多毛孢侵染引起[4-5];Wang等发现安徽两个不同茶区发生的茶树轮斑病由、和引起[6]。本研究从福建和安徽的各大茶产区采集茶树轮斑病病样,通过组织分离、形态学特征、多位点序列分析和柯赫氏法则,确定茶树轮斑病的病原菌种类,并采用菌丝生长速率法评估了茶树轮斑病菌对多菌灵、戊唑醇和苯醚甲环唑的敏感性,从而为茶树轮斑病的有效治理提供科学依据。
1 材料与方法
1.1 材料
供试药剂为37%苯醚甲环唑可湿性粉剂(Difenoconazole 37% WP),江苏健神生物农化有限公司;97%多菌灵可湿性粉剂(Carbendazim 97% WP),先正达作物保护有限公司;98%戊唑醇可湿性粉剂(Tebuconazole 98% WP),先正达作物保护有限公司。
1.2 方法
1.2.1 病原菌的分离 2017—2021年期间从福建武夷山、安徽合肥和东至等茶园采集茶树轮斑病典型病叶,采用组织分离法进行病菌分离。在叶片病健交界处剪约5 mm的正方形组织块,置于75%的酒精浸泡10 ~ 15 s,再用0.1 %的 HgCl2表面消毒90 s,然后用无菌水连续漂洗3次后,将其放在无菌纸上,晾干后转移到 PDA 培养基上。25 ℃培养箱中黑暗培养5 ~ 7 d。待菌落长出后进行纯化、扩繁,4 ℃保存备用。
1.2.2 形态学特征观察 将得到的菌株在PDA平板上进行活化,25 ℃培养6 ~ 7 d后观察菌落形态。培养15 ~ 21 d待其产孢后,在荧光倒置显微镜(日本Olympus, CKX53)下观察分生孢子形态,并测量30个分生孢子大小。
1.2.3 分子鉴定 采用CTAB法提取供试菌株的基因组DNA,扩增rDNA-ITS(ITS4/ITS5)[7]、-微管蛋白基因(T1/--2b)[8-9]和基因(EF1-728F/EF-2)的片段[10-11]。PCR 反应体系为25 µL: 2× LA Premix12.5 µL,10 μmol·L-1的上下游引物各0.75 µL,DNA 模板1.5 µL和9.5 µL的无菌水。扩增程序: 95 ℃预变性 3 min,95 ℃变性 30 s,72 ℃延伸 90 s,35 个循环后,72 ℃延伸 10 min,退火温度: ITS为53 ℃退火45 s,为55 ℃退火50 s,为56 ℃退火30 s。将扩增后的PCR产物在1.0%琼脂糖凝胶上电泳检测后,送至南京擎科生物科技有限公司测序,获得序列在NCBI网站进行BLAST同源性分析。将目的片段序列按照ITS--的顺序进行连接,利用MEGA7.0软件,采用最大似然法(ML)构建系统发育进化树。
1.2.4 致病性测定 采用针刺法对‘舒茶早’离体枝条的叶片进行致病性测定。采摘健康、长势一致的枝条,经自来水冲洗、表面消毒后,用无菌昆虫针在叶片的叶脉两侧制造伤口。产孢菌株用分生孢子悬浮液接种,配置浓度约为107个·mL-1的孢子悬浮液,每个损伤处接种50 µL,保鲜膜覆盖接种位置,对照使用无菌水处理,每个处理重复3次;对于不产孢的菌株,用直径6 mm 的打孔器打取菌丝块,菌丝面贴于叶片刺伤处,用PDA琼脂块作为对照,每个处理重复3次[6]。接种后将离体枝条放于盛有无菌水的三角瓶中,然后置于25 ℃的人工气候箱中,每天观察发病情况。对于接种后发病的叶片,重新对发病组织进行病原分离,经培养特征观察和分子鉴定病菌后完成柯赫氏法则。
1.2.5 茶树轮斑病菌对3种杀菌剂的敏感性测定 采用菌丝生长速率法测定茶树轮斑病菌对3种杀菌剂的敏感性。每种化学药剂设置5个梯度,配成不同浓度的含药平板,每个浓度做 3组重复。各杀菌剂的有效成分浓度如下:37%苯醚甲环唑10、2、0.4、0.08和0.016 μg·mL-1,98%戊唑醇15、3、0.6、0.12和0.024 μg·mL-1,99%多菌灵1、0.5、0.2、0.1和0.05 μg·mL-1,以无菌水加入PDA培养基为对照处理。用内径为6 mm打孔器打取菌饼,分别接种到上述含药PDA平板上,置于25 ℃培养箱中培养,4 d后采用十字交叉法测量各处理菌落直径,计算各处理的菌丝生长抑制率。菌丝生长抑制(%)=(对照菌落直径﹣处理菌落直径)/(对照菌落直径﹣6 mm )×100。使用DPS 7.05软件计算抑制中浓度(EC50)。
2 结果与分析
2.1 茶树轮斑病病害症状
茶树轮斑病主要危害叶片,病斑初为黄绿色小斑点,后渐向内扩展成半圆形至圆形或不规则形褐色大斑。边缘黑褐色、隆起,后期中部变为灰白色,边缘产生轮纹,沿轮纹产生黑漆状扁平小颗粒(图1)。

图1 茶树轮斑病田间症状
Figure 1 Symptoms of gray blight onin the field
2.2 病菌的分离和形态学特征
在福建和安徽的不同茶园共分离获得40株病菌,菌落形态分为4种(图2)。类型Ⅰ包括18株菌株,边缘波浪状,菌落奶白色,菌丝绒毛状,层叠生长,具有沟纹;菌落背面中间至外缘黄褐色到浅黄色(图2-a/e)。类型Ⅱ包括6株,边缘近圆形,具有同心圆环,菌丝纯白色呈毡状;菌落背面中间至外缘,淡黄色到白色(图2-b/f)。类型Ⅲ包括9株,边缘波浪状,菌丝纯白色、棉絮状、纹状生长;菌落背面中间至外缘,浅褐色到白色(图2-c/g)。类型Ⅳ包括7株,边缘波浪状,菌丝纯白色,散射生长,形状呈花瓣状;背面中间淡黄色,边缘白色(图2-d/h)。
产生的分生孢子5细胞,纺锤形,直或稍弯曲,大小为(18.5 ~ 33.4) μm × (6.2 ~ 9.9) μm,中间三色孢同为褐色;顶孢和尾孢无色,顶孢圆柱形,尾孢三角形,顶端附属丝1 ~ 4根,多数为3根,长8.9 ~ 39.2 μm,顶端勺状膨大,部分无勺状膨大,个别菌株分生孢子顶端附属丝有分支,尾孢上着生一根中生式柄,长3.0 ~ 9.0 μm (图3)。根据菌落形态和分生孢子特征,初步将分离获得的菌株鉴定为假拟盘多毛孢属

a ~ d: 类型Ⅰ- Ⅳ的正面菌落形态; e ~ h: 类型Ⅰ- Ⅳ的背面菌落形态。
Figure 2 Morphological characters of the isolates

标尺= 20 μm。
Figure 3 Morphological characters of conidia from the isolates
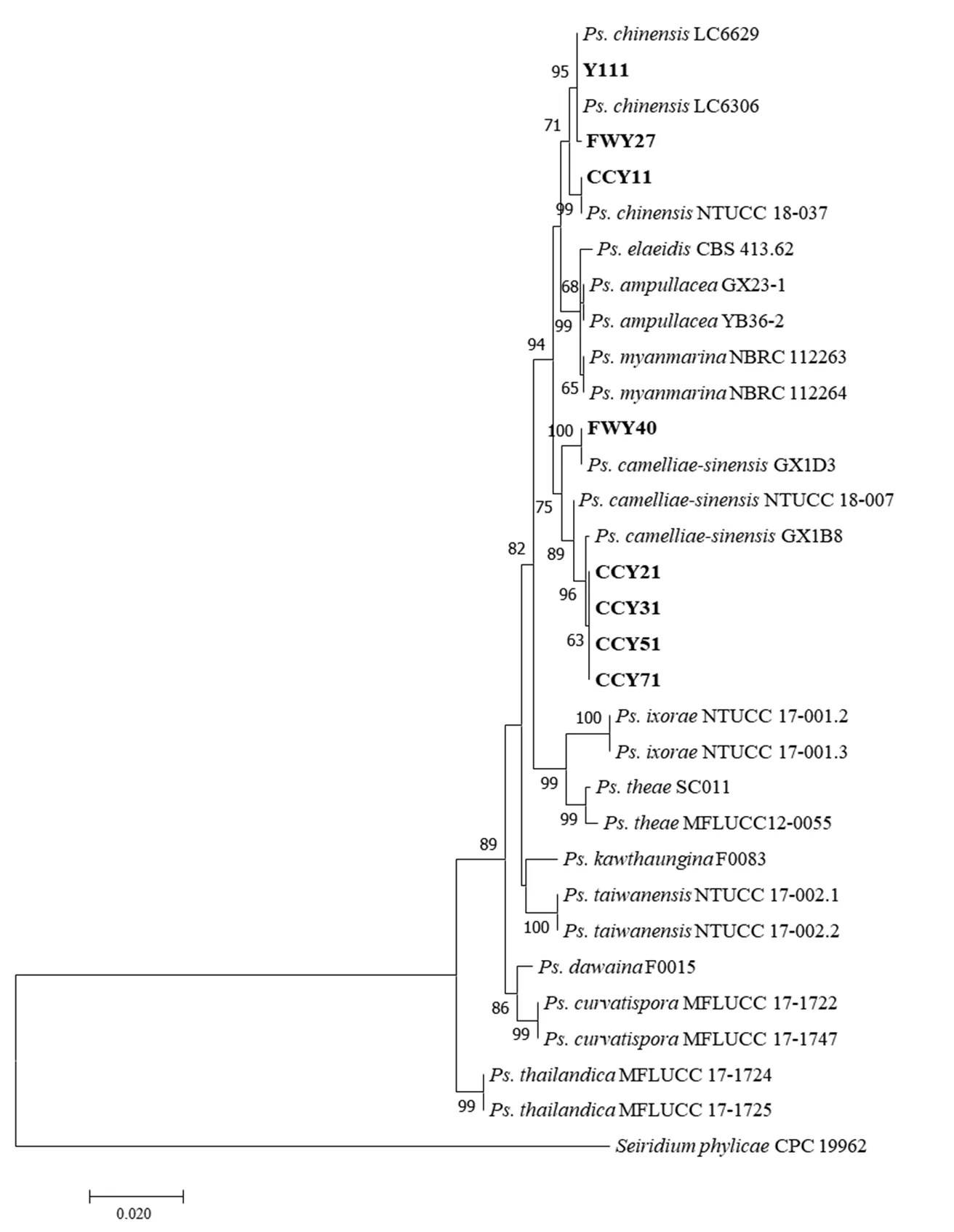
图4 基于ITS、TUB2和TEF 3个位点对假拟盘多毛孢的聚类分析
Figure 4 Phylogenetic analysis ofspp. based on ITS,andloci
2.3 多位点序列分析
在不同菌落形态特征类型中选择8株代表性菌株,对其ITS、和目的片段进行PCR扩增、测序,获得目的位点ITS、和的序列长度分别为543、818和486 bp。在NCBI中进行同源性比对,各菌株FWY27、Y111和CCY11的ITS、和序列与参考菌株NTUCC 18-037[3](MT322054、MT321856和MT321955)的序列同源性在98%以上;菌株CCY21、CCY31、CCY51、CCY71和FWY40的ITS、和序列与参考菌株NTUCC 18-007[3]( MT322023、MT321825和MT321924)序列同源性也在98%以上。将目的位点的序列按ITS--(483 bp - 732 bp - 434 bp)顺序进行多位点聚类分析,选择CPC 19962作为外群,用最大似然法(ML)构建系统发育树。结果表明:菌株FWY27、Y111和CCY11与的参考菌株以71%的自举值聚成一簇;CCY21、CCY31、CCY51、CCY71和FWY40与的参考菌株以75%的自举值聚成一簇(图4)。测试菌株信息及其GenBank登录号如表1所示。
Figure 5 Symptoms observed in the tea leaves of cv.after inoculation for 14 days

表2 茶树轮斑病菌对3种杀菌剂的敏感性测定
2.4 致病性测定
将8株代表性菌株接种到‘舒茶早’离体枝条的叶片上,对于不产孢的2株菌株(CCY51和CCY31)采用菌丝块进行接种,其余产孢菌株采用分生孢子悬浮液进行接种。结果显示,属于和菌株均具有致病性,且各菌株间表现出不同的致病性。接种7 d后,菌株CCY71、Y111、CCY21和CCY31引起接种点病斑扩展,联结成近圆形的褐斑,边缘产生轮纹,接种14 d后病斑中部变成灰白色,且伴随有黑色漆状小颗粒产生,表现出较强的致病性;菌株FWY40、CCY51和 CCY11接种7 d后,引起茶树叶片部分接种点病斑联结,形成不规则形褐色病斑,致病力较弱,其中菌株FWY27致病力最弱,接种14 d后仅产生褐色斑点(图5)。
2.5 茶树轮斑病菌对3种杀菌剂的敏感性
由表2可知,供试的茶树轮斑病菌菌株对苯醚甲环唑和戊唑醇表现出敏感性。测试的3株和5株对苯醚甲环唑的EC50分别为0.035 0 ~ 0.078 6 μg·mL-1和0.063 1 ~ 0.267 5 μg·mL-1。3株和5株对戊唑醇的EC50值分别为0.466 2 ~ 1.028 6 μg·mL-1和0.845 5 ~ 1.582 6 μg·mL-1。2株和5株对多菌灵EC50分别为0.126 3 ~ 0.164 7 μg·mL-1和0.130 7 ~ 0.155 3 μg·mL-1。测试菌株CCY11对多菌灵表现出抗性,多菌灵在1 μg·mL-1浓度下对该菌株的抑制率仅有20%。
3 讨论与结论
传统的拟盘多毛孢属分类主要依靠形态学特征,但在环境等条件影响下,形态学特征不能准确区分拟盘多毛孢属内的种[12]。Maharachchikumbura等研究表明,基于ITS、和的多位点序列分析可有效区分拟盘多毛孢属内的种类[13]。目前为止,我国报道的引起茶树轮斑病的病原菌种类有、、、、、、、、、、和[3-6, 14-17]。由引起茶树轮斑病的病原菌在安徽、云南、四川、广西、浙江、台湾、江西、湖北等多地茶园被分离报道[3,6,16]。例如,Wang等[6]从云南等13个省地茶园分离获得168株茶树轮斑病的病原菌,其中分离频率达到23.8%;Tsai等从台湾茶园分离鉴定了33株茶树轮斑病的病原菌,分离频率为6.1%[3]。由引起的茶树轮斑病在我国贵州、安徽、重庆、云南、四川、广西、浙江、台湾、湖南、广东、河南、福建、湖北等地也被报道[3,5-6,15-16]。本研究通过对福建和安徽茶园的茶树轮斑病的病原调查,确定引起茶树轮斑病的病原菌种类为和,其分离频率分别为37.5%和62.5%。由引起的茶树轮斑病在福建地区为首次报道。这表明和可能是引起我国茶树轮斑病的优势种。
化学防治仍是当前防治茶树轮斑病的主要措施。研究发现,茶树轮斑病菌对苯醚甲环唑、嘧菌酯、丙环唑、百菌清、甲基托布津、多菌灵和恶霉灵均具有敏感性,而对代森锰锌的敏感性较差[18-19];茶树轮斑病菌和对苯醚甲环唑和戊唑醇也分别表现出较高的敏感性[14, 20]。本研究结果表明,从福建和安徽分离的茶树轮斑病菌和对苯醚甲环唑、戊唑醇和多菌灵均有较强的敏感性。苯醚甲环唑和戊唑醇为三唑类脱甲基抑制剂,其作用机理是抑制病原真菌的麦角甾醇的生物合成。多菌灵为苯并咪唑类杀菌剂,其通过干扰病原菌有丝分裂中纺锤体的形成,影响细胞分裂,进而达到抑菌的目的。由于引起茶树轮斑病的病原种类多样,结合本研究以及前人的研究结果,建议苯醚甲环唑、戊唑醇作为防治茶树轮斑病的优选药剂,以此加强对不同茶区茶树轮斑病的有效管理。
[1] 刘仲华, 黄建安, 龚雨顺, 等. 茶叶功能成分的健康作用研究新进展[J]. 中国茶叶, 2021, 43(9): 1-11.
[2] HAJIBOLAND R. Environmental and nutritional requirements for tea cultivation[J]. Folia Hortic, 2017, 29(2): 199-220.
[3] TSAI I, MAHARACHCHIKUMBURA S S N, HYDE K D, et al. Molecular phylogeny, morphology and pathogenicity ofspecies on Ixora in Taiwan [J]. Mycol Progress, 2018, 17(8): 941-952.
[4] 张欣, 卢声洁, 程宇豪, 等. 茶轮斑病致病病原菌的鉴定[J]. 贵州农业科学, 2020, 48(12): 62-68.
[5] 李冬雪, 赵晓珍, 王勇, 等. 贵州惠水县茶轮斑病病原菌的鉴定[J]. 热带作物学报, 2018, 39(9): 1827-1833.
[6] WANG S S, MI X Z, WU Z R, et al. Characterization and pathogenicity of-like species associated with gray blight disease onin Anhui Province, China[J]. Plant Dis, 2019, 103(11): 2786-2797.
[7] WHITE T J, BRUNS T, LEE S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//PCR Protocols. Amsterdam: Elsevier, 1990: 315-322.
[8] GLASS N L, DONALDSON G C. Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes[J]. Appl Environ Microbiol, 1995, 61(4): 1323-1330.
[9] O'DONNELL K, CIGELNIK E. Two divergent intragenomic rDNA ITS2 types within a monophyletic lineage of the fungusare nonorthologous[J]. Mol Phylogenet Evol, 1997, 7(1): 103-116.
[10] O'DONNELL K, KISTLER H C, CIGELNIK E, et al. Multiple evolutionary origins of the fungus causingdisease of banana: concordant evidence from nuclear and mitochondrial gene genealogies[J]. Proc Natl Acad Sci USA, 1998, 95(5): 2044-2049.
[11] CARBONE I, KOHN L M. A method for designing primer sets for speciation studies in filamentous ascomycetes[J]. Mycologia, 1999, 91(3): 553-556.
[12] 韦继光, 徐同, 潘秀湖, 等. 拟盘多毛孢属的分类学研究进展[J]. 广西农业生物科学, 2006, 25(1): 78-85.
[13] MAHARACHCHIKUMBURA S N, HYDE K D, GROENEWALD J Z, et al.revisited[J]. Stud Mycol, 2014, 79: 121-186.
[14] CHEN Y J, WAN Y H, ZENG L, et al. Characterization ofcausing gray blight disease on tea leaves () in Chongqing, China[J]. Can J Plant Pathol, 2021, 43(3): 413-420.
[15] CHEN Y J, ZENG L, SHU N, et al.-like species causing gray blight disease onin China[J]. Plant Dis, 2018, 102(1): 98-106.
[16] WANG Y C, XIONG F, LU Q H, et al. Diversity of-like species causing gray blight disease of tea plants () in China, including two novelspecies, and analysis of their pathogenicity[J]. Plant Dis, 2019, 103(10): 2548-2558.
[17] 卢声洁, 赵兴丽, 罗林丽, 等. 一株茶轮斑病病原菌的分离鉴定及致病力[J]. 茶叶通讯, 2021, 48(2): 253-258.
[18] 陈雅丽, 陈文艳, 侯囡嵩, 等. 安徽池州市茶轮斑病病原鉴定及4种杀菌剂对其抑制性[J]. 安徽农业大学学报, 2019, 46(2): 209-213.
[19] 郭世保, 陈俊华, 史洪中. 几种杀菌剂对茶轮斑病菌的室内毒力及田间药效[J]. 贵州农业科学, 2014, 42(10): 130-132.
[20] 任亚峰. 茶假拟盘多毛孢的药剂活性筛选以及抑菌机制的研究[D]. 贵阳: 贵州大学, 2019.
Identification of pathogen causing gray blight onfrom Fujian and Anhui provinces and their sensitivity to three fungicides
LI Qingyu, DENG Qiang, LIU Jiaojiao, ZHANG Lixin
(Key Laboratory of Biology and Sustainable Management of Plant Diseases and Pests of Anhui Higher Education Institutes, School of Plant Protection, Anhui Agricultural University, Hefei 230036)
From 2017 to 2021, diseased leaves of gray blight onwere collected from tea plants in Fujian and Anhui provinces, and the pathogens of tea gray blight were obtained and identified by morphology characteristics, multi-loci sequence analysis and Koch’s postulate test. The results indicated that a total of 40 isolates showed four types in colony morphology. The conidia were similar, and they were spindle shaped, straight or slightly curved, with three brown cells in the middle and transparent cells at both ends. Based on the PCR amplification, sequencing and multi-loci sequence analysis ofITS,andgenes for representative isolates, they were identified asands, respectively. This was the first report ofcausing gray blight onin Fujian Province. Furthermore, it was determined for the sensitivity of the pathogen to three fungicides in this study. The results showed that the tested isolates had the highest sensitivity to difenoconazole, with an EC50value of 0.035 0 - 0.267 5 μg·mL-1, followed by tebuconazole and carbendazim, with an EC50value of 0.126 3 - 1.582 6 μg·mL-1. In conclusion, difenoconazole and tebuconazole can be selected as the priority to control gray blight disease of.
;like species; identification; phylogenetic analysis; fungicides screening
S435.711
A
1672-352X (2023)05-0835-07
10.13610/j.cnki.1672-352x.20231030.020
2023-10-31 12:02:03
[URL] https://link.cnki.net/urlid/34.1162.S.20231031.0912.002
2022-11-01
安徽省留学回国人员创新创业扶持计划项目 (2020LCX004)资助。
李庆雨,硕士研究生。E-mail:liqingyv147258@163.com
张立新,博士,教授,博士生导师。E-mail:lxzhang@ahau.edu.cn
