‘茶花’蓝莓茎段初代培养体系建立
2023-11-22朱秀蕾余碧霞
朱秀蕾,张 林,余碧霞
(安庆职业技术学院农林与服装学院,安庆 246003)
蓝莓(Vacciniumspp.)属杜鹃花科越桔属多年生灌木,又称蓝浆果或越桔,落叶或常绿果树,果实为小浆果类,果皮较薄,果肉酸甜,原产地和主要产区均在北美洲地区[1]。由于蓝莓果实具有很高的营养价值和保健功能,可以改善人类亚健康状况,被国际粮农组织列为人类五大健康食品之一[2]。‘茶花’蓝莓又称为卡米尔蓝莓,美国佐治亚大学2005年推出的中早熟南高丛蓝莓品种,植株高且枝条生长旺盛,直立,树冠开张但冠幅较窄,果粒大,果实亮蓝色,果蒂痕小而干,果实硬度好且风味佳,适合鲜食市场。传统的扦插繁殖和种子繁殖耗时长、效率低,采用植物组织培养技术可快繁蓝莓种苗[3]。目前‘茶花’蓝莓品种初代培养的研究鲜有报道,所以本研究以‘茶花’蓝莓为试材,探讨灭菌剂、诱导培养基、增殖培养基等因素对‘茶花’蓝莓初代培养的影响,从而为‘茶花’蓝莓组培快繁体系的建立奠定基础。
1 材料与方法
1.1 试验材料
供试材料:‘茶花’蓝莓当年新抽出的半木质化茎段,采自安庆职业技术学院园林园艺基地。
供试试剂:玉米素(zeatin,ZT),上海阿拉丁生化科技股份有限公司;6-苄氨基嘌呤(6-benzylaminopurine,6-BA),上海宇航生物科技有限公司;吲哚-3乙酸(3-indoleacetic acid,IAA),广州市林国化肥有限公司。
供试培养基:改良WPM培养基中加入7 g/L琼脂和30 g/L蔗糖[4]。
1.2 试验方法
1.2.1 外植体选择与处理 将采集的‘茶花’蓝莓带腋芽茎段放入有少量洗衣粉的清水中清洗,然后用解剖刀切割成2~3 cm段,先在流水下不断冲洗30 min,再用无菌水冲洗,沥干水后,将试材放到超净工作台[5]。
1.2.2 外植体灭菌剂处理 将75%乙醇和2.5%次氯酸钠溶液2种灭菌剂设为2个因素,按不同的灭菌时间设置3个水平,A1、A2、A3分别为75%乙醇漂洗10、20、30 s;N1、N2、N3分别为2.5%次氯酸钠溶液消毒5、10、15 min;交叉组合共9个处理(A1N1、A1N2、A1N3、A2N1、A2N2、A2N3、A3N1、A3N2、A3N3),重复3次。
1.2.3 外植体接种 将茎段与灭菌剂接触的两头剪掉,茎段截成0.5~0.7 cm作为外植体接种于培养基中,改良WPM+琼脂7 g/L+蔗糖30 g /L,pH 5.8,重复3次,每处理接种5瓶,每个培养瓶接种10个外植体,置于温度为(28±2)℃、光照强度为1 500~2 000 lx、光照时间为12 h/d下培养,10 d后统计‘茶花’蓝莓茎段外植体成活率。外植体成活率(%)=外植体成活总数/接种外植体数×100。
1.2.4 诱导培养基筛选 将灭菌的‘茶花’蓝莓茎段外植体分别接种到改良WPM,附加不同质量浓度配比的6-BA、ZT诱导培养基中。6-BA质量浓度设置4个水平,B1、B2、B3、B4的6-BA质量浓度分别为0.5、1.0、1.5、2.0 mg/L;ZT质量浓度设置3个水平,Z1、Z2、Z3的ZT质量浓度分别为0.5、1.0、1.5 mg/L;交叉组合共12个处理(B1Z1、B1Z2、B1Z3、B2Z1、B2Z2、B2Z3、B3Z1、B3Z2、B3Z3、B4Z1、B4Z2、B4Z3),重复3次,每处理接种5瓶,每个培养瓶接种10个外植体,置于温度为(28±2)℃、光照强度为 1 500~2 000 lx、光照时间为12 h/d下培养,30 d后统计‘茶花’蓝莓丛生芽诱导率。丛生芽诱导率(%)=不定芽诱导总数/接种外植体数×100。
1.2.5 增殖培养基筛选 经诱导培养基生成的丛生芽分别接种到改良WPM,附加不同质量浓度配比的IAA、ZT增殖培养基中。IAA质量浓度设置3个水平,I1、I2、I3的IAA质量浓度分别为0.5、1.0、1.5 mg/L;ZT质量浓度设置3个水平,Z1、Z2、Z3的ZT质量浓度分别为1.0、1.5、2.0 mg/L;交叉组合共9个处理(I1Z1、I1Z2、I1Z3、I2Z1、I2Z2、I2Z3、I3Z1、I3Z2、I3Z3),重复3次,每处理接种5瓶,每个培养瓶接种10个丛生芽,置于温度为(28±2)℃、光照强度为1 500~2 000 lx、光照时间为12 h/d下培养,30 d后统计‘茶花’蓝莓丛生芽增殖率。丛生芽增殖率(%)=丛生芽分化总数/接种外植体数×100。
1.3 数据分析
采用DPS 2006软件统计试验数据进行方差分析,采用Turkey检验法进行组间显著性差异检验。
2 结果与分析
2.1 不同灭菌剂对‘茶花’蓝莓茎段外植体成活率的影响
由表1可知,‘茶花’蓝莓茎段外植体在A3N2处理中成活率与其他处理比较差异显著,在A2N2和A3N3处理、A1N3和A2N1处理中成活率差异不显著。如果灭菌时间较短,‘茶花’蓝莓茎段外植体接种后第3天出现污染,A1N1处理污染严重。随着消毒时间延长,污染率逐渐下降。如果75%乙醇和2.5%次氯酸钠溶液灭菌时间过度,外植体成活率降低。综上,A3N2处理灭菌效果最好,外植体成活率最高,为96.21%,所以‘茶花’蓝莓茎段外植体表面灭菌除了选择合适的灭菌剂种类外,选择合适的灭菌时间也很重要。
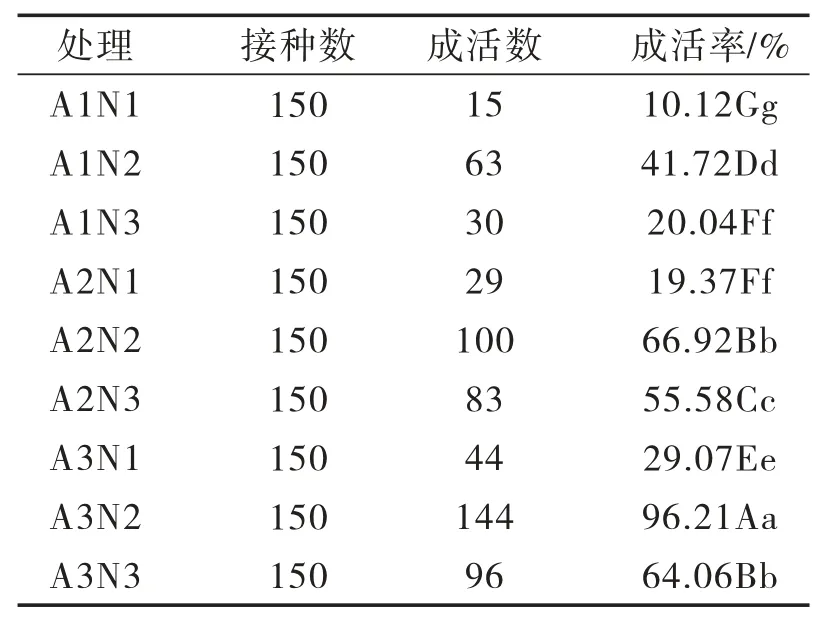
表1 不同灭菌剂对‘茶花’蓝莓茎段外植体成活率的影响
2.2 不同6-BA、ZT处理对‘茶花’蓝莓茎段外植体丛生芽诱导率的影响
由表2可知,‘茶花’蓝莓茎段在B3Z2处理中丛生芽诱导率与其他处理比较差异显著,在B2Z3、B3Z1、B3Z3、B4Z2处理中对丛生芽诱导率的影响差异不显著。‘茶花’蓝莓茎段丛生芽诱导主要受培养基中细胞分裂素调控,6-BA对‘茶花’蓝莓茎段丛生芽诱导率存在一定的影响,但效果显著低于ZT。当ZT质量浓度为0.5~1.5 mg/L时,‘茶花’蓝莓茎段丛生芽诱导率呈先升高后降低的趋势,当ZT质量浓度为1.0 mg/L时,‘茶花’蓝莓茎段丛生芽诱导率最高。综上,在B3Z2处理中诱导效果最好,‘茶花’蓝莓茎段外植体丛生芽诱导率最高,为97.91%。
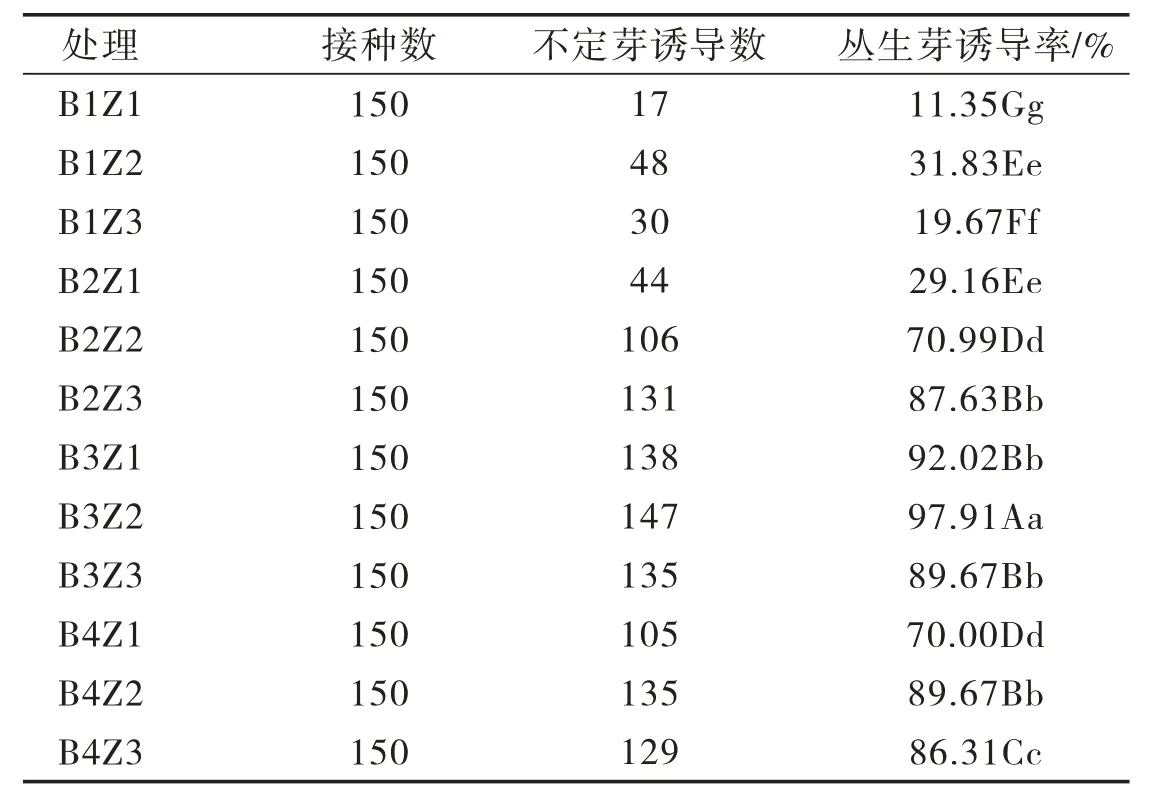
表2 6-BA、ZT配比对‘茶花’蓝莓茎段外植体丛生芽诱导率的影响
2.3 不同IAA、ZT处理对‘茶花’蓝莓丛生芽增殖率的影响
由表3可知,‘茶花’蓝莓在I2Z2处理中丛生芽增殖率与其他处理比较差异显著,在I1Z2和I2Z1处理中对丛生芽增殖率差异不显著。‘茶花’蓝莓茎段丛生芽增殖主要受培养基中生长素和细胞分裂素调控,IAA对‘茶花’蓝莓茎段丛生芽增殖率存在一定的影响,但效果显著低于ZT。当ZT质量浓度为1.0~2.0 mg/L时,‘茶花’蓝莓茎段丛生芽增殖率呈先升高后降低的趋势,当ZT质量浓度为1.5 mg/L时,‘茶花’蓝莓丛生芽增殖率最高。综上,在I2Z2处理中增殖效果最好,‘茶花’蓝莓丛生芽增殖率最高,为93.01%
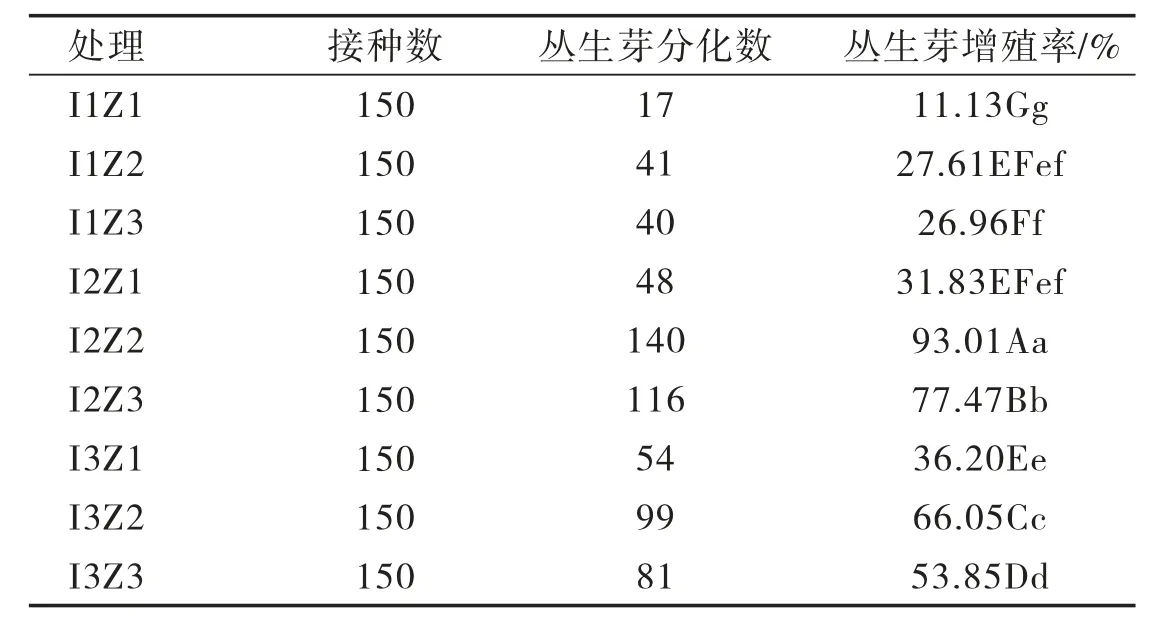
表3 IAA、ZT配比对‘茶花’蓝莓丛生芽增殖率的影响
3 讨 论
3.1 不同灭菌剂处理对‘茶花’蓝莓茎段外植体成活率的影响
外植体消毒是植物组织培养无菌培养体系构建的第一步。外植体从室外采集时上面附着大量的细菌和病毒,灭菌剂的种类、浓度、灭菌时间直接影响外植体的灭菌效果,金如意等[6]研究表明,5%NaClO溶液消毒10 min,再用0.1% HgCl2溶液消毒7 min外植体的消毒效果最好。但是因HgCl2溶液有剧毒,在实际生产中存在着巨大的安全隐患,所以笔者通过试验寻求既安全又高效的灭菌方法,在‘茶花’蓝莓的组织培养过程中,研究不同灭菌剂对‘茶花’蓝莓茎段外植体成活率的影响。本研究表明,如果灭菌时间较短,‘茶花’蓝莓茎段外植体接种后第3天出现污染。随着消毒时间延长,污染率逐渐下降,而75%乙醇和2.5%次氯酸钠溶液灭菌时间过度,外植体的成活率降低。
3.2 不同植物生长调节剂组合对‘茶花’蓝莓初代培养的影响
植物生长激素中的细胞分裂素对蓝莓丛生芽的诱导和增殖起到了至关重要的作用,且蓝莓品种不同所适用的细胞分裂素种类和用量也不同。廉家盛等[7]研究表明,ZT对蓝莓丛生芽的诱导和增殖具有显著效果,且不同的蓝莓品种用量也有差别。本研究表明,在‘茶花’蓝莓初代培养过程中,当ZT质量浓度为0.5~1.5 mg/L时,‘茶花’蓝莓茎段外植体丛生芽诱导率呈先升高后降低的趋势,当ZT质量浓度为1.0 mg/L时,‘茶花’蓝莓茎段外植体丛生芽诱导率最高。当ZT质量浓度为1.0~2.0 mg/L时,‘茶花’蓝莓丛生芽增殖率呈先升高后降低的趋势,当ZT质量浓度为1.5 mg/L时,‘茶花’蓝莓丛生芽增殖率最高。而6-BA对‘茶花’蓝莓丛生芽诱导率存在一定的影响,但效果显著低于ZT,与李森等[8]研究结论一致。IAA对‘茶花’蓝莓丛生芽增殖率存在一定的影响,但效果显著低于ZT。本研究对‘茶花’蓝莓初代培养进行了探讨,为‘茶花’蓝莓品种的工厂化育苗和商品基地的建设奠定了基础,对‘茶花’蓝莓的生根培养、驯化移栽还需进一步研究。
4 结 论
本研究表明‘茶花’蓝莓茎段外植体在初代培养过程中,‘茶花’蓝莓茎段外植体用75%乙醇浸泡30 s,再用2.5%次氯酸钠溶液浸泡10 min,灭菌效果最好,成活率最高。改良WPM+6-BA 1.5 mg/L+ZT 1.0 mg/L诱导培养基最适宜茎段腋芽诱导;改良WPM+IAA 1.0 mg/L+ZT 1.5mg /L增殖培养基最适宜再生芽增殖。在植物组培初代培养过程中,影响制约外植体成苗的因素很多,本研究仅对‘茶花’蓝莓灭菌剂种类、激素质量浓度和种类进行了初探,其他不同激素配比、光照条件等因素仍需要进一步研究。
