流速对黑鲷幼鱼游泳行为及运动生理的影响
2023-11-22汤保贵陈秀灿胡长圣戴佳玥王学锋2静2
汤保贵 陈秀灿 胡长圣 戴佳玥 王学锋2 张 静2
(1.广东海洋大学水产学院,湛江 524088;2.南方海洋科学与工程广东省实验室(湛江),湛江 524025;3.广东省水产经济动物病原生物学及流行病学重点实验室,湛江 524088)
增殖放流作为海洋牧场的主要操作方式,是补充和恢复生物资源的一种常见的修复措施,也是最为有效的修复手段[1,2],它可以维护生态系统,优化渔业资源结构,改善海域生态环境[3]。世界鲑科鱼类增殖放流持续了150多年取得了成功;挪威鳕(Gadus morhua)增殖放流经过100多年的反复试验最终停止了;日本的栽培渔业50年总结为“未取得令人满意的成果”[1],可见增殖放流是一项非常复杂的系统工程[4]。我国渔业增殖放流的历史较短,始于20世纪70—80年代,规模和影响都较小;规模化发展活跃于近十余年[1]。近年来,各级地方政府和渔业主管部门在不同季节举行了持续大规模的增殖放流活动,但放流者在选择适宜放流对象、确定放流种苗最佳规格和数量、合理配比投放结构等方面存在着一定的盲目性,绝大多数渔业生物资源的增殖放流并没有达到预期的效果,苗种放流后生存适应性差、放流存活率低,严重影响了增殖效果;放流效果的评估往往在放流个体进入渔业阶段后就停止了,放流基础研究滞后[5,6],已成为制约海洋牧场增殖放流成效提升的主要因素之一[7]。人工放养鱼类的死亡有很多原因,主要包括人工繁殖鱼类本身的身体机能不完善、遗传缺陷、疾病的发生、放流后在自然水体中低的摄食能力和反捕食能力,以及与野生个体相比竞争力不足等;同时,放流鱼类体质、规格和放流地点的选择也可能对放流鱼类的存活率造成影响。在众多影响放流鱼类存活率的因素中,放流鱼类摄食-反捕食能力的不足被认为是直接导致死亡率高的重要因素,游泳能力偏低是导致放流个体摄食和反捕食能力下降的原因之一;鱼类的游泳能力,特别是暴发游泳速度,在鱼类摄食和逃避敌害的过程中发挥了重要的作用,任何影响鱼类游泳能力的因素都可能影响到鱼类摄食和反捕食的成功率[8];另一项研究证明了游泳能力和捕食风险之间的相关性,在许多鱼类中,暴发游泳速度,最快的无氧速度,比持续的游泳速度更有助于避免捕食者的攻击和获得食物[9]。大量研究表明,孵化场养殖的鱼在放流前短时间置于室外的池塘能提高放流后存活率;放流前对鱼种进行适当的游泳运动驯化能有效地改善鱼体的生理机能,增强免疫能力,提高野外存活率[10—13]。
目前,国内外关于鱼类游泳能力及运动生理、力竭运动后恢复能力的研究主要集中在大洋洄游性鱼类如鲑科鱼类等的研究上[14,15],还有对大口鲈、大西洋鳕、虹鳟、草鱼、鲢、鳙、鲤及裂腹鱼等淡水鱼类和河流性鱼类的研究[16—22]。适于近海网箱养殖及增殖放流的鱼种主要有黑鲷、大黄鱼和美国红鱼等。其中黑鲷(Acanthopagrus schlegelii),别称乌颊鱼、黑立、黑加吉等,隶属鲈形目(Perciformes),鲷科(Sparidae),棘鲷属(Acanthopagrus),是暖温广盐性底栖鱼类,又是沿岸性鱼类,一般不作长距离洄游,是沿海增殖放流的优良品种,放流水域遍及渤海、黄海、东海和南海四大海区[23,24]。近几年,关于黑鲷游泳能力和运动生理的研究逐渐增多,桂福坤等[25]研究了适应条件对鱼类续航游泳能力的影响;虞顺年等[26]研究了运动训练对黑棘鲷生长、抗氧化能力和非特异性免疫的影响并对黑鲷的适宜放流规格进行了探讨;又对不同运动强度下黑鲷生长、血清和肝脏抗氧化指标进行了研究[13];李丹丹等[27]对黑鲷幼鱼力竭运动后代谢酶活性的恢复水平进行了研究;娄宇栋等[28]对黑鲷幼鱼的游泳喜好进行了研究;张艺等[29]对池塘跑道式养殖黑鲷进行了初步研究;王裕玉等[23]对不同养殖模式下黑鲷生长、血清生化指标及抗氧化性能进行了研究;柴若愚等[30]研究了水流速度对黑鲷续航游泳能力及生理代谢的影响;还有从人工鱼礁不同形态导致不同流速分布的角度对黑鲷幼鱼聚集效果进行了研究[31,32]等。上述研究基本都是预先选定流速进行研究,缺少对黑鲷基本游泳能力的探究,本研究首先对黑鲷幼鱼的游泳能力(包括感应流速、临界游泳速度和暴发游泳速度等)进行测定并据此设定不同流速梯度,研究差异流速下黑鲷幼鱼的游泳行为及运动生理,研究结果可为黑鲷网箱养殖、野化训练等提供技术支持。
1 材料与方法
1.1 实验鱼苗与装置
实验时间为2021年11—12月,实验黑鲷鱼苗来自广东湛江海思特水产科技有限公司,体长为(12.38±0.69) cm,体重为(45.99±9.05) g;为减轻鱼类的应激反应,将实验鱼先置于室内养殖桶静水条件下暂养7d。每天投喂两次(8: 00和17: 00;广东粤海思路集团的海水鱼料),日投饲量约为体重的2%,喂食期间停止充氧。日换水量约为50%,溶解氧保持在7.0 mg/L以上,水温控制在(19.0±0.5)℃,盐度16.0±1.0。实验前禁食48h。
采用丹麦Loligo Systems公司生产的大型游泳水槽SY28060进行测定,该水槽的流速调节范围为0—120 cm/s。水槽测试段体积为10 L,可与外部长方体水槽结构进行水体循环交换也可密封,测试区规格为40 cm×10 cm×10 cm。通过电脑软件控制螺旋桨转动产生流速变化和水体交换,水流通过蜂窝状稳流配件保证仪器试验区的流场均匀稳定。整个系统包括: 环形水槽、电机、水泵、Witrox温度溶氧采集终端、DAQ-BT蓝牙数据采集终端和仪器配套软件AutoRespTM(图1)。

图1 丹麦Loligo System泳道呼吸仪Fig.1 Swim tunnel respirometer of Loligo system
仪器工作原理: 在试验前,通过两点校正法(饱和溶氧和零溶氧)在AutoRespTM中进行溶氧探头校准。流速校准采用两点校准(0和5 V电压下的速度),利用德国Hoentzsch GmbH公司生产的叶轮式流量计进行校准。
1.2 感应流速、临界游泳速度和暴发游泳速度的测定
在暂养桶内每次取1尾鱼,将其头部顺流方向置于测试水槽中,适应1h以减少转运应激反应,然后采用“流速递增法”测定: 流速从0开始每隔5s提升1 cm/s,同时观察鱼的游泳行为,当鱼掉转头部方向发生逆流游泳时,记录此时的流速为感应流速[33],共测试16尾。
临界游泳速度和暴发游泳速度的测定方法几乎相同。每次取1尾鱼置于水槽测试区域,在1 BL/s(体长/s)流速下适应1h后,采用递增流速法[15],若水流速度每20min增加约1 BL/s,直至鱼游泳疲劳(鱼贴至测试隔网处20s,仍不能重新游动,视为疲劳[34])结束测试,此时计算的为临界游泳速度Ucrit;若水流速度每20s增加约1 BL/s,直至鱼游泳疲劳结束测试,则此时计算的为暴发游泳速度。每种流速下各测试16尾。
1.3 摆尾频率的测定
分别设置1、2、3、4、5、6和7 BL/s共7个流速组,每组6尾鱼。将鱼静水条件下适应1h后开始在各流速下使用录像机对每尾鱼的游泳行为持续拍摄记录10min,拍摄过程中用隔板遮挡在水槽周围,以防干扰。将录制的视频,通过KMPlayer视频软件进行逐帧分析,选取4个连续的1min片段计算摆尾频率(Tail beat frequency,TBF)。
1.4 静止耗氧率和运动耗氧率的测定
设置静止、1—6 BL/s共7个试验组,每组6尾鱼,进行静止耗氧率(Standard metabolic rate,SMR)和运动耗氧率(Activity metabolic rate,AMR)的测定。每次取1尾鱼放入水槽测试段,适应1h后密闭水槽进行4次溶解氧测定(分别在5min、10min、15min和20min)。
1.5 单位距离耗能的计算
单位距离耗能(Cost of transport,COT)的计算公式为: C OT=/U,式中,COT单位为mg/(kg·m);U为试验鱼的游泳速度(m/h);为耗氧率。
1.6 耗氧生存分析
设置0(静止组)、20%Ucrit(低流速组,约1 BL/s)、50%Ucrit(中流速组,约3 BL/s)和80%Ucrit(高流速组,约5 BL/s)共4组,每次测1尾,每组测12尾。在实验前将水槽注满水,充分曝气后放入鱼并密闭水槽开始进行实验。实验过程中仔细观察鱼的动态,并每隔10min进行一次溶解氧的测定。当鱼静卧水槽底部,侧翻,鳃盖停止运动视为死亡,此时的溶解氧浓度即为窒息点[36]。每次实验最长持续10h,记录每尾鱼的生存时间(分)及生存结局(死亡或存活)。
1.7 生化取样与测定
设置0(静止组)、20%Ucrit(低流速组,约1 BL/s)、50%Ucrit(中流速组,约3 BL/s)和80%Ucrit(高流速组,约5 BL/s)共4组,每组6尾鱼,共测定24尾。将每尾实验鱼在目标流速中运动20min后取样。在每次试验结束后立即将实验鱼取出,转入有丁香酚麻醉液(100 mg/L)的水桶中进行麻醉,待实验鱼被完全麻醉后立即测量体长并称重,随后立即抽取血液,剪取尾部白肌和肝组织。其中,血液样品用含有肝素钠的EP管收集,随后在4℃下静置2h后低温离心20min(4℃,4000 r/min),离心后收集上层血清并置于液氮罐中保存待测,取样后的肝脏和肌肉组织同样迅速放入液氮罐中,随后转置于-80℃超低温冰箱中保存。黑鲷血液中的葡萄糖、乳酸和皮质醇,肌肉中的磷酸肌酸、乳酸、糖原和肝脏中的糖原均由上海酶联生物科技有限公司采用试剂盒测定。
1.8 数据分析
感应流速、临界游泳速度和暴发游泳速度的统计采用S-W检验进行正态性检验后,各速度的测定值以平均值±标准差(mean±SD)表示;生理生化指标数据经正态性检验和方差齐性检验满足条件后进行单因素方差分析(One-way ANOVA)法进行分析,若结果出现组间差异,则用LSD多重比较法对各组数据的差异进行显著性检验,显著性水平为P<0.05;对带有结局(存活或死亡)的生存时间和流速分组进行Kaplan-Meier生存分析和Cox回归;对摆尾频率、耗氧率、单位距离耗能(COT)与流速的关系进行线性和非线性曲线拟合分析。所有数据采用Excel 2007和SPSS 26.0统计软件进行处理,图像使用Origin 2019绘制。
2 结果
2.1 感应流速、临界游泳速度和暴发游泳速度
对测定的感应流速、临界游泳速度和暴发游泳速度分别进行正态性检验(表1)。
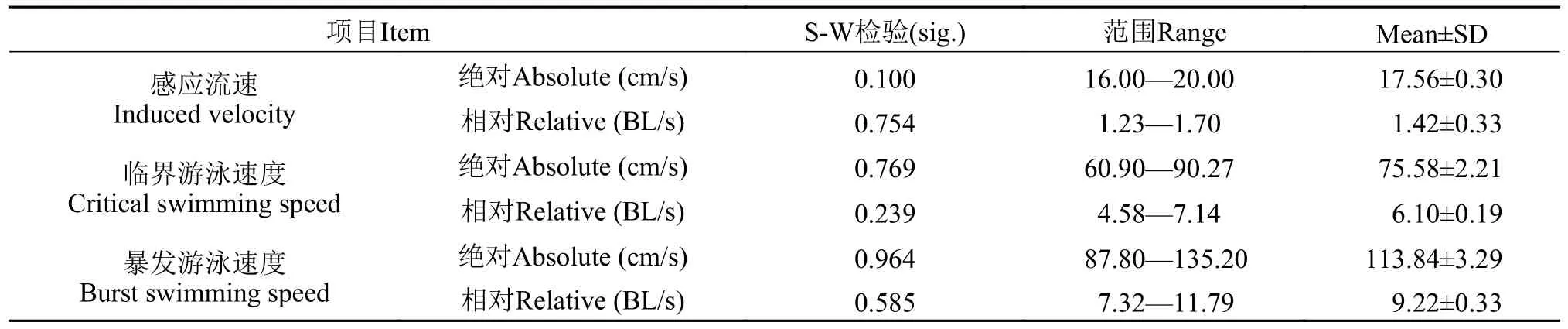
表1 黑鲷的感应流速、临界游泳速度和暴发游泳速度Tab.1 Induced velocity,critical swimming speed and burst swimming speed of Acanthopagrus schlegelii
可知测定的感应流速、临界游泳速度和暴发游泳速度均符合正态分布(P>0.05)。黑鲷的绝对感应流速为(17.56±0.30) cm/s,相对感应流速为(1.42±0.33) BL/s;绝对临界游泳速度为(75.58±2.21) cm/s,相对临界游泳速度为(6.10±0.19) BL/s;绝对暴发游泳速度为(113.84±3.29) cm/s,相对暴发游泳速度为(9.22±0.33) BL/s。
2.2 摆尾频率
黑鲷的摆尾频率与相对流速的关系如图2所示。随着流速(1—7 BL/s)的增加,摆尾频率增大且与流速呈显著的线性正相关关系,其线性方程为TBF=0.8078U+0.851(R2=0.7847,P<0.05)。
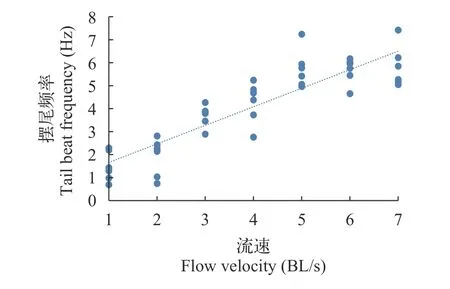
图2 黑鲷的摆尾频率与流速的关系Fig.2 Relationship between tail beat frequency of Acanthopagrus schlegelii and flow velocity
2.3 耗氧率与单位距离耗能
试验测得黑鲷静止耗氧率为(332.25±165.47) mg/(kg·h)。在1—6BL/s流速下,运动耗氧率与流速呈二次多项式关系(图3),拟合方程为:16.59U2-118.69U+397.00(R2=0.933,P<0.05)。最低耗氧率出现在3.6 BL/s流速下,约为185.65 mg/(kg·h);实测静止耗氧率小于拟合方程得到的静止耗氧率397.00 mg/(kg·h)。
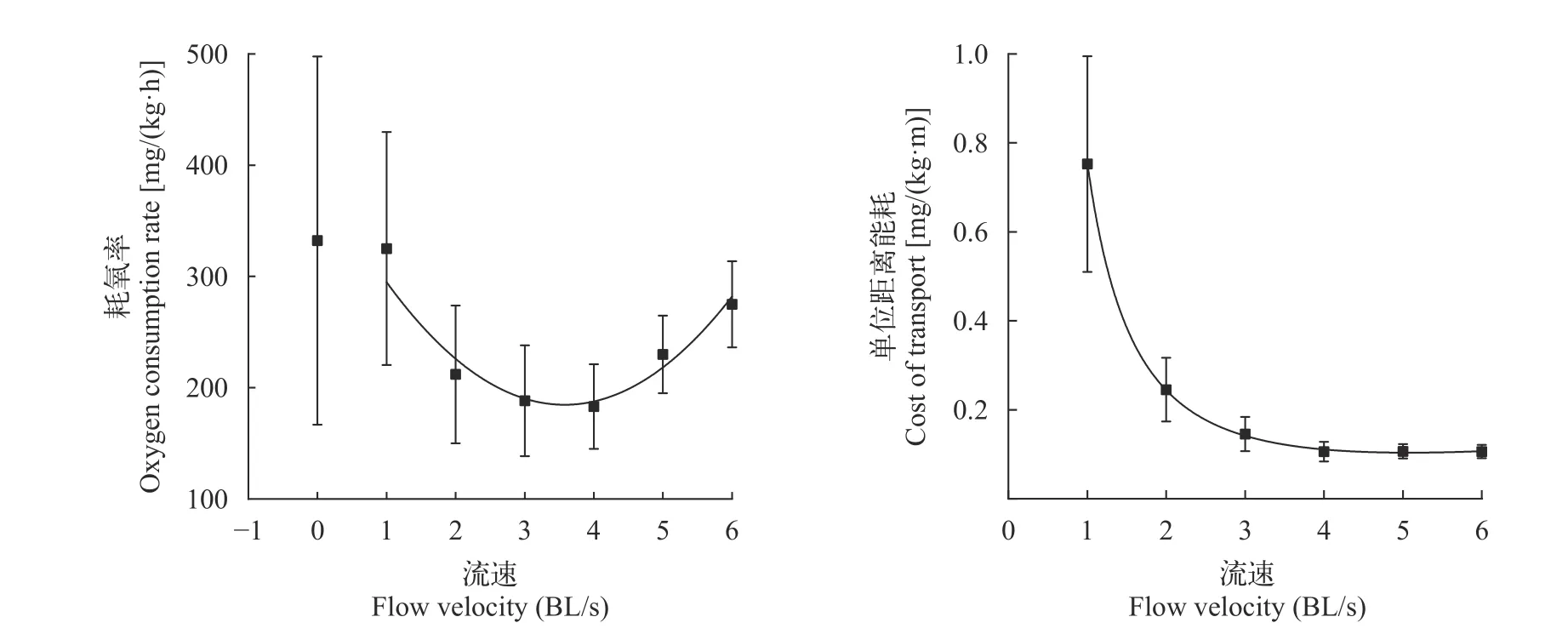
图3 黑鲷在不同流速下的耗氧率与单位距离耗能(COT)Fig.3 Oxygen consumption rate () and cost of transport (COT) of Acanthopagrus schlegelii at different flow velocities
黑鲷在不同流速条件下的单位距离耗能COT与流速呈幂函数的关系(图3),拟合方程为: COT=0.75U-1.72+0.006U1.38(R2=0.992,P<0.05)。在4 BL/s流速即约66%Ucrit流速处,COT达到最小,约为0.11 mg/(kg·m),且随着流速增加COT基本保持不变。
2.4 不同流速下黑鲷的耗氧生存分析
将带有结局(存活或死亡)的生存时间和流速分组进行Kaplan-Meier生存分析和Cox回归,结果如表2所示,生存函数如图4所示。在低、中流速组,黑鲷幼鱼的生存时间超过设定的终止时间10h,故并未测出其中位生存时间,且两组生存时间无统计学差异(P>0.05);而在静止和高流速组,黑鲷幼鱼的生存时间分别是156min(129—183min)和507min(201—813min),即2.6h(2.15—3.05h)和8.45h(3.35—13.55h),静止时中位生存时间约是高流速时中位生存时间的1/3,而死亡风险比高流速时高20.338倍(P<0.001,HR=21.338,95%CI 4.275—106.512)。
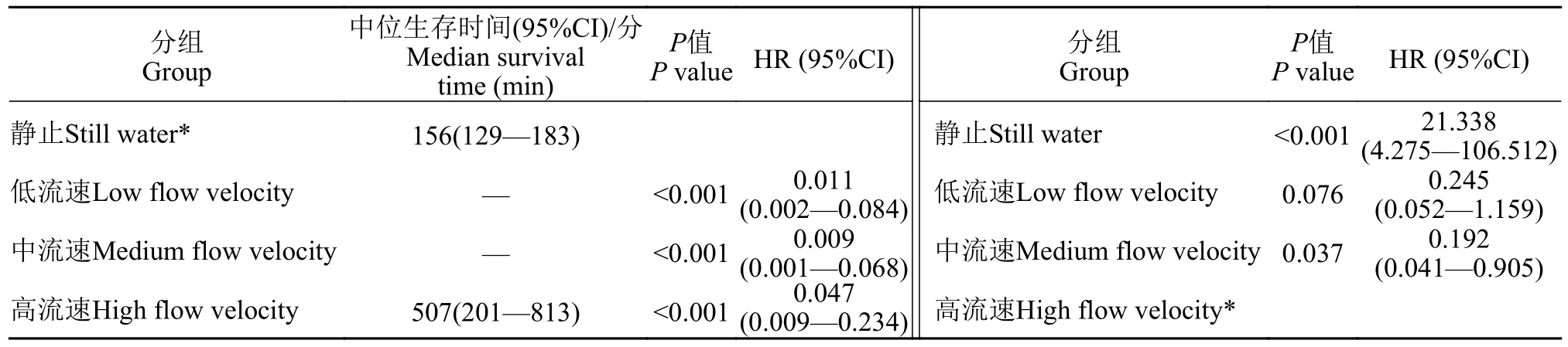
表2 不同流速下黑鲷生存时间的差异性Tab.2 Survival time difference of Acanthopagrus schlegelii at different flow velocities
实验中观察到,在静水中,初始时黑鲷幼鱼活动正常;随着时间的增长及溶氧值的降低,实验鱼以斜向上姿态游泳,呼吸明显加快,时而上下窜游,焦躁不安;溶氧值进一步降低,实验鱼逐渐丧失平衡,出现侧翻,随后侧卧在水槽底部,鳃盖张合幅度加大,出现2—3次上窜后,最后停止呼吸,整个过程不超过4h;测得的窒息点为0.34(0.23—0.52) mg/L。在低流速和中流速下,各有2尾鱼死亡,其中低流速组死亡时间分别为5.08h和5.92h,溶解氧值分别为1.68和1.69 mg/L;中流速组死亡时间分别为8.42h和9.23h,溶解氧值分别为1.69和1.72 mg/L;其余黑鲷幼鱼均持续游泳10h未窒息死亡。在高流速下,黑鲷幼鱼持续游泳10h,只有4尾存活,死亡实验鱼的窒息点为(3.18±0.76) mg/L。
2.5 流速对黑鲷幼鱼生理生化的影响
实验测得不同流速下黑鲷幼鱼肌肉、肝脏和血液中各代谢物的含量如表3所示。经正态性检验和方差齐性检验,各指标的P值均大于0.05,符合方差分析条件。方差分析结果表明,肌肉的乳酸在高流速时显著高于其他实验组;血液中的乳酸在高流速时显著高于静止实验组、静止实验组显著高于低、中流速实验组,此时肌糖原含量较低,氧化分解为乳酸后进入血液中,导致血液中乳酸较高;而低、中流速下肌糖原含量较高,血乳酸也最低;高流速下肌糖原又降低,肌乳酸和血乳酸均升高,这种变化趋势与耗氧率的一致。肝糖原在中流速时显著高于低流速、低流速显著高于静止和高流速实验组,而血液中的葡萄糖含量在高流速时显著高于其他实验组,此时肝糖原水解成葡萄糖进入血液后氧化分解供能。肌肉中磷酸肌酸的含量在中流速时显著高于低流速、低流速时显著高于静止实验组和高流速实验组,与肝糖原的变化趋势一致,表明中、低流速时肌肉中储存了较多的能量;而静止和高流速时均需要释放这种能量。血液中皮质醇的含量在高流速时显著高于中、低流速时,中、低流速时显著高于静止实验组。
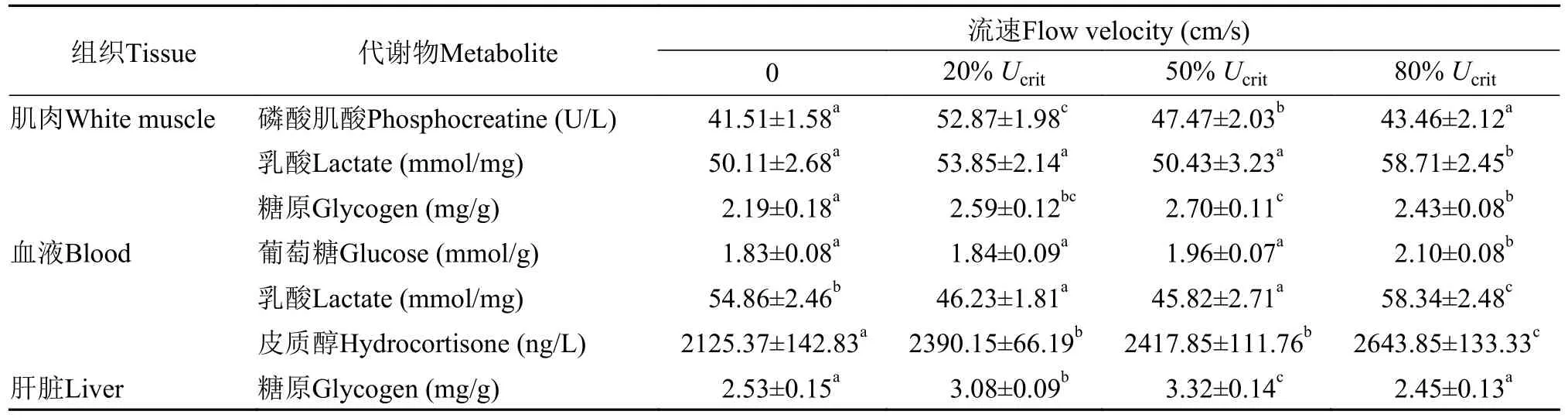
表3 不同流速下黑鲷肌肉、肝脏和血液中各代谢物的含量(平均值±标准差)Tab.3 Contents of metabolite in muscle,liver and blood of Acanthopagrus schlegelii at different flow velocities (mean±SD)
3 讨论
3.1 黑鲷幼鱼的游泳能力
感应流速是鱼类应对水流时恰能产生趋流行为反应的流速值,又名初始流速、起点流速[37]。鱼的体长因素会对其各种游速产生一定的影响,通常认为相对感应流速更能准确表达鱼类对水流流速变化的敏感度[22]。实验测得黑鲷幼鱼的相对感应流速约为1.4 BL/s,而桂福坤等[25]在研究适应条件对鱼类续航游泳能力的影响时指出黑鲷的适应流速建议控制在1.5 BL/s以内以避免测试前鱼类过多的能量损失,符合黑鲷的游泳特性。
临界游泳速度是衡量鱼类游泳能力的标准指标,首先由布雷特引入该概念,常作为评价鱼类稳定游泳运动能力的重要指标[15]。它表达了有关鱼的生态和生理以及影响游动能力的因素的重要信息,对鱼体寻找配偶、搜索食物、探寻适宜环境等方面有重要意义[38—40]。由于临界游泳速度测定时的时间步长从2min至60min不等,使用最多的是20min和30min[41],加上测试时速度增幅的影响,使得测定的临界游泳速度很难横向比较,对这一问题仍然存在很大分歧[42]。但临界游泳速度测量至少可以粗略估计鱼类的最大有氧游泳速度,通常认为它反映了最大耗氧量[43]。娄宇栋等[28]研究了大黄鱼、黑鲷和美国红鱼的游泳喜好,给出了当流速大于0.62 m/s[体长(11.31±0.80) cm]可能会给黑鲷带来不适的结论,而本实验测得相近规格黑鲷幼鱼[体长(12.38±0.69) cm]的临界游泳速度为0.76 m/s,考虑体长带来的影响,实验结果基本相当;其持续游泳能力高于相近规格大黄鱼[体长(14.13±1.24) cm,临界游泳速度0.42 m/s]的游泳能力。柴若愚等[30]研究证明体长差异不显著的美国红鱼比黑鲷具有更强的持续游泳能力。
3.2 黑鲷幼鱼的运动生理
鱼在自发游动过程中的活动主要由转弯、鳍的移动、速度的突然变化等组成;在较高的游泳速度下,会发生从自然游泳到强迫游泳的转变,同时,测得的氧含量明显下降[44]。与较高流速下的强制或定向游泳相比,由于自发运动,鱼在最低游泳速度下的运输成本相对较高。实验测得黑鲷幼鱼1 BL/s时的单位距离耗能COT约是在4 BL/s流速以上COT的6.9倍。一般认为,若鱼体在静水条件下游泳时的耗氧率明显低于流水条件,说明水流造成的趋流游泳运动会显著增加生物机体的能耗水平[45],如大马哈鱼[46]、舌齿鲈[47]、杂交鲟[48]等;但本文结果表明最低耗氧率并不是出现在静水组,而是在3.6 BL/s的流速下(约57%Ucrit)。Farrell和Steffensen[49]观察到,虽然虹鳟在休息和低游泳速度时有节奏地换气,但在转换为“撞击换气(张开嘴游泳,无鳃运动)”之前,耗氧量是增加的;当撞击换气时,耗氧量会下降,大约发生在30%Ucrit处。同样的现象也发生在耗氧生存分析和生理生化指标的测定上。从生存时间来看,低、中流速下黑鲷的中位生存时间在10h以上;静止时的中位生存时间最短,约3h,是高流速时中位生存时间的1/3,死亡风险比高流速时高约20倍。从窒息点来看,低、中流速下黑鲷生存的最低溶解氧约为1.70 mg/L,静止时最低溶解氧可降低至0.34 mg/L,而高流速时最低溶解氧约为3.18 mg/L。可见,在静水环境下,黑鲷的生存虽然可以维持在较低的溶解氧水平下,但生存时间最短;中、低流速保持了一个较低的溶解氧水平和较长的生存时间,更利于黑鲷的生存;German等[50]发现在3种流速下加州大比目鱼10周养殖后特定生长率在低流速下显著高于高流速和静水组。实验中方差分析得到黑鲷的各项生理生化指标基本分成3组,即中、低流速实验组,静止实验组和高流速实验组。中、低流速下肌糖原、肝糖原和磷酸肌酸的含量均较高,而静止实验组和高流速下血乳酸含量较高,这种变化趋势与耗氧率的一致,表明中、低流速时肌肉中储存了较多的能量;而静止和高流速时均需要释放这种能量。由上述分析可推测在57%—65%Ucrit的流速可能是黑鲷幼鱼最大有氧功率输出的流速,而Jones等[14]的研究结果显示,三文鱼的最大有氧功率输出约在80%Ucrit处。
皮质醇的含量是从静止到低、中流速到高流速依次递增的,与其他生化指标相比,并未出现“U”型的变化趋势,结合耗氧率的分析,推测静止状态和高流速下黑鲷的耗能机制可能是不一样的,前者是代谢物供给耗能而后者更可能是厌氧代谢占优势,这些还需要进一步的验证。
3.3 对网箱养殖和增殖放流的意义
Hochachka[51]证明了训练对鱼的耗氧和恢复时间有相当大的影响。Brett等[52]发现在流速为24 cm/s的水族箱中饲养银鲑比在流速较低的水族箱中饲养的银鲑表现出更高的巡航速度和较低的疲劳敏感性。本文测定的黑鲷幼鱼[体长(12.38±0.69 cm)]的临界游泳速度为0.76 m/s,考虑到临界游泳速度与体长的正相关性[41],可以推荐黑鲷网箱养殖的流速不宜超过0.8 m/s,而放流鱼苗通常小于测定鱼苗规格,可以推荐黑鲷放流鱼苗的适宜训练流速在1.5—3.5 BL/s。虽然临界游泳速度总体上随调节时间的增加而升高,但在5—10d变化相对较小[53],因此在增殖放流的野外驯化中可以选择2周以上为宜,可以提高放流鱼种在野外的生存能力。
