力竭运动胁迫对三种鲤科鱼类低氧耐受和热耐受的影响
2023-11-22张永飞黄可人罗玉莲刘蒨莹付世建
张永飞 黄可人 罗玉莲 刘蒨莹 庞 旭 付世建
(1.重庆师范大学进化生理与行为学实验室,重庆市动物生物学重点实验室,重庆 401331;2.西南大学水产学院,重庆 400715)
运动是动物生存和繁衍的基础,伴随着复杂的生理过程。鱼类的运动可分为游泳运动(洄游、捕食等)和非游泳运动(跳跃、滑翔等)两种方式,它们对于鱼类的生长、生存及繁殖都具有十分重要的生态学意义[1,2]。鱼类的热耐受和低氧耐受能力也是决定其物种分布、栖息地变迁、能否适应气候变化等的重要生理特征。在自然状态下,鱼类总是处于运动或运动后恢复的过程,根据运动激烈程度的不同,运动后的鱼类可能出现完全力竭或部分力竭的状态。此时,由于运动后能源物质更新、代谢废物处理等生理过程的影响,鱼类的能量代谢将在相当长的时间内处于较高水平,而鱼类的最大代谢率(Maximum metabolic rate,MMR)没有发生改变,有氧代谢空间(Aerobic scope,即MMR和维持代谢率之差)缩小。由Ern[3]提出的氧和温度限制的代谢生态位理论(Oxygen-and temperature-limited metabolic niche)认为,最大代谢率与温度间呈“钟形”曲线关系,而维持代谢率随着温度的升高呈指数曲线增加,结果是温度进一步上升,其代谢空间将降至0;而后开启无氧代谢,当无氧代谢也无法维持机体能量需求时,鱼类则达到温度耐受极限而死亡。鱼类面临水体环境缺氧时与之类似,因维持代谢需求保持稳定,而随环境溶氧的降低,其摄氧能力也会下降,当有氧代谢无法满足维持代谢需求时,即达到临界氧压(Critical oxygen tension,Pcrit);随后将开启无氧代谢直至死亡。因此,鱼类维持代谢率发生改变后,鱼类的低氧耐受能力和热耐受能力可能会随之改变,这对于鱼类面临极端环境变化(如热浪、洪水等)是十分不利的。
已有研究发现,不同鱼类在摄食后运动时,其功率输出受不同器官和组织位点的限制,如,金鱼(Carassius auratus)和中华倒刺鲃(Spinibarbus sinensis)受到“心鳃”系统供氧的限制,而鲤(Cyprinus carpio)“心鳃”系统供氧能力能够支持两种生理功能同时完成,它们表现出不同的代谢模式[1,4]。由于经长期人工驯化和选择,金鱼具有较高的摄食代谢功率分配,属于“摄食优先模式”[5];中华倒刺鲃偏好流水生境,具有较强的运动代谢需求且属于“运动优先模式”[6];鲤分布广泛,生理调节和适应能力强,摄食和运动功率分配均处于中等水平,表现出“添加模式”。因此,不同鱼类运动后其恢复过程中的低氧耐受和热耐受可能有所不同。
本研究以这3种鲤科鱼类为对象,在经力竭运动胁迫后,测定临界氧压(Critical oxygen tension,Pcrit)、失衡点(Loss of equilibrium,LOE)、临界代谢率(Critical metabolic rate,CMR)和边际代谢率(Marginal metabolic rate,Marginal MR)等低氧耐受参数和临界温度[Critical temperature,CT(临界高温,CTmax和临界低温,CTmin)、致死温度LT(致死高温,LTmax和致死低温,LTmin)]热耐受指标,旨在为动物生理生态领域研究提供基础。
1 材料与方法
1.1 实验材料
自重庆市当地水产养殖场购买的3种实验幼鱼,首先在实验室水生物养殖系统(由上海海圣生物实验设备有限公司定制,长×宽×高=45 cm×35 cm×30 cm)中驯养2周以上,光周期为13L∶11D,水体溶氧饱和,驯养期间使用通威鱼用膨化配合饲料于每天10:00饱足投喂1次,温度维持在25℃。
1.2 实验方案
在驯养结束后,选取体重相近、机体状况良好的3种幼鱼数尾(样本量及体重、体长见表 1和表 2)用于测定低氧耐受或热耐受。在正式实验前,所有实验鱼禁食36h,实验开始前8h将实验鱼置于相应的实验装置中适应,以尽量减少装置间转移而产生的胁迫,适应期间水温、溶氧等条件与养殖系统保持一致(25℃,溶氧饱和)。实验分为力竭组和对照组。力竭组在适应结束后,首先在环形水道(内半径16 cm、外半径32 cm,水深约为10 cm)中用小型渔网追赶[7],直至鱼体失去平衡或随波逐流即达到力竭状态(大约5min),随后转移至呼吸室或热耐受测定装置内(转移过程中空气暴露约15s),开始测定各项实验指标,并于实验结束后记录其对应的体重、体长等参数;对照组不经历力竭处理。
1.3 实验装置
低氧耐受测定低氧耐受使用实验室自制的间歇式呼吸代谢测定仪测定[8]。适应期间呼吸室维持换水,待力竭处理后,将已力竭或适应完毕的鱼放入呼吸室(除去实验鱼体积约520 mL)中测定,温度等其他条件与养殖系统保持一致。测定时关闭换水泵,呼吸室密闭,使用溶氧仪(哈希HQ30d,美国哈希公司)测定呼吸室内溶氧值,每2min记录1次[在首次记录时,同时记录下第一次读数稳定后的溶氧值(mg/L)及溶氧饱和率(百分数),之后记录百分数,根据溶氧值A∶百分数A=溶氧值B∶百分数B计算之后的溶氧值],持续测量至实验鱼失去平衡,记录完毕后立即开启换水泵。此外,中华倒刺鲃和鲤的力竭组在胁迫后代谢水平较高,呼吸室内溶氧水平下降快而无法有效统计临界氧压等数据。因此,其在低氧测试第25分钟(此时呼吸室溶氧大约5.0 mg/L)时更换呼吸室内水体至饱和。代谢率计算公式如下:
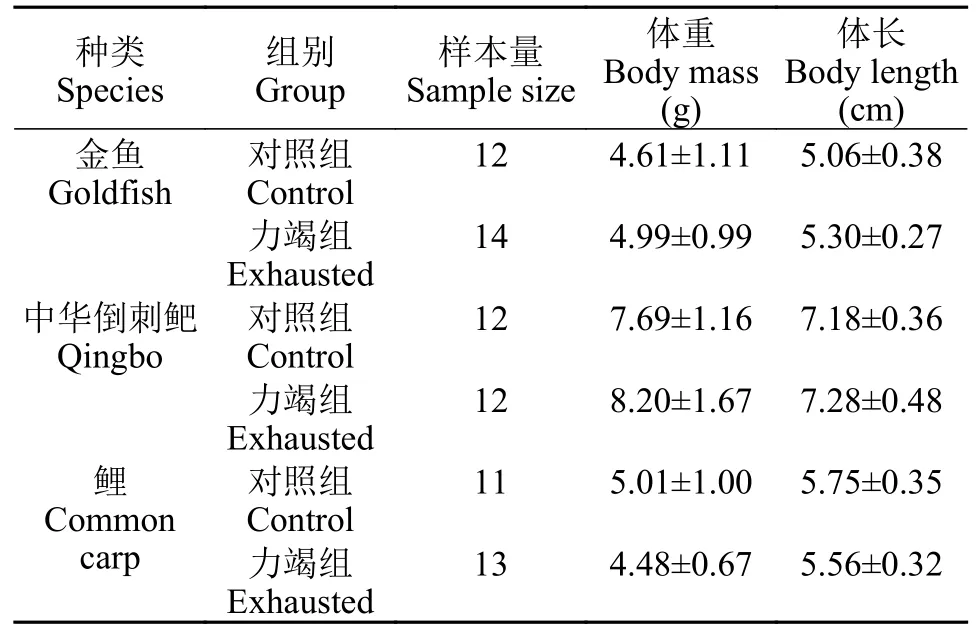
表1 低氧耐受实验各组别实验鱼样本量及体重和体长(平均值±标准差)Tab.1 The sample size,wet weight,and body length of experimental fish in each group of the hypoxia tolerance experiment (mean±SD)
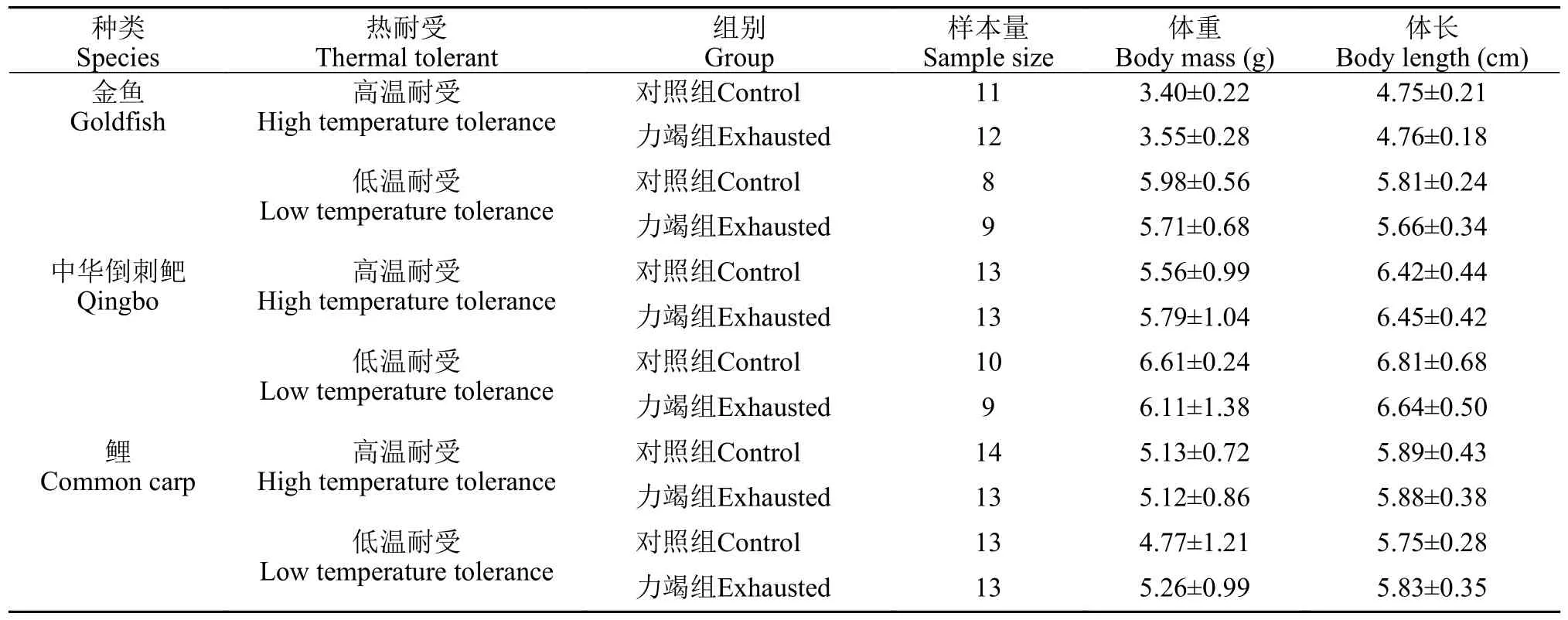
表2 热耐受实验各组别实验鱼样本量及体重和体长(平均值±标准差)Tab.2 The sample size,wet weight,and body length of experimental fish in each group of the thermal tolerance experiment (mean±SD)
式中,Ak和Ak+1是测定时间为k和k+1时的溶氧值(mg/L),V(L)是呼吸室总体积与实验鱼体积的差值,t为测定的间隔时间(1/30h),M为实验鱼体重(kg)。
静止代谢率开始急剧下降时所对应的环境氧压作为该实验鱼的临界氧压(Pcrit),通过“双线法(Two-segmented straight lines)”进行计算[8],其对应的代谢值作为临界代谢率(CMR);实验鱼首次在呼吸室内失去平衡时所对应的环境氧压为失衡点(LOE),其对应的值为边际代谢率(Marginal MR)。
热耐受测定热耐受参数测定采用临界温度法[9]。每次测定6尾鱼(3尾力竭),置于长×宽×高=11.5 cm×9.5 cm×15 cm的单元格中实验(铁丝网围制)。测定时,先将力竭组3尾鱼依次放入环形跑道驱赶至力竭,再开始热耐受实验。通过冷水机(1.5 P)或可调功率加热棒(3000 W)以0.3℃/min的速度进行匀速降温或升温,并持续充氧,保证实验水体内氧含量充足。在实验过程中,使用精密温度计监控水温变化,以实验鱼失去平衡10s时的温度作为临界温度(CTmax和CTmin);鳃盖停止呼吸10s或对尾部刺激无反应时的温度作为致死温度(LTmax和LTmin)。
1.4 数据统计与分析
实验数据使用EXCEL 2016进行常规统计,用SPSS 25以体重为协变量对力竭运动胁迫和鱼种造成的影响进行双因素方差分析(Two-way ANOVA),数据采用莱文方差等同性检验(Levene’s Test)和夏皮洛-威尔克(Shapiro-Wilk)法进行齐性分析和正态分布检验。如方差结果显著,则采用Tukey法进行组内事后比较。
2 结果
2.1 力竭运动胁迫对低氧耐受能力的影响
如图1所示,在测定过程中,达到Pcrit点之前,实验鱼的代谢率随着呼吸室内氧气含量的减少保持在相对稳定的水平;Pcrit点以后,实验鱼代谢率随着呼吸室内氧气含量的减少逐渐降低,直至LOE点。另外金鱼、中华倒刺鲃、鲤的力竭组代谢率均相对高于对照组。
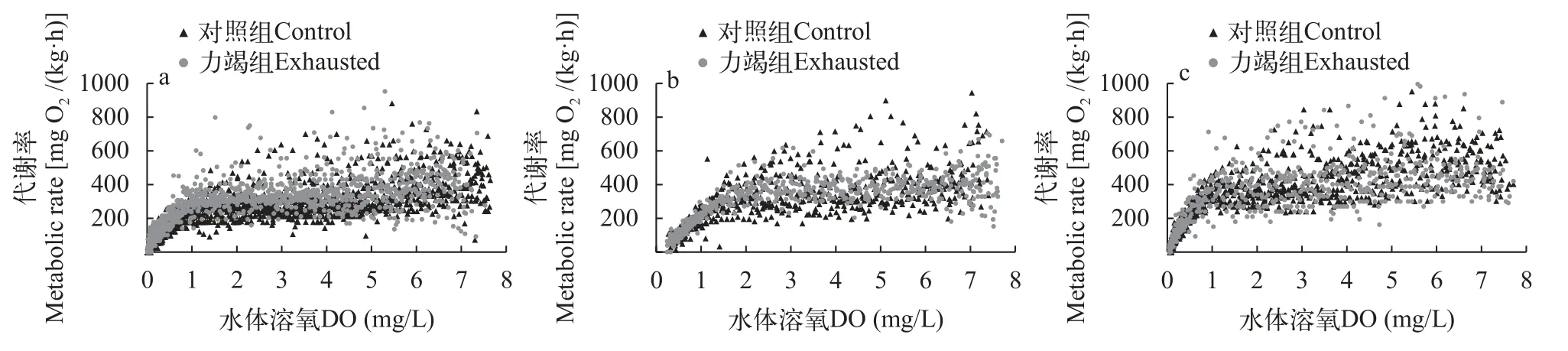
图1 溶氧水平对金鱼(a)、中华倒刺鲃(b)和鲤(c)代谢率的影响Fig.1 The effect of dissolved oxygen level on metabolic rate of goldfish (a), qingbo (b) and common carp (c)
方差分析显示体重对各代谢参数均无显著影响,不同种间各代谢参数均差异极显著(F值详见表 3,P<0.001)。力竭运动胁迫对实验鱼的Pcrit(F=7.122,P=0.009)和CMR(F=14.497,P<0.001)均有显著影响,对实验鱼的LOE(F=0.339,P=0.562)和Marginal MR(F=0.462,P=0.499)均无显著影响。在力竭运动胁迫后,鲤的Pcrit显著升高(P<0.05),中华倒刺鲃和金鱼无显著差异(图2a);3种鱼的CMR均显著提升(P<0.05;图 2c)。此外,在力竭运动胁迫后,除中华倒刺鲃的LOE显著降低以外(P<0.05),其余鱼的LOE和3种鱼的Marginal MR均无显著变化(图2b和图 2d)。
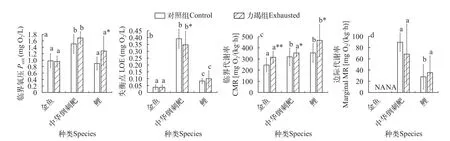
图2 力竭运动胁迫对各低氧耐受特征参数的影响(平均值±标准差)Fig.2 The influence of exhaustion exercise stress on the hypoxic tolerance indicators (mean±SD)
2.2 力竭运动胁迫对热耐受能力的影响
结果显示(图3),体重对除了CTmin(F=10.818,P=0.002)以外的热耐受参数指标均无显著影响;不同种间各代谢参数均差异显著(F值详见表 3,P<0.05)。力竭运动胁迫对实验鱼的CTmax(F=22.430,P<0.001)有显著影响,对实验鱼的CTmin(F=0.001,P=0.971)、LTmax(F=0.230,P=0.633)和LTmin(F=0.351,P=0.556)均无显著影响。在力竭运动胁迫后,金鱼和中华倒刺鲃的CTmax显著降低,金鱼的CTmin显著升高(P<0.05);但对中华倒刺鲃的CTmin和鲤的CTmax及CTmin无显著影响。此外,力竭运动胁迫也未对3种鱼的LTmax和LTmin产生显著影响。
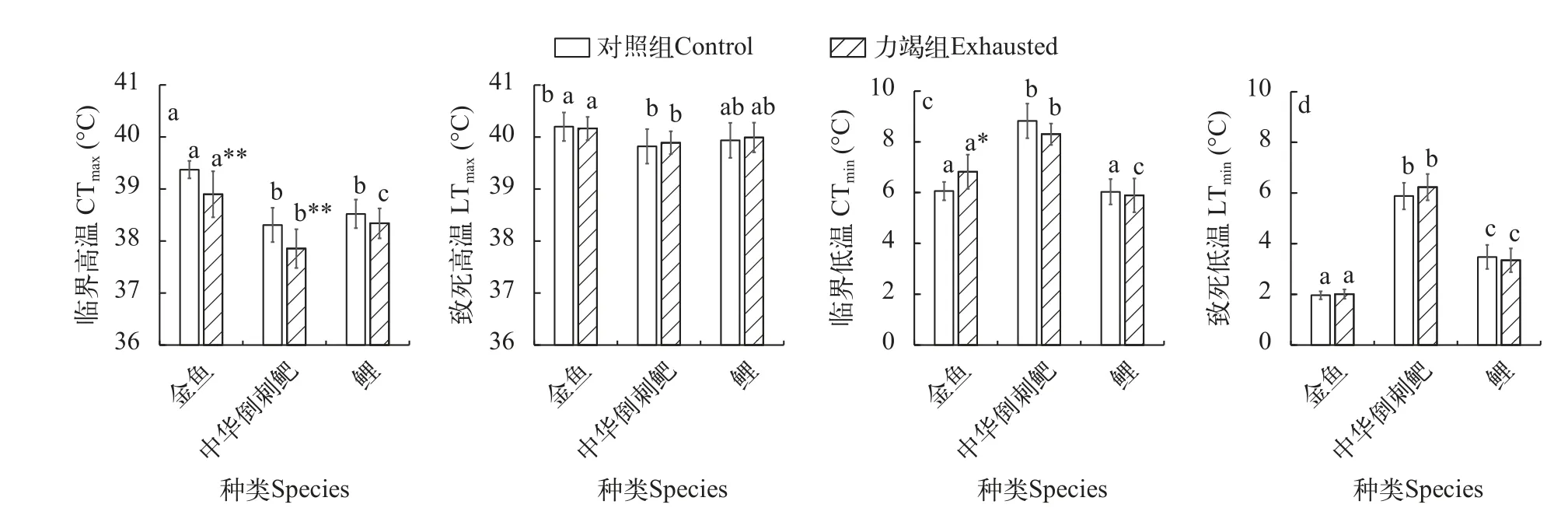
图3 力竭运动胁迫对各热耐受特征参数的影响(平均值±标准误)Fig.3 The influence of exhaustion exercise stress treatment on the thermal tolerance indicators (mean±SE)
3 讨论
3.1 低氧耐受种间比较及力竭运动胁迫的影响
Pcrit和LOE是鱼类低氧耐受能力的重要衡量指标。由图 2可知,3种实验鱼的低氧耐受能力关系如下: 金鱼>鲤>中华倒刺鲃,这与它们的生活习性和生境状态是密切相关的。中华倒刺鲃是偏好激流的淡水鱼类,常年生活于氧气充足的流水生境中;金鱼则偏好静水生境,由于水体水流速度缓慢及其他环境因子影响,易遭遇低氧胁迫;而鲤的生活环境是介于激流和静水生境的中间体。因此,为了适应各自特定生境的氧气环境、水流速度等环境条件,3种鱼类的耐低氧能力出现适应性分化,以应对不同生境条件带来的生理挑战。而在淡水贻贝等生物种类中也存在类似的情况,即生活在溪流等氧含量较丰富的水环境中的种类(Villosa irisandV.constricta),其在面临低氧时的调节能力会更差[10],表现出对特定生态环境的适应性。
力竭运动是典型的无氧运动之一,主要通过白肌纤维糖酵解提供能量[4]。在运动结束后,肌肉磷酸肌酸(Pcr)、ATP和糖原等含量迅速下降,并且会导致机体内尤其是肌乳酸含量急剧增高[11]。鱼类力竭运动后需要较长时间恢复,代谢率在该过程会显著提升,主要是用于ATP和Pcr更新、血红蛋白氧化、乳酸的代谢和糖原的重新合成及各类激素的释放、底物循环增加等生化过程[1]。已有研究发现,当鱼类代谢率提升时,其Pcrit也相应提升,如鲫(Carassius carassius)分别在10℃、15℃、20℃和25℃驯化1个月后,Pcrit随着驯化温度的升高而增加;反之亦然,如罗非鱼(Oreochromis niloticus)在一定温度条件下,饥饿状态测得的Pcrit显著低于饱食状态[12,13]。本研究发现,鲤的CMR提升了43%,Pcrit提升了32%;中华倒刺鲃和金鱼的CMR分别提升了11%和48%。因此,这是由于代谢率提升,有氧代谢空间受到压缩所致。鱼类面临低氧胁迫时可能采取不同的策略,一种为尽量减少行为活动降低耗氧;另外一种表现为回避行为或偏好行为,即加快运动,寻找新环境[3]。因此,中华倒刺鲃、金鱼和鲤属于后者。然而,饥饿后的鲤表现出有氧和无氧代谢能力先增加后降低的变化趋势,这说明鱼类面对环境因子胁迫时采取的应对措施会随胁迫时间的变化而有所差异[7]。此外,金鱼具有特殊的酒精代谢途径,所以能够耐受极端低氧。已有研究发现,温度对大西洋鲑(Salmo salar)和鲫的LOE没有影响[14,15],本研究发现力竭运动胁迫对金鱼和鲤的LOE也没有影响,而对中华倒刺鲃的LOE影响显著。这说明,相对于生活在氧气充足的流水生境中的鱼类(如中华倒刺鲃等),生活在中等流速或静水水体的鱼类(如鲫和鲤等)它们对于水体环境氧气要求更低,尤其是对于生活在静水中的鱼类而言,它们会经常遭遇环境低氧,因而能够保证极端低氧耐受能力的相对稳定。这提示我们在进行鱼类栖息地保护等工作时,要关注鱼类在同时或先后面临多种极端环境胁迫时的生存能力的变化。尤其是暴雨山洪时的水体缺氧和高水流速度对鱼类的生存存在着极大的挑战。另外,这也提示鱼类在运动或捕捞应激等逆境胁迫后对于水体缺氧会更为敏感,此时,在养殖和运输等过程中应当保证氧气等其他环境条件不对鱼类造成二次胁迫。
3.2 热耐受种间比较及力竭运动胁迫的影响
金鱼、中华倒刺鲃和鲤均属于广温性鱼类,因而其耐高温和耐低温能力均处在一定的范围内(图3)。但由于其各自生境的差异,所面临的水体环境温度挑战也有所不同,各自的耐受性也有所差异。其中,中华倒刺鲃的热耐受能力远低于金鱼和鲤,尤其是耐极端低温的能力,这可能与中华倒刺鲃在长江流域中的栖息地环境温度息息相关。
心鳃系统是氧气吸收和运输的重要功能系统,当温度超过心鳃系统的耐受极限时,心鳃系统临近衰竭,供氧不足,机体基础功能受到影响[3,16,17]。此外,力竭运动胁迫会导致有氧代谢空间(AS)受到压缩,这是由于运动胁迫后较高水平的CMR导致。同样,耐受性法则也指出,当环境温度超过生物血液氧化的最适温度时,有氧代谢活动范围开始发生变化[16]。而氧和温度限制的代谢生态位理论[3]中指出,机体关键生理功能是否直接受到组织氧气供应限制,会影响鱼类的热耐受能力。若不受组织氧气限制,失衡点(此时的温度即CTmax)则出现在有氧代谢和无氧代谢之和不能支持机体功能时;若受组织氧气限制则出现在之前。如图3a和图 3c所示,在力竭运动胁迫后,由于有氧代谢空间缩小,金鱼和中华倒刺鲃的CTmax均降低了0.5℃左右,这说明金鱼和中华倒刺鲃的关键生理功能不直接受到组织氧气供应限制;反之,在胭脂鱼(Myxocyprinus asiaticus)和岩原鲤(Procypris rabaudi)的温度驯化实验[18]也出现了: 随驯化温度升高,其MMR、SMR和AS升高,同时CTmax也升高,这与上述实验结果一致。而鲤则属于受组织氧气供应限制的鱼类,且其代谢竞争模式为“添加模式”,心鳃功能强大[19,20],因而其热耐受能力不被改变(图3)。而金鱼的CTmin升高,中华倒刺鲃和鲤不变,这可能与金鱼长期经过人工驯化和选择后抗逆能力较弱有关,也可能是由于体重效应造成的(表3)。因而,在核电站废水排放、水坝排水时应当充分考虑排水所引起的水体温度变化,尽量做到合理排水以降低水体温度变化对鱼类造成的胁迫作用。
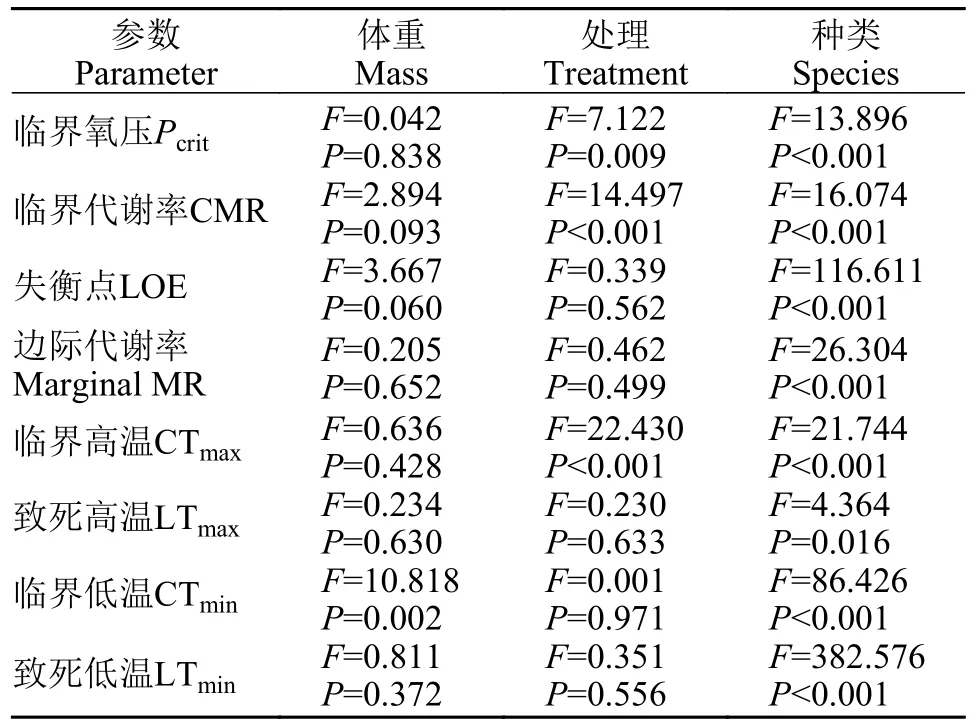
表3 种类和力竭运动胁迫对实验参数的无交互双因素协方差分析表Tab.3 The Table of non-interactive two-way ANOVA of experimental parameters for species and exhaustion exercise stress treatment
当环境温度临近致死温度时,温度对机体心鰓系统造成损害,生物体对组织的供氧能力已经无法满足组织需求,生物体的热耐受能力将会受到限制[3,21]。金鱼、中华倒刺鲃和鲤的致死温度(LTmin和LTmax)在力竭运动胁迫后均不被影响(图3b和图 3d),这是热休克蛋白的高度保守性造成的。热休克蛋白(HSP) 可以保护细胞免受极端生理、病理和环境条件的影响,对蛋白质错误折叠校正和保护未成熟多肽在逆境下不聚集等方面发挥作用[22]。鱼类在面临低温或高温时体内的热休克蛋白开始大量表达,包括HSP70和HSP90等多类与热应激相关的蛋白质[23—25]。但当温度超过热休克蛋白的耐受极限时,热休克蛋白受损,进而导致机体内的酶活性无法正常维持,最终导致鱼类死亡。但斑马鱼(Danio rerio)和齐口裂腹鱼(Schizothorax prenanti)等的温度驯化实验表明,较长期的温度驯化依旧可以对该鱼的致死温度造成影响[9,26],这可能是由于长期温度驯化导致鱼体的适应所致。
