改良增菌条件应用于Soleris系统对食品中沙门氏菌的检验
2023-11-22姚卢悦陈丽花
姚卢悦,陈丽花
(1.上海应用技术大学 香料香精技术与工程学院,上海 201418;2.普研(上海)标准技术服务有限公司,上海 201318)
沙门氏菌(Salmonella)是一种常见的食源性致病微生物,由其引发的病例报道较多见[1-3]。因此,沙门氏菌的检验是食品生产、流通和销售等消费环节中十分重要的微生物监测项目。
食品中沙门氏菌检验的现行国家标准方法是GB 4789.4-2016[4],检验周期为5~7 d。为满足对快检法准确兼具高效的应用需求,近年来酶联免疫法[5-6]、PCR法[7-10]、ATP荧光法[11]、流式细胞仪法[12]和质谱法[13-14]等检测技术快速发展,还出现了多技术平台联用的快检方法[15-17],但是受限于场地、设备操作和人员技术能力等问题较难大规模推广。而Soleris系统则复合了光学检测和培养模块,其应用研究多见于乳制品、保健品等中的菌落总数、大肠菌群等的快检[18-19]。该系统通过光学检测器对获得实时系统特征值检出时间(DT值),达到快速预警的检测目的,通过多个培养模块叠加可实现批量化、多样化检验的优势。
按照Soleris系统对食品中沙门氏菌进行检验的操作程序,其增菌步骤采用胰蛋白胨大豆肉汤(trypticase soy broth,TSB)于36 ℃培养24 h。随后将增菌培养物以1.0 mL体积转移到氯化镁孔雀绿肉汤(Rappaport-Vassiliadis broth,RV)中42 ℃选择性增菌 8 h。相较于使用TSB的增菌方法,我国国家标准方法中缓冲蛋白胨水(buffered peptone water,BPW)的使用更广泛,配制成本也更低廉。本试验以保证Soleris系统沙门氏菌检验检出率为前提,着力于Soleris法增菌条件的优化和改良,通过与国家标准检测法等效性研究为采用此法进行食品中沙门氏菌检验提供了参考。
1 试验材料与方法
1.1 培养基及试剂
S2-SAL沙门氏菌检测试剂瓶、S2-SALI沙门氏菌检测添加剂:纽勤生物科技(上海)有限公司;缓冲蛋白胨水(buffered peptone water,BPW)、胰蛋白胨大豆肉汤(trypticase soy broth,TSB)、胰蛋白胨大豆琼脂培养基(trypticase soy agar,TSA)、脑心浸液肉汤(brain heart infusion broth,BHI)、氯化镁孔雀绿肉汤(Rappaport-Vassiliadis broth,RV)、平板计数琼脂(plate count agar,PCA):北京陆桥技术股份有限公司;氯化钠:国药集团化学试剂有限公司;API 20E生化鉴定条:梅里埃诊断产品(上海)有限公司。
1.2 试验用菌株
本研究所使用的菌株见表1。

表1 测试菌种Table 1 Tested strains
1.3 待检样品准备
将从市场上获得的已经完成国标法沙门氏菌检测并生化鉴定为沙门氏菌阳性的猪肉和牛肉样品以25 g/份的量各分装成10份,共计20份样品。
1.4 试验仪器与设备
Soleris微生物快速检测仪 纽勤生物科技(上海)有限公司;移液器 Eppendorf中国有限公司;BWS-12恒温水浴锅、DHP-9272生化培养箱 上海一恒科学仪器有限公司;DC-05低温循环水槽 江苏天翎仪器有限公司;MQD-S2NR振荡培养箱 上海旻泉仪器有限公司。
1.5 试验方法与过程
1.5.1 热损伤菌悬液的制备
参考谢雨龙等[20]、张佩佩等[21]对沙门氏菌热失活的研究,将试验菌接种到BHI中37 ℃振荡4 h;吸取1 mL培养物到60 ℃的9 mL生理盐水管中,立即水浴3 min;转移1 mL热处理菌液到4 ℃的9 mL生理盐水管中获得热损伤菌悬液。
1.5.2 前增菌生长比较试验
按照增菌液种类将试验组分为BPW组和TSB组。将热受损沙门氏菌逐级10倍稀释,制成浓度约为102~103CFU/mL的菌液,取1 mL接种到BPW和TSB中,使增菌液中的沙门氏菌起始浓度约为1~10 CFU/mL。以增菌液添加菌液的时间为起点,做0 h菌落计数,每2 h取培养物进行菌落计数,以生长对数值绘制生长曲线,评价沙门氏菌在不同培养液和不同增菌时间下的修复生长情况。
1.5.3 选择性增菌优化试验
前增菌培养物分别按照1.0 mL和0.1 mL的接种体积接种到RV中,42 ℃培养8 h后按照GB 4789.28-2013[22]对微生物的生长情况进行定性和半定量分析。
1.5.4 Soleris系统试验
取0.1 mL RV培养物接种到S2-SAL试剂瓶中,按照沙门氏菌检验程序(见表2)上机检验。

表2 沙门氏菌仪器检测参数设置Table 2 Parameter setting of Salmonella instrument detection
1.5.5 样品沙门氏菌检验
从20份已检出沙门氏菌的肉类样品中随机抽取牛肉和猪肉各5份进行热处理作为热损伤测试组,剩余样品作为自然样品组,备用。在25 g样品中加入225 mL BPW预增菌18 h,随后各自按照国标法和Soleris法进行后续检测,比较国标法与Soleris法的试验结果,验证方法的可行性。
1.6 试验数据处理
采用Excel 2019、Origin 2019b进行数据和图表的基本处理,采用 IBM SPSS Statistics 23进行t检验分析。
2 结果与分析
2.1 BPW组与TSB组生长试验结果比较
对不同培养时间的TSB和BPW培养物进行菌落计数,计算各自的生长对数值,绘制生长曲线,见图1和图2。
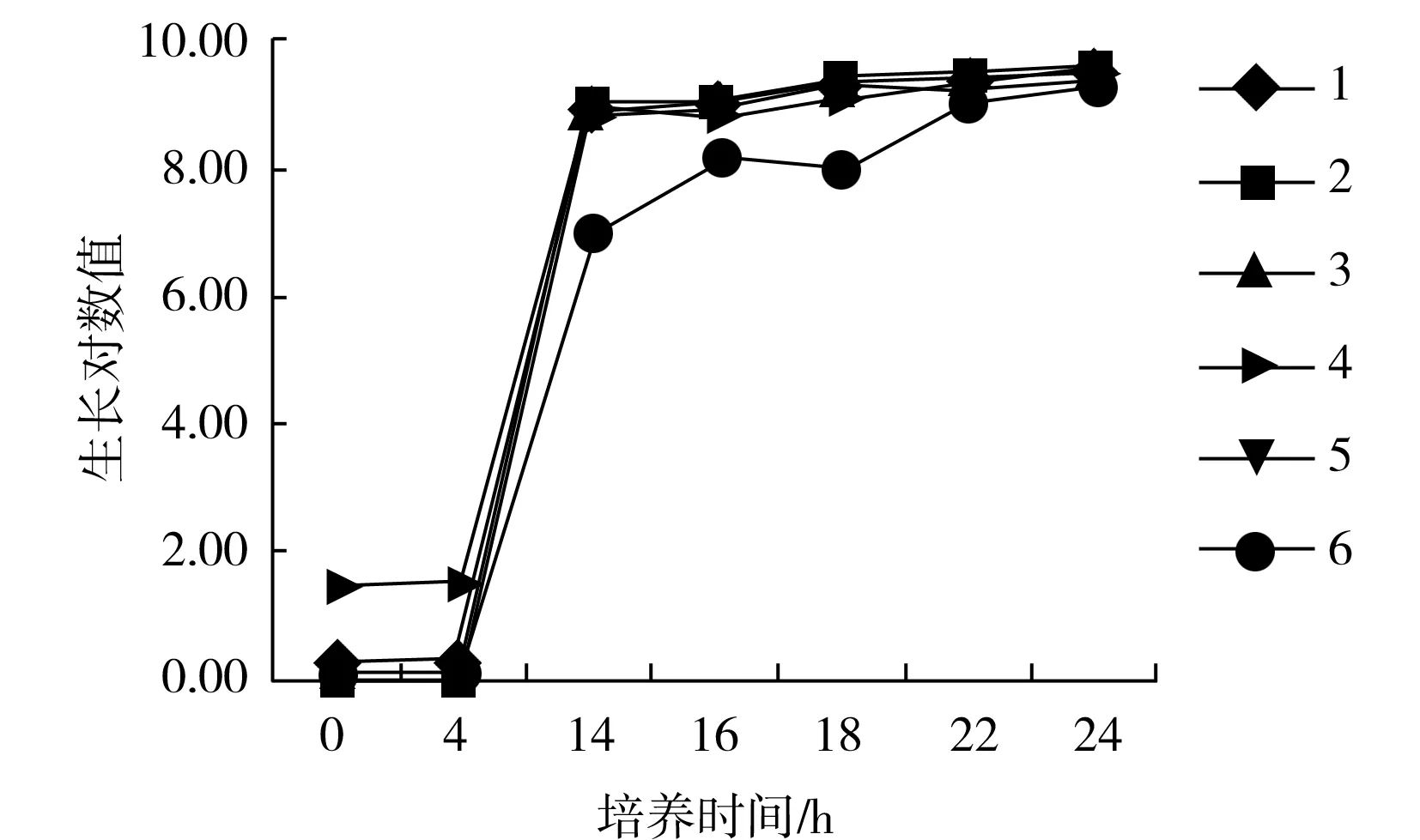
图1 TSB组沙门氏菌生长曲线Fig.1 Salmonella growth curve of TSB group
运用SPSS中的独立样本t检验分析两个试验组中热受损沙门氏菌在不同培养时间下沙门氏菌的生长对数值,获得两个试验组中热受损沙门氏菌的生长是否存在显著性差异的结果,见表3。
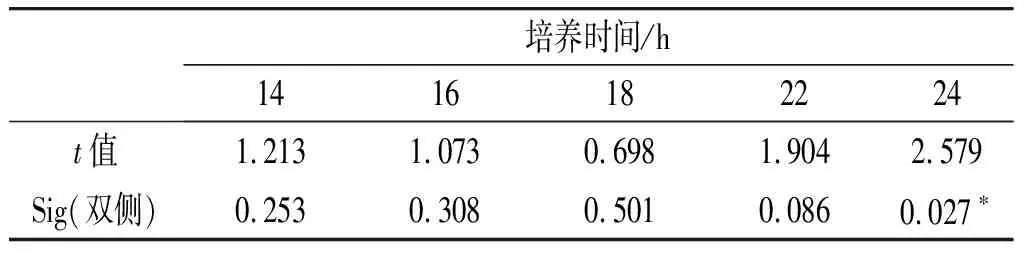
表3 TSB组和BPW组生长对数值显著性分析
由表3可知,BPW 和TSB两种培养基的增菌效果在14,16,18,22 h时无显著差异(P>0.05),仅在24 h时增菌效果产生了差异(P<0.05)。
绘制肺炎克雷伯氏菌和奇异变形杆菌的热受损菌的生长曲线后发现:奇异变形杆菌在BPW中的生长效率远远低于TSB(见图3和表4);肺炎克雷伯氏菌在不同增菌时间下的平均生长对数值比TSB组的平均生长对数值低0.83。因此采用BPW进行前增菌对控制干扰菌、增强试验选择性有重要的意义,但是随着增菌时间的增加,生长对数值差值逐渐缩小。
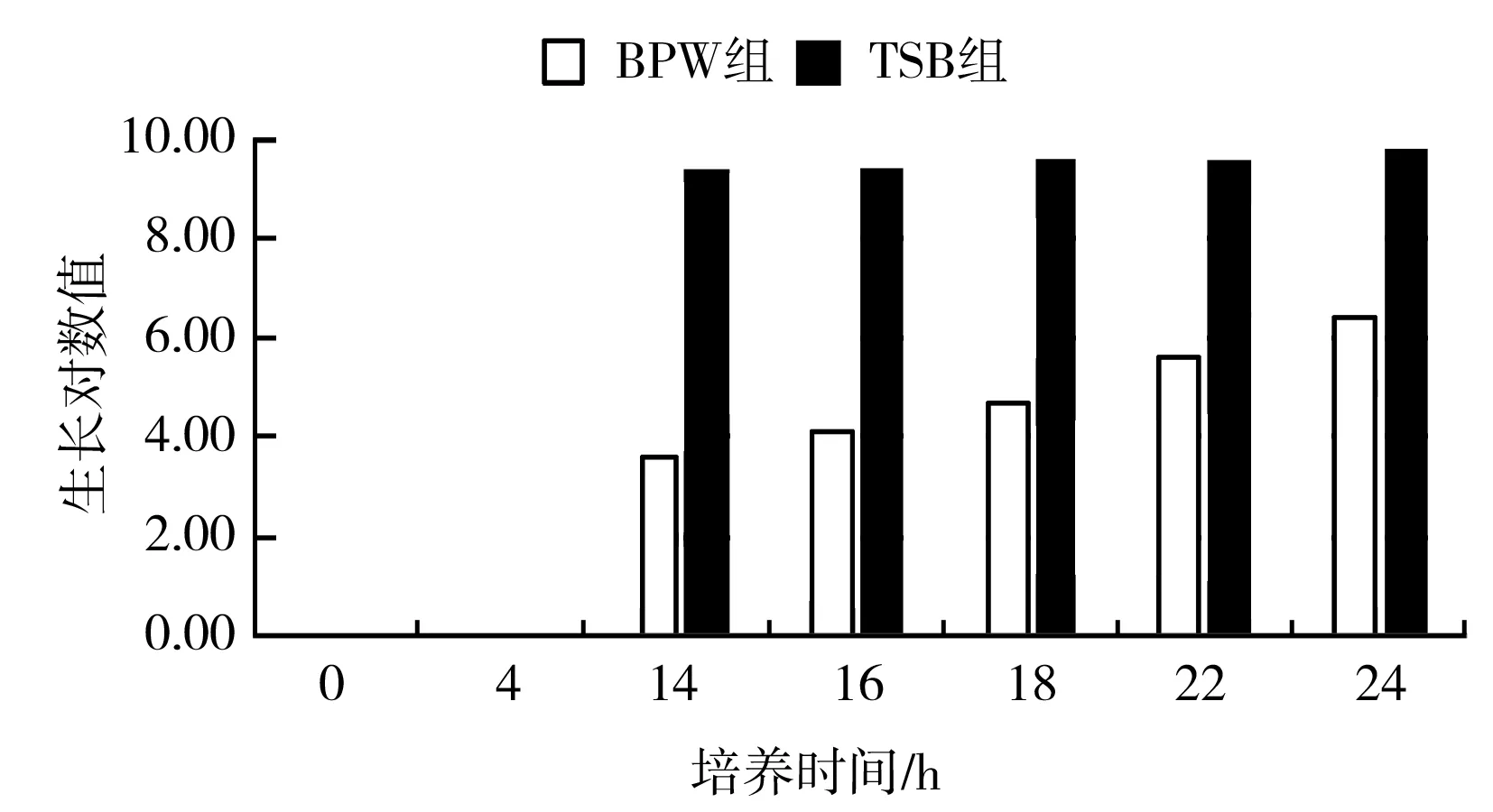
图3 奇异变形杆菌增菌效果比较Fig.3 Comparison of Proteus mirabilis's enrichment effect

表4 不同培养时间奇异变形杆菌生长对数值比较Table 4 Comparison of Proteus mirabilis's growth logarithms at different cultivation time
2.2 选择性增菌试验结果分析
参考GB 4789.28-2013[22]中的方法对接种后的RV肉汤进行浊度观察:采用1.0 mL接种体积增菌8 h后沙门氏菌阳性对照管与阴性对照管相比浊度有明显变化,肺炎克雷伯氏菌和奇异变形杆菌的接种管浊度与沙门氏菌管相近;采用0.1 mL接种体积增菌8 h后各管浊度变化无法用肉眼判断是否与阴性对照管存在差异,因此采用半定量划线法对RV培养物生长情况进行确认,结果见表5。
由表5可知,对半定量划线结果进行计算,沙门氏菌平均G值为8.75,证明采用0.1 mL接种体积仍可使沙门氏菌获得良好的生效效果,且对常见的试验干扰菌肺炎克雷伯氏菌和奇异变形杆菌起到抑制其生长的作用。所以,控制和改良RV接种体积能够进一步保持沙门氏菌的生长优势,增强Soleris方法的选择性。
2.3 Soleris系统检验结果
18 h培养物前增菌后分别按照Soleris法和国标法进行后续测试,BPW组和TSB组24 h培养物增菌后按照Soleris法测试,记录各试验组DT值(见图4和图5)。
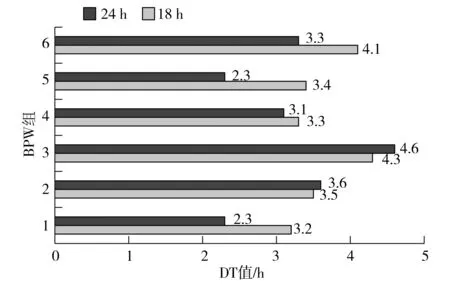
图4 BPW组DT值Fig.4 DT value of BPW group
对各组DT值(系统检出时间)进行分析,BPW组前增菌培养18 h和24 h后 Soleris DT值平均为3.63 h和3.20 h;TSB组前增菌培养18 h和24 h后 Soleris DT值平均为3.72 h和3.10 h。由显著性分析可知,BPW组前增菌18 h和24 h后t值为1.084,Sig(双侧)P=0.304>0.05;TSB组前增菌18 h和24 h后t值为1.291,Sig(双侧)P=0.226>0.05。将BPW组和TSB组前增菌18 h后的DT值进行计算,t值为0.274,Sig(双侧)P=0.790>0.05,将BPW组和TSB组前增菌24 h后的DT值进行计算,t值为0.585,Sig(双侧)P=0.858>0.05。由t检验可知,经过18 h前增菌与RV增菌,TSB组与BPW组DT值间无显著差异,24 h TSB组与BPW组DT值间也无显著差异,且两组组内18 h前增菌和24 h前增菌的DT值也无显著差异。
2.4 样品测试结果
样品分为热损伤组和对照组,经过Soleris法和国标法的比对测试,测试结果见表6。
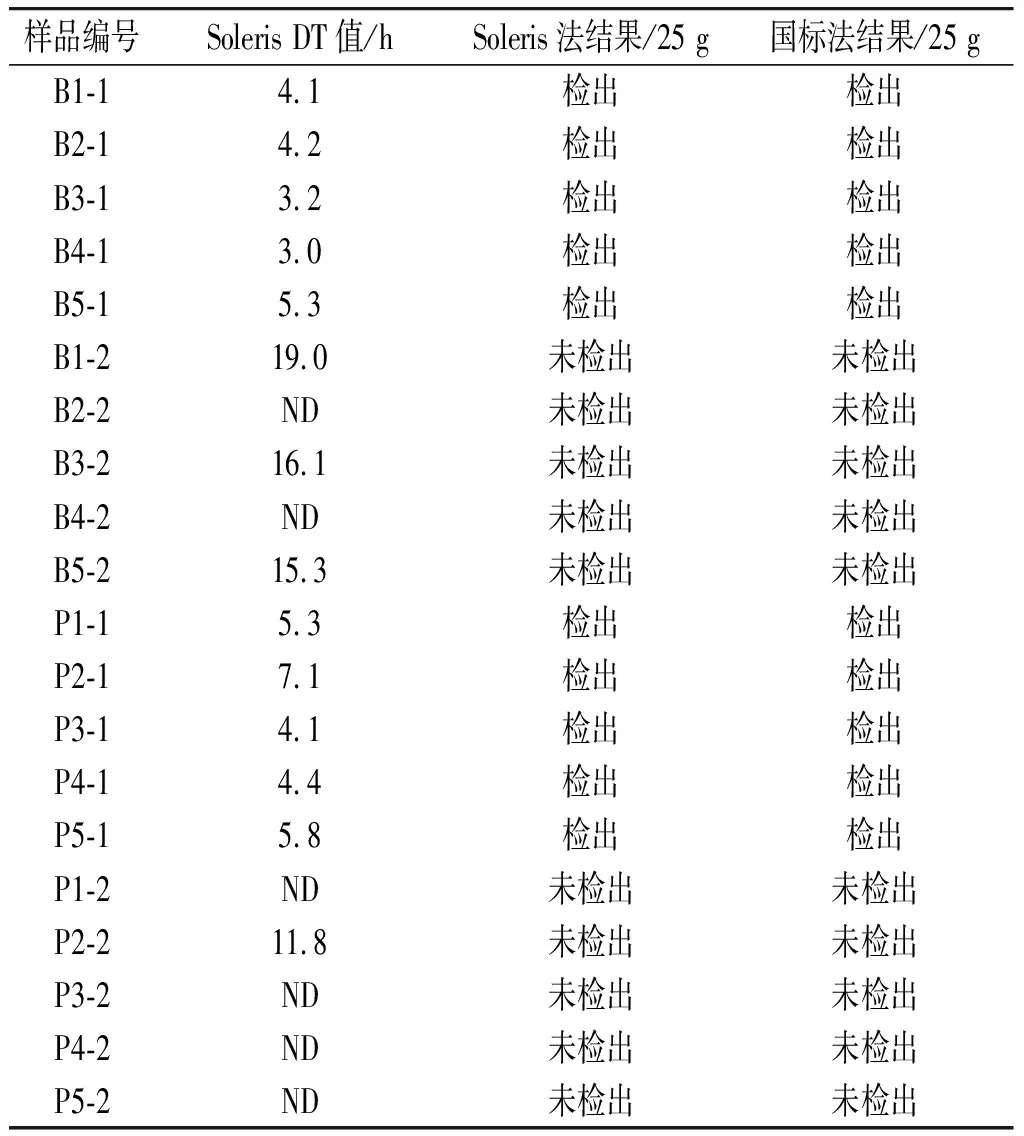
表6 样品检验结果(沙门氏菌检验)Table 6 Detection results of samples (Salmonella detection)
表6中B1-1~B5-1为牛肉样品的自然样品组,B1-2~B5-2为热处理牛肉组;P1-1~P5-1为猪肉自然样品组,P1-2~P5-2为热处理猪肉组。通对对20份样品的检测结果进行汇总和分析:10份自然阳性样品均有沙门氏菌检出。阳性牛肉样品的Soleris系统DT值平均为4.0 h,阳性猪肉样品的DT值平均为4.3 h。经过热处理的生肉样品中虽然B1-2、B3-2、B5-2、P2-2 4个样品有DT值检出,经选择性分离和API生化鉴定确认为非沙门氏菌。对Soleris系统判定为“ND”的S2-SAL阴性试剂瓶进行表观观察,未观察到明显变化,因此将瓶中培养液进行划线培养,分离平板上无菌生长。阴性结果试剂瓶继续培养24 h,表观无变化,划线培养后也无菌生长,因此排除假阴性的可能。20份肉类样品的Soleris法检测结果与国标法检测结果一致,对于低风险样品的沙门氏菌从预增菌至Soleris检验完成仅需46 h,比国标法检验速度更快。
3 讨论与小结
经过对BPW生长率的研究表明增菌14,16,18,22 h其增菌效果与采用TSB增菌无显著性差异,仅采用24 h两种增菌液的增菌效率才出现显著差异。通过RV接种量比较培养试验,以0.1 mL前增菌培养物进行Soleris法的选择性增菌,沙门氏菌的平均生长G值为8.75,在保持目标菌良好的增菌效率前提下能够有效抑制肺炎克雷伯氏菌和奇异变形杆菌这两种食品沙门氏菌检验中常见的干扰菌的增殖,提高了方法的选择性。以18 h和24 h两个重点前增菌考察时间完成整个Soleris沙门氏菌试验后发现:样品中沙门氏菌含量越高,Soleris检出DT值越小;BPW组18 h和24 h平均DT值为3.63 h和3.72 h,TSB组18 h和24 h平均DT值为3.20 h和3.10 h,进行DT值显著性分析,BPW组和TSB组组内、BPW组和TSB组组间18 h和24 h DT值均无显著差异。经过改良前增菌液种类和增菌时间、改进RV接种量对Soleris系统上机检验无显著影响。因此,以BPW作为Soleris法检测沙门氏菌的前增菌液增菌18 h,以0.1 mL体积转接RV进行后续试验的增菌条件不仅能提高Soleris检测过程中对干扰菌的抑制,而且保持了Soleris系统的高度响应。
将由市场上获得的沙门氏菌阳性肉类食品样品分成自然样品组和热处理样品组,采用Soleris法以改良后的条件进行沙门氏菌检验,Soleris系统对有DT值检出的样品进行实时检测的同时保持了快速预警的优势;对于Soleris系统报告为阴性的样品,全部检测时间仅需要46 h,且无假阴性发生,从而节省了鉴定试验和人员投入等测试成本。综合样品检测结果,Soleris法检验结果与国标法检测结果完全一致,从而证明了采用Soleris法进行食品中沙门氏菌检验具有一定的应用推广意义。本试验主要集中于阳性菌验证、肉类阳性样本和热处理样本的试验,对其他食品类型样品的实际检验应用还需要进一步进行适用性研究。
