锂离子电池正极材料过渡金属离子溶出的危害及抑制研究
2023-11-21占佳琦邢丽丹
占佳琦,邢丽丹
(华南师范大学化学学院,广东 广州 510006)
0 引言
随着笔记本电脑、手机、摄像机等信息家电的大规模应用和高智能化发展,人们对二次电池性能的需求也不断增加。电池使用环境的复杂化,促使电池向着高容量、小体积、轻量化发展[1]。凭借能量密度高、循环寿命长和环境友好等优势,锂离子电池迅速在电池市场中占主导地位,并已逐渐应用于电动汽车、电动自行车等领域中[2-4]。
商用锂离子电池主要由含锂过渡金属氧化物正极、石墨负极、隔膜和碳酸酯基电解液组成[5-8],这些关键材料及材料之间的界面性质均对电池性能有显著的影响。含锂过渡金属氧化物正极材料在循环过程中,尤其是高温或者高电压条件下,由于本体材料的不可逆相变、离子混排、或电解液中HF 侵蚀等原因,导致过渡金属离子溶出,破坏了正极材料的结构与界面稳定性[9-16]。例如:钴酸锂(LiCoO2)正极材料在循环过程中,由于界面发生的副反应,导致部分Co3+发生歧化反应生成+2 价和+4 价的钴离子,其中Co4+以CoO2化合物的形式存在,Co2+则进入电解液中,其反应式为4xH++2LixCoO2→ (2-x)CoO2+xCo2++2xLi++2xH2O[17];锰酸锂(LiMn2O4)材料,在循环过程中部分Mn3+发生姜泰勒效应,产生Mn4+和Mn2+化合物,前者由于不溶于电解液而继续保留在正极材料中,后者则溶解到电解液中[10,18]。Huang 等[19]的研究发现,过渡金属离子的溶出也受到电解液组分的影响,锰酸锂材料在含LiPF6/LiClO4的电解液中溶出的Mn 比在含LiTFSI的电解液中多,通过电子顺磁共振波谱在LiPF6/LiClO4电解液中观察到Mn2+存在,而在含LiTFSI的电解液中只观察到Mn3+,这可能是由于LiPF6/LiClO4均会发生副反应产生HF 或HCl,促进正极材料中的Mn3+发生歧化反应。
值得关注的是,这些溶出的过渡金属离子对负极界面稳定性及本体电解液的影响也不容忽视。溶解至电解液中的过渡金属离子在浓度差和电场力的驱动下,逐渐迁移并沉积到负极界面。研究表明[20-21],过渡金属离子具有较强的催化活性,会催化负极界面电解液分解,导致负极界面电解液分解产物增多、界面阻抗增大。高阻抗的负极界面容易诱导形成锂枝晶,不仅消耗了活性锂离子,还有可能导致电池内短路(见图1)[22-27]。
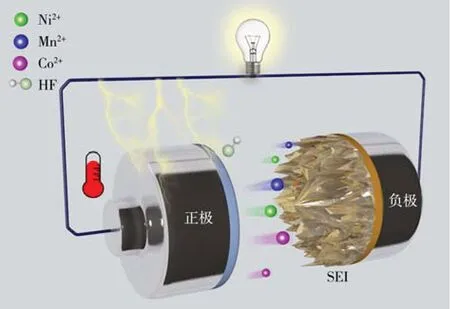
图1 过渡金属离子从正极溶出、迁移、沉积及危害模型Figure 1 Schematic illustration for dissolution,migration,deposition and detriment of transition metal ions from the cathode
如何有效地抑制过渡金属离子溶出是正极材料及电解液研究方向的重点之一。目前,已经报道的方法主要从两方面入手:第一个方面,通过对正极材料进行改性,抑制正极材料中过渡金属离子的溶出,如采用SiO2、Al2O3、ZrO2、B2O3等无机化合物对正极材料表面进行包覆,或采用微量Ce、Ti、Sb 等阳离子对材料进行掺杂[28-33],这些材料改性策略可以在一定程度上减缓正极材料中阳离子混排,抑制过渡金属离子溶出,提高结构稳定性;第二个方面,通过调控电解液组分,使电解液在正极表面发生氧化分解形成稳定的固体电解质界面(SEI)膜,进而提高电极/电解液界面稳定性,抑制过渡金属离子溶出[34-37]。这些措施均只能在一定程度上减缓过渡金属离子溶出,目前尚未见到能完全抑制过渡金属离子溶出的途径。因此,除了继续探究如何更加有效地抑制过渡金属离子溶出以外,明确并减缓溶出的过渡金属离子对电池性能的危害也迫在眉梢。
目前,关于溶出的过渡金属离子对电池性能影响的综述较少。针对这一现状,本文主要讨论过渡金属离子对负极界面和本体电解液稳定性的影响机制,以及如何通过电解液组分设计和优化进而抑制溶出的过渡金属离子对电池性能的危害。
1 过渡金属离子在负极界面的沉积及影响
由于具有高比容量、低成本的优点,石墨是目前应用最为广泛的锂离子电池负极材料,因此已报道的文献也主要关注过渡金属离子在石墨负极界面的沉积和影响。Wandt 等[38]通过原位X-射线吸收光谱(XAS)测试了石墨/LiNi0.33Mn0.33Co0.33O2电池在循环过程中过渡金属离子的溶出和沉积行为,实验结果发现:当电池工作电压超过4.6 V 时,过渡金属离子的溶出显著加剧;另外,该研究还发现溶出后的Ni、Co、Mn 均 以+2 价 化 合 物 沉 积 在 石 墨 负 极 表面。Kumagai 等[39]直接向电解液中加入不同量的Co(ClO4)2·6H2O 以模拟正极溶出的Co2+,同时研究其对石墨/Li 半电池性能的影响并发现:当电解液中添加40 ppm 的Co2+后,石墨负极表现出较低的放电容量与库仑效率;当电解液中的Co2+含量增加到150 ppm 时,石墨/Li 半电池在1.5—0.5 V 的电位区间出现一个电压平台,放电比容量高达1770 mAh·g-1,导致电池性能衰退加剧。为了进一步明确Co2+对石墨负极的破坏机制,文献[40]通过在电解液中添加Co(TFSI)2,研究了Co2+在石墨负极上的沉积行为和影响,X-射线光电子能谱(XPS)结果显示:电解液中的Co2+以Co0和Co2+的化合物形式同时存在于石墨负极表面(见图2(a)),其中Co2+主要为CoO 和CoF2化合物;Co0主要是在低电压下嵌锂的过程中形成,其会在脱锂过程中再次被氧化为Co2+,导致初期循环过程中石墨表面沉积的Co 含量随电极电位的变化而改变(见图2(b));此外,计时电流实验结果表明,与Co2+化合物相比,在Co0电极上观察到的残余电流更高,说明Co0催化电解液分解的活性比Co2+更强、危害更大;随后,作者通过在含Co2+的电解液中同时引入具有高还原活性的成膜添加剂,有效地抑制了Co0的沉积,降低Co 化合物的沉积量,进而提高石墨负极在含Co2+电解液中的循环稳定性。

图2 石墨电极的XPS 光谱和ICP-OES 结果[40]Figure 2 XPS spectra and ICP-OES results of graphite
Joshi 等[22]向电解液中同时加入了Ni(TFSI)2、Co(TFSI)2和Mn(TFSI)2,研究了3 种过渡金属离子对石墨/Li1.05Ni1/3Co1/3Mn1/3O2全电池性能的影响,并发现:电池的首次充放电曲线及倍率性能测试结果表明,电池在含过渡金属离子电解液中经循环后,电极极化显著增大、电池容量下降、倍率性能衰退;通过聚焦离子束-扫描电子显微镜对循环后的石墨极片表面与截面进行表征后可以清楚地看到,石墨负极在含过渡金属离子的电解液中循环后,其表面存在不均匀的电解液分解产物,并且分解产物粗糙度和厚度增大。Jung 等[41]通过原位XAS 和非原位电感耦合等离子体发射光谱(ICP-OES)检测了从LiNi0.6Mn0.2Co0.2O2正极中溶出并沉积在石墨负极上的3 种过渡金属离子含量,发现过渡金属离子的溶出几乎与正极材料中物质的化学计量比相等,Ni 的溶出沉积量最大。与此同时,作者在电解液中分别添加了Ni(TFSI)2、Co(TFSI)2和Mn(TFSI)2,研究3种过渡金属离子对石墨/LiNi0.6Mn0.2-Co0.2O2全电池性能的影响并发现:3 种过渡金属离子均会破坏石墨负极界面膜稳定性,导致电池性能衰退;而且相比较Ni2+和Co2+,Mn2+沉积在负极表面对电解液的催化活性更强,导致电池性能衰退明显比另外两个电解液体系快。Wachs 等[42]采用电分析流式电池(EFC)与电感耦合等离子体质谱(ICP-MS)相结合,原位检测了高镍正极材料中过渡金属离子的溶出 情况,实 验 结果 表 明:Ni、Co 和Mn 元 素分 别 在4.7、4.8 和5 V 的电位下开始溶出,并且过渡金属离子的溶出量与电极的极化密切相关;在高电位条件下,极化时间越长离子的溶出量就越多,其中Mn 的沉积对电池性能影响最大。Solchenbach 等[43]的研究也表明,与Ni 相比,Mn 溶出后对电池性能的危害更大。然而,过渡金属离子在负极沉积影响差异的机制仍不清楚。值得一提的是,在大多数报道的文献中,研究人员通过在未循环的电池中加入含有过渡金属离子的电解液,研究溶出过渡金属离子对电极性能的影响,然而实验设计方案与实际的电池体系存在差异,在电池首次充电过程中正负极表面会形成固体电解质界面膜(负极为SEI 膜、正极为CEI膜),在随后的循环过程中正极材料中的过渡金属离子逐渐溶解到电解液中并扩散沉积到负极。因此,在实际电池体系中,溶出的过渡金属离子沉积到已有SEI 膜覆盖的负极表面。如果直接把含过渡金属离子的电解液加入到未循环的电池中(负极界面是无SEI 膜的),SEI 膜的存在是否会影响过渡金属离子的沉积行为及危害并不清楚。因此,这类实验方案得到的结论均会高估或者低估了过渡金属离子在负极沉积带来的危害。
Zhan 等[44]考虑了石墨负极SEI 膜的存在,研究了含过渡金属离子电解液对循环后石墨负极性能的影响,发现循环过的石墨极片在含Mn2+电解液中浸泡后界面阻抗显著增加,Mn2+与石墨负极SEI 膜中的Li+发生离子交换,导致界面阻抗增加(见图3)。随后,Vissers 等[45]通过密度泛函理论(DFT)计算证明,电解液中的[Mn(EC)6]2+与SEI 膜中的主要无机组分Li2CO3、Li2O 和LiF 之间发生离子交换的反应是热力学可行的,向含有Mn2+的电解液中加入Li2CO3、Li2O 和LiF 化 合 物,储 存 后 电 解 液 中 的Mn2+浓度均大幅下降,说明溶解在电解液中的Mn2+会与石墨SEI 膜的主要成分发生离子交换,表明过渡金属离子沉积在SEI 膜内层无机层的表面。
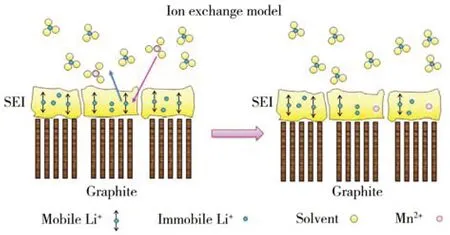
图3 Mn2+与SEI 膜组分发生离子交换的模型[44]Figure 3 Proposed ion-exchange model between Mn2+and SEI components[44]
为了进一步明确石墨负极表面SEI 膜对过渡金属离子沉积和危害行为的影响,研究了新鲜石墨(表面无SEI 膜)和循环过石墨(表面有SEI 膜)负极在含Co(TFSI)2电解液中的电化学行为发现[46]:循环过的石墨电池性能衰退更为严重,100 圈循环后容量保持率便下降至38%,而新鲜的石墨负极在200圈循环后容量保持率仍高达97%,说明石墨负极表面有SEI 膜会加剧过渡金属离子沉积带来的危害;由于Co2+更高的价态和更高的键合能,使得SEI 膜中的Li+与电解液中的Co2+发生交换反应,即便经过短时间的浸泡,SEI 膜中的锂化合物几乎全部转变为钴化合物(见图4),这种离子交换反应使得过渡金属离子在有SEI 膜的石墨负极表面的沉积量远大于新鲜的石墨表面;与此同时,XPS 测试结果表明,在含Co(TFSI)2电解液中浸泡后的石墨SEI 中检测到少量的金属态Co0,这可能是电解液中的Co2+与石墨SEI 内层中的微量锂金属发生反应。过渡金属离子沉积量大及存在金属态,最终导致石墨负极性能急剧衰退,这也说明之前没有考虑石墨表面SEI 膜存在的研究低估了过渡金属离子的沉积和危害。

图4 石墨电极的XPS 溅射结果[46]Figure 4 XPS sputtering results of graphite
综上所述可知,溶解的过渡金属离子主要通过与SEI 膜中的锂离子发生交换反应而沉积到负极界面,而不是通过还原反应沉积。因此,在负极界面上离子的价态大多数为+2。通过调控电解液组分,构筑高稳定(高键合能组分)的SEI 膜,有望减缓这种离子交换反应,进而抑制过渡金属离子的沉积和危害。此外,尽管已有文献探讨了不同过渡金属离子沉积(Ni、Co 和Mn)对负极界面稳定性带来的危害差异,但其背后机制仍未明确。
2 过渡金属离子对本体电解液的影响
关于过渡金属离子溶出后的危害研究,目前主要集中在其对负极界面性能的影响方面。然而,残留在本体电解液中的过渡金属离子对电池性能的影响也不容忽视。与锂离子相比,过渡金属离子具有更高的电荷密度,因此其在电解液中与阴离子、溶剂分子会形成更加复杂的溶剂化层结构,如Mn2+的高电荷密度使得其溶剂化层中的PF6-结构发生变化,更容易发生分解产生高反应活性的PF5,当电解液中同时含有Mn2+和PF6-时热分解温度下降,更容易发生分解变色(见图5)[47]。更重要的是,过渡金属离子催化电解液热分解后引起的电池性能衰退,比其沉积在负极界面引起的性能衰退更为严重。计算结果表明,Mn2+溶剂化层的还原稳定性更差,即本体电解液中的过渡金属离子还会催化降低电解液的还原稳定性,进一步加剧电极极化和电池性能衰退。抑制过渡金属离子对本体电解液稳定性的危害,可显著改善电池的循环性能,特别是高温循环寿命。

图5 电解液热储存与DSC 测试结果[47]Figure 5 Electrolyte storage at high temperature and DSC test results
综上所述可知,Mn2+离子对电解液的稳定性造成了严重影响,这是其高电荷密度所致。因此可以推断,其他高价态过渡金属离子也可能会带来类似的危害,但不同过渡金属离子所带来的危害程度尚未明确。
3 抑制过渡金属离子溶出所带来的危害
过渡金属离子从正极材料中溶出后,会残留在电解液中以及沉积到负极界面,导致电池性能衰退。因此,抑制过渡金属离子溶出对电池带来的危害迫在眉梢。Zhan 等[48]提出通过在电解液中引入成膜添加剂碳酸亚乙烯酯(VC)或氟代碳酸乙烯酯(FEC)可有效地提高石墨/LiMn2O4电池的性能,研究发现:电池在高温(55 ℃)下循环100 圈后,无添加剂的电池容量与初始容量相比损失了70%左右,而含有VC 或FEC 添加剂的电池的容量仅损失30%和50%;在添加剂电解液中循环100 圈后的石墨负极上沉积的Mn 含量比在无添加剂中的更高,这可能是添加剂分解为负极界面膜提供了更多了活性锂组分,使得更多的过渡金属离子与SEI 膜组分中的锂离子发生交换反应,表明添加剂参与形成的界面膜仍保有足够的活性锂组分用于离子传输;随后,发现虽然添加剂体系沉积的过渡金属离子更多,但其阻抗反而比无添加剂的小,可见过渡金属离子的沉积量与电极阻抗变化不一定成正比的关系。本课题组[40]通过在石墨/LiCoO2软包电池中加入环丁烯砜(3SF)成膜添加剂,提高了电池在4.5 V 高电压下的循环性能,实验结果表明:添加了2%的3SF 软包电池循环350 圈后容量保持率从42%增加到79%,电池极化也显著降低;电化学性能测试与电极表面组分表征结果显示,3SF 添加剂能够优先于电解液在负极表面发生还原分解,参与构筑一层薄且稳定的负极SEI 膜,该膜能够抑制溶解的Co2+在石墨负极上沉积,提高石墨负极/电解液界面稳定性,这是由于添加剂与Co2+的结合能力强,会优先与溶解在电解液中的Co2+结合,同时3SF 的高还原活性使得Co2+-3SF 结构得到电子时使3SF 发生还原,进而抑制Co2+被还原为高催化活性的金属态Co0(见图6)。

图6 DFT 计算结果[40]Figure 6 DFT calculation results
除上述添加剂外,还有一些报道显示能够抑制过渡金属离子沉积的添加剂,如碳酸锂[24]、二氟磷酸锂[49]和二苯基硼酸-2-氨基乙酯[50]等。除了使用成膜添加剂以外,提高电解液中的锂盐浓度也是抑制过渡金属离子沉积的另一有效方法。Cui 等[51]通过拉曼光谱、核磁共振波谱与红外光谱和电感耦合等离子体发射光谱等结果证明发现,电池在3 mol·L-1的LiTFSI/DMC 电解液体系中循环100 圈后,石墨电极中Mn 沉积量低于1 mol·L-1的LiTFSI/DMC 体 系。Wang 等[34]将上 述 电 解液 的 锂 盐改 为双(氟磺酰基)酰胺锂(LiFSA),通过DFT-MD 计算,结果表明高盐电解液体系主要提高了阴离子与Li+的配位作用,降低了过渡金属离子在电解液中的溶解度,最终提高了石墨/LiNi0.5Mn1.5O4电池在高电压下的循环稳定性与倍率性能。
目前,研究更多集中在降低过渡金属离子在负极的沉积,而在抑制过渡金属离子催化电解液热分解方面的研究较少。本课题组[52]在揭示Mn2+催化降低电解液热稳定性的工作基础上[47],提出通过在电解液中加入一种与Mn2+离子体积相匹配的1-氮杂-12-冠4-醚(A12C4)作为添加剂抑制其危害,理论计算与实验结果表明,A12C4 能够捕获电解液中的Mn2+并形成稳定的络合物,有效地抑制了Mn2+对PF6-结构的破坏,进而有效抑制了其对电解液的热催化分解(见图7),并最终显著提高了石墨/NMC523 软包电池的循环稳定性。
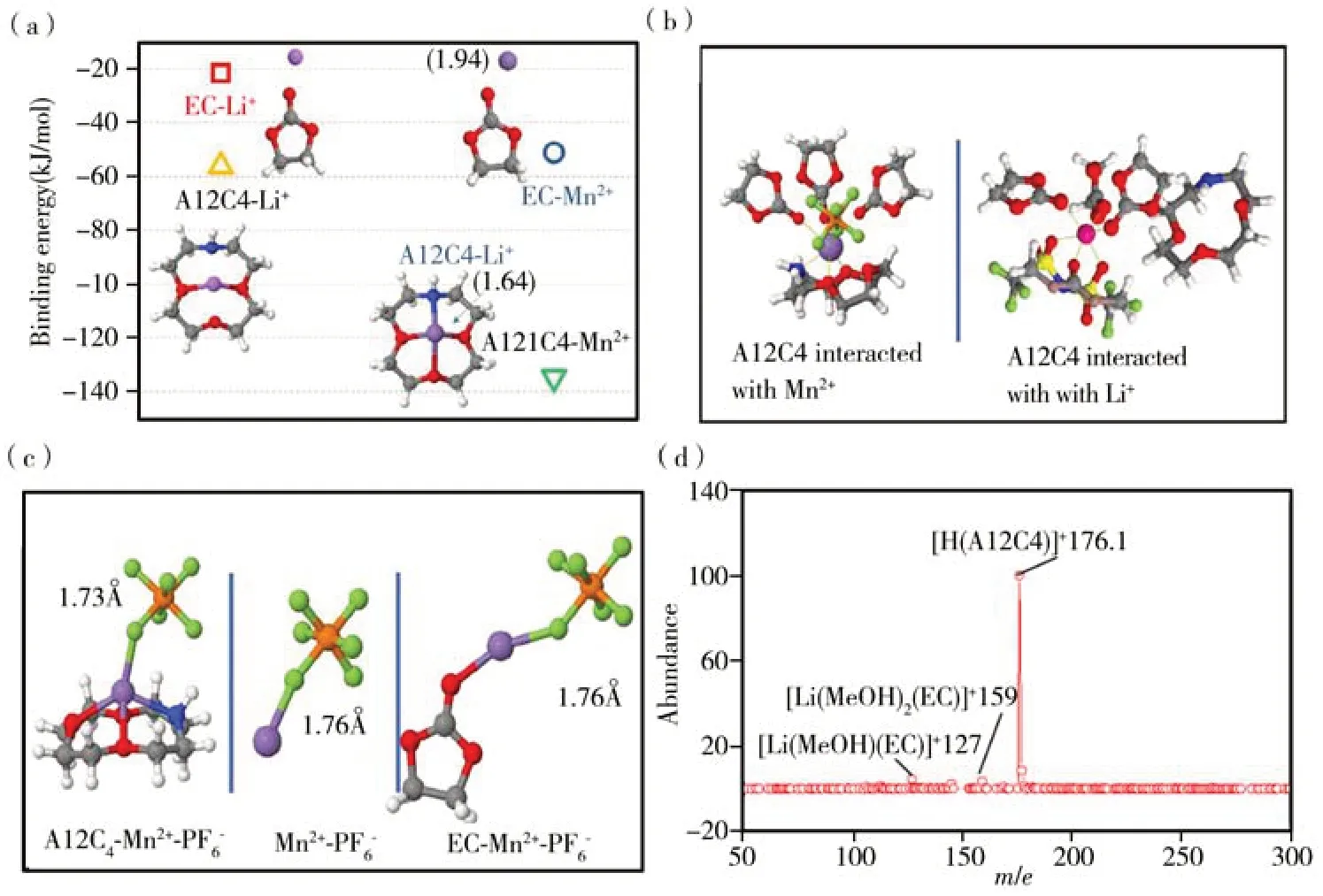
图7 DFT 计算,MD 模拟与ESI-MS 表征结果[52]Figure 7 DFT calculation,MD simulation and ESI-MS characterizations results
4 结论
含锂过渡金属氧化物正极材料在高电压、高温环境下容易发生过渡金属溶解,溶解的过渡金属离子在负极的沉积已被证明是造成电池性能衰减的重要原因。因此,研究过渡金属离子在负极沉积机制,有助于分析其沉积对电极/电解液界面性质及电池性能衰减的危害来源。过渡金属离子在负极的沉积危害主要表现两方面:(1)催化负极界面电解液分解,其分解产物在负极界面堆积导致界面膜阻抗上升,同时消耗了电池中的活性锂;(2)与负极界面SEI 膜组分中的Li+发生离子交换,加剧过渡金属离子沉积,阻碍了Li+的正常传输。与此同时,过渡金属离子残留在本体电解液中也会引起电池性能衰退,而且残留在本体电解液中所带来的危害甚至比沉积到负极界面更为严重。过渡金属离子电荷密度更高,结合溶剂分子及阴离子的能力强于Li+,因此在电解液中会形成更加复杂的溶剂化层结构。过渡金属离子诱发其溶剂化层中PF6-发生热分解产生高反应活性的PF5,进而降低含PF6-电解液的热稳定性。另外,过渡金属离子催化降低其溶剂化层内阴离子与溶剂分子的还原稳定,导致电解液在负极界面的分解更加严重。
通过电解液的调控,可以有效抑制过渡金属离子对电池性能的危害。当添加高还原活性的成膜添加剂,在负极形成更稳定的界面膜,抑制过渡金属离子与界面膜中的锂离子发生离子交换,进而降低沉积量;当添加高稳定和高选择性的添加剂时,捕获并稳定电解液中残留的过渡金属离子,进而抑制其对电解液的热催化以及还原分解。
