免疫检查点抑制剂相关心脏毒性的临床特点及研究进展
2023-11-21邓悦周晓阳
邓悦 周晓阳
(武汉大学人民医院心内科,湖北 武汉 430060)
免疫检查点抑制剂(immune checkpoint inhibitor,ICI)通过激活免疫系统发挥抗肿瘤效应,极大地改善了肿瘤患者的预后。近年来,随着ICI的适用范围和使用人群的不断扩大,关于ICI相关不良事件的报道也逐渐增多,其中ICI相关心肌炎尤其引起人们注意[1-2]。但当前关于ICI相关心肌炎的报道大多为病例报道或发病机制的讨论,因此,现从流行病学、危险因素、发病机制、临床表现、诊断、治疗、预后及未来展望等多角度讨论ICI相关心脏毒性的特点,旨在更全面地了解ICI相关心脏毒性,为临床的诊断和治疗提供参考。
1 流行病学
回顾性分析[3]2016年6月—2019年12月6 925例患者行抗程序性死亡受体1(programmed death-1,PD-1)、抗程序性死亡受体配体1(programmed death-ligand 1,PD-L1)治疗后所报告的主要不良心血管事件(major adverse cardiovascular event,MACE)显示,0.4%的患者报告发生MACE,0.18%报告发生心肌炎,其中22.2%的心肌炎患者死亡。2018年报告于VigiBase系统中的数据显示,ICI治疗后发生心肌炎、心包疾病的病例更多,其中50%的ICI相关心肌炎患者死亡,21%的心包疾病患者死亡[4]。分析ICI治疗与动脉粥样硬化事件间的关联发现,ICI治疗后动脉粥样硬化相关心血管事件风险增加3倍,其斑块的体积进展也更快[5]。2022年纳入41个随机对照试验共计23 121例肺癌患者的meta分析[6]显示ICI相关心肌炎的死亡率是44.4%。2021年,纳入1 265篇文章中4 751例患者的meta分析[7]显示,1.3%的患者报告发生ICI相关心脏毒性,其中心肌炎占50.8%,24.6%的心肌炎患者死亡。2022年另一篇纳入48个研究共计11 207例行ICI治疗的患者的meta分析[8]显示,致死性心脏毒性的发生率是1.3%。分析1 047例在西安交通大学附属第一医院行ICI治疗的晚期实体瘤患者的研究[9]显示,ICI相关心脏毒性的发生率是7%。最新的中国香港数据[10]显示ICI相关MACE是2.8%,其中4.4%的患者因此而住院。由此可见,ICI相关心脏毒性的发生率较低,但其死亡率却较高。见表1。
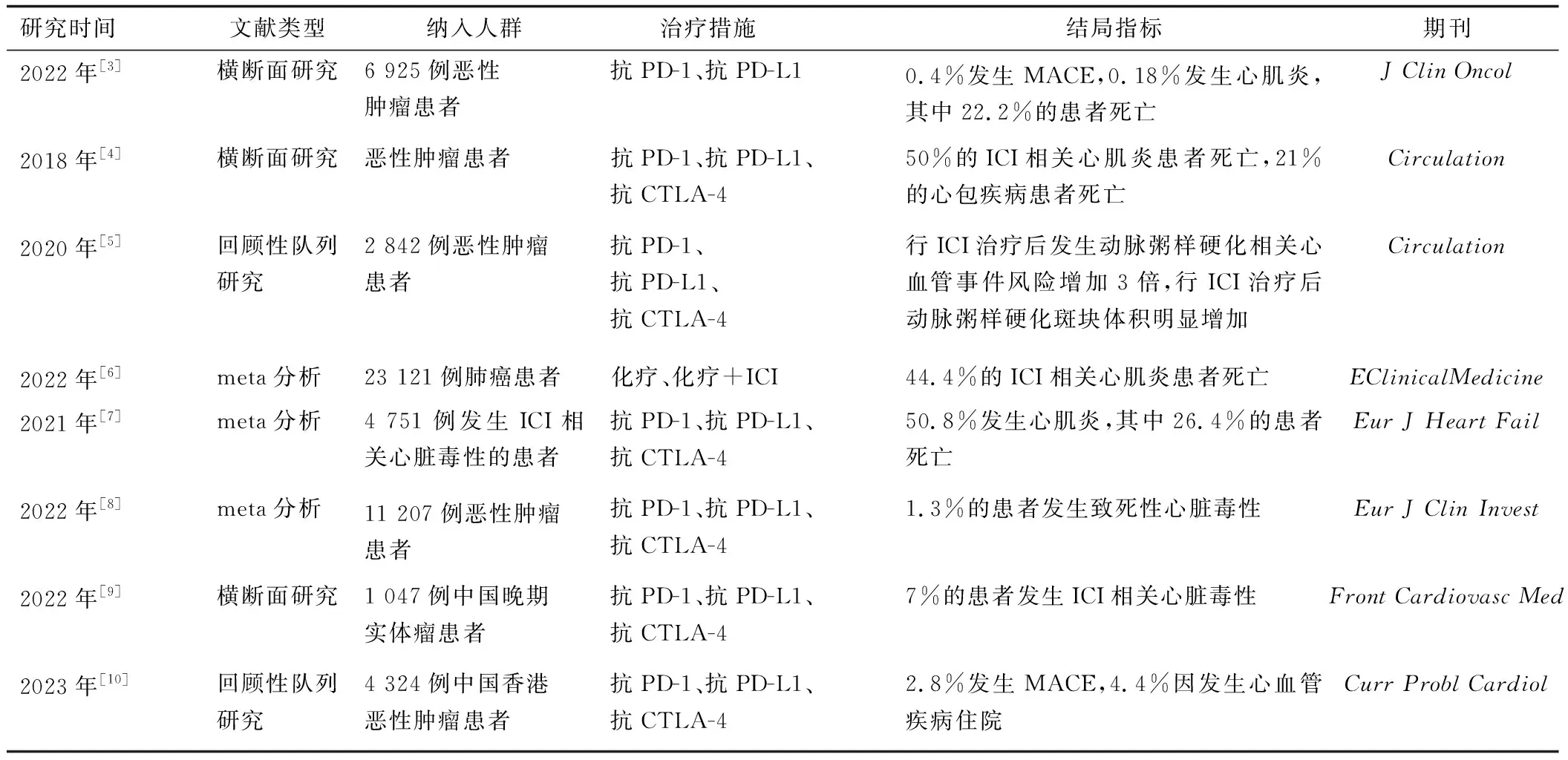
表1 2016—2023年行抗PD-1、抗PD-L1、抗CTLA-4治疗后发生心血管相关事件的回顾性分析
2 危险因素
2.1 肿瘤的治疗方式
已有多项研究[3,6-7,11-13]认为肿瘤的治疗方式会影响ICI心脏毒性:相较于单药ICI治疗,双药ICI联合、ICI+化疗、ICI+靶向治疗等方案均会增加ICI心脏毒性;其中,抗PD-L1+抗细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)+化疗的免疫相关不良事件(immune-related adverse event,irAE)风险最高,其次是双药ICI联合以及含抗CTLA-4的抗肿瘤治疗方案。
2.2 肿瘤的类型
2021年分析FDA不良事件报告系统中ICI不良事件与治疗方式、肿瘤大小间的关系认为,泌尿系统癌症发生肾炎、肾上腺功能减退、心肌炎的概率更高[14]。2023年分析11例行ICI治疗的胸腺瘤患者的研究[15]显示,36.4%发生ICI相关心肌炎。2022年的一篇研究[16]认为,B2/B3型胸腺瘤易合并多器官irAE,合并多器官irAE的死亡率更高。但尚无其他研究证实肿瘤类型与ICI心脏毒性存在相关性。
2.3 ICI的药物种类
2022年分析5 518例行ICI治疗的癌症患者的数据[17]显示,ICI单药治疗中,相较于纳武利尤单抗(nivolumab),伊匹单抗(ipilimumab)和帕普利珠单抗(pembrolizumab)发生MACE的风险更高。相较于纳武利尤单抗和其他抗PD-L1抗体,阿维鲁单抗(avelumab)发生MACE的风险更高[17]。
2.4 irAE累积的器官数量
分析中国6家医院的46例ICI相关心肌炎病例显示,合并多器官irAE的心力衰竭及心肌炎更严重,其预后也更差[16]。
2.5 患者的易感性
有病例报道行纳武利尤单抗治疗后的胃癌患者出现嗜酸粒细胞增多、心肌炎、急性肾小管坏死等药疹综合征,其分子学检测显示药疹综合征风险相关基因存在异常,但未来还需更多的基因易感性在发病中的作用的研究[18]。
2.6 其他
纽约心功能分级Ⅲ~Ⅳ级心力衰竭、糖尿病、常见的心血管疾病危险因素也是ICI相关心脏毒性的危险因素[9,16]。
3 发病机制
当前,ICI相关心肌炎的主要发病机制是ICI打破免疫耐受平衡,诱发自身免疫性心肌炎。
免疫耐受是指机体通过多种途径淘汰或抑制自身反应性免疫细胞,主要分为中枢免疫耐受和外周免疫耐受。胸腺髓质上皮通过表达组织限制性抗原消除自身反应性T细胞,该过程称为中枢免疫耐受。胸腺中组织特异性抗原表达水平的细微变化将影响器官特异性自身免疫疾病的易感性[19]。胸腺瘤患者行ICI治疗后同时影响外周和中枢免疫耐受,故其发生ICI相关心肌炎的风险明显增高[15]。
当自身反应性T细胞亲和力较低、胸腺细胞的自身抗原表达量较低、中枢免疫耐受逃逸时,则需外周免疫耐受,其中免疫检查点具有重要作用[20]。免疫检查点主要包含PD-1和CTLA-4,PD-1与PD-L1/L2结合抑制CD28介导的PI3K信号通路,从而抑制丝氨酸/苏氨酸激酶(serine/threonine kinase,Akt)磷酸化,抑制T细胞活化的最初阶段,其抑制程度取决于胞内酪氨酸受体功能[21](见图1)。但当T细胞存在CD28与CD80/86协同刺激信号通路时,PD-1的抑制作用将会减弱,白细胞介素(interleukin,IL)-2、γ干扰素(interferon-γ,IFN-γ)等细胞因子仍增加,T细胞大量增殖。CTLA-4与CD80/86结合通过蛋白磷酸酶2A而抑制Akt磷酸化,抑制细胞因子分泌及T细胞的进一步发展和大量增殖等,由于其对PI3K无抑制作用,故PI3K通路相关基因如Bcl-xL等可正常表达。因此,PD-1与CTLA-4在维持免疫耐受方面既协同又有差异[21](见图2)。相较于使用单药ICI,联合使用两种ICI对胞内Akt信号通路的抑制作用明显减弱,故更易发生自身免疫性心肌炎。
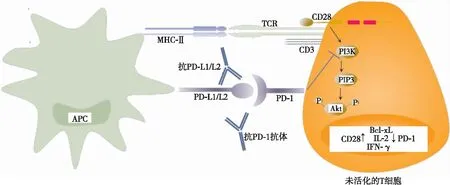
注:APC,抗原呈递细胞;MHC-Ⅱ,主要组织相容性复合体Ⅱ;TCR,T细胞受体;PIP3,3、4、5-三磷酸磷脂酰肌醇。图1 PD-1在T细胞的信号通路
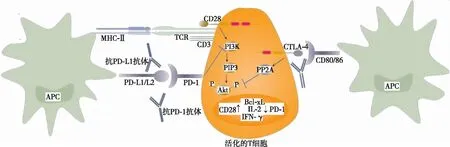
注:APC,抗原呈递细胞;MHC-Ⅱ,主要组织相容性复合体Ⅱ;TCR,T细胞受体;PIP3,3、4、5-三磷酸磷脂酰肌醇;PP2A,蛋白磷酸酶2A。图2 PD-1与CTLA-4在T细胞的信号通路既协同又有差异
PD-1表达于T细胞、胸腺细胞,PD-L1/L2表达于抗原呈递细胞和其他组织。PD-1与PD-L1/L2的结合抑制T细胞活化的最初阶段和细胞因子的分泌,调节T细胞活化和增殖的程度,同时也控制自身反应性T细胞使其处于自身免疫性疾病的阈值之内,维持外周免疫耐受;PD-1信号通路的中断会导致自身免疫性心肌炎,用抗PD-1抗体处理A/J小鼠后发生心肌炎,组织学显示大量能识别肌球蛋白的自身免疫T细胞浸润A/J小鼠心肌[22];行阿替丽珠单抗治疗肺癌后发生ICI相关心肌炎的组织病理学显示无肿瘤浸润区域PD-L1高表达,CD3、CD68、CD8细胞大量浸润,其CD3表达水平明显高于急性心肌梗死、非ICI相关心肌炎[23]。
CTLA-4表达于活化后的T细胞,其在T细胞激活后的2~3 d表达水平明显升高,CTLA-4与CD80/86结合抑制IL-2的转录,调整细胞周期,抑制自身反应性T细胞,调节T细胞的分化等,在早期阶段抑制T细胞的大量增殖及活化状态的进一步进展,进而下调免疫功能,维持自我耐受[24-27](见图1)。CTLA-4对炎症的发生和发展具有决定性作用,抗CTLA-4使活化后的T细胞大量增殖和细胞因子的分泌不受控制进而导致炎症瀑布,故抗CTLA-4所导致的ICI相关心肌炎风险增高。
另一方面,ICI也促进动脉粥样硬化斑块进展,增加动脉粥样硬化斑块相关心血管事件的风险。抑制血管内皮细胞的PD-1/PD-L1通路使T细胞激活,促进血管炎症以及斑块的进展和破裂,发生急性冠脉综合征(acute coronary syndrome,ACS)[28]。2020年采用病例交叉研究和回顾性队列研究的方法分析ICI与动脉粥样硬化性心血管事件的关系发现,ICI队列的斑块进展更快,其发生ACS风险明显增加[5]。除此之外,其它协同刺激性检查点CD40/40L、Ox40L和协同抑制性检查点CD200/200R对动脉粥样硬化也具有调节作用[29]。
总之,ICI通过提高T细胞活性发挥抗肿瘤效应的同时,也打破自身免疫耐受平衡,促进斑块破裂,诱发ICI相关心肌炎和ACS。此外,肠道菌群与ICI相关心脏毒性之间可能也存在关联:肠道菌群紊乱通过下调PPARα-CYP4X轴促进结肠巨噬细胞M1样极化,促进促炎因子肿瘤坏死因子-α及IL-1β的产生,诱发炎症反应。行抗PD-1处理的菌群失调大鼠结肠巨噬细胞的M1样极化增加,而抑制巨噬细胞、肿瘤坏死因子-α及IL-1β时,大鼠的心脏毒性则减轻[30],未来还需更多的研究探讨肠道菌群对ICI相关心脏毒性的确切机制。
4 临床表现及诊断
ICI相关心肌炎的临床表现差异很大,大多数患者表现为胸痛、乏力或无症状,重症者合并重症肌无力,辅助检查通常有心肌肌钙蛋白(cardiac troponin,cTn)、心肌型肌酸激酶同工酶水平升高,心电图显示心律失常,心脏超声异常等结果,由于上述异常指标无特异性,故确诊ICI相关心肌炎的金标准是心肌活检,但其合并症较多,临床常推荐心脏磁共振(cardiac magnetic resonance,CMR)和冠状动脉造影鉴别其他疾病[31]。比较ICI相关心肌炎、ICI治疗前、病毒性心肌炎的CMR,发现ICI相关心肌炎和病毒性心肌炎的T1、T2序列和细胞外体积分数均更高,晚期钆增强更普遍,但ICI相关心肌炎常累及中隔段和中壁层,且累及中隔段晚期钆增强患者预后较差[32]。但值得注意的是,心肌活检除能明确诊断外,还能提示肿瘤的后续免疫治疗。
1例黑色素瘤患者行纳武利尤单抗+伊匹单抗治疗3周后出现暴发性心肌炎,免疫组织化学示CD8、PD-1 T淋巴细胞大量浸润于原发性肿瘤和转移性网膜,但该细胞不能攻击肿瘤细胞,故推测该患者肿瘤免疫治疗耐药[33]。
对于心肌炎的发病间隔距首次ICI治疗较长时,应谨慎诊断ICI相关心肌炎。1例转移性肾癌患者行纳武利尤单抗治疗27个疗程后出现急性心肌炎,心肌活检示大量单核、巨噬细胞浸润心肌,心肌严重坏死,免疫组织化学示大量CD68、CD8细胞,而CD4、CD20细胞阴性,炎症毒性标志物阳性,心肌中检测到肠道病毒RNA基因组和病毒蛋白,考虑诊断病毒性心肌炎[34]。
因此,怀疑ICI相关心肌炎时,需结合冠状动脉造影和CMR排除感染和缺血因素,以及药物使用与发病的时间间隔,但金标准仍是心肌活检。
5 治疗及预后
基于美国临床肿瘤学会和欧洲肿瘤内科学会所发布的指南[35-36]认为:ICI心脏毒性发病时间是2~54周,中位时间是6周。仅有心脏标志物异常的Grade 1级患者无需停止ICI治疗,6 h后复查cTn;≥Grade 2级患者立即停止ICI治疗,24 h内启动强的松1~2 mg/(kg·d)治疗,直至心脏损伤缓解;若反应较差则改为甲泼尼龙1 g/d联合免疫抑制剂治疗,持续3~5 d;ACS等其余心脏疾病根据美国心脏病学会指南处理,新发传导阻滞可植入起搏器。Grade级别较低的患者后续可重启ICI治疗,但还需更多的研究来评估重启的安全性[37]。
当前关于ICI相关心肌炎的治疗效果仅有病例报道,对16例病例报道的ICI相关心肌炎统计显示2例死亡,但还需更多的研究来探讨该群体的远期心脏功能状态以及大剂量肾上腺皮质激素治疗后对肿瘤的影响[18,23,38-51]。
6 未来展望
尽管越来越多的证据表明免疫检查点在动脉粥样硬化中的重要性,但在心血管领域基于免疫检查点的治疗研究仍很少,未来还需更多的研究来探讨免疫检查点在不同类别细胞中的作用,以此开发针对动脉粥样硬化等心血管疾病的潜在治疗药物。同时,还需鉴定更多ICI相关心肌炎相关基因来识别高风险ICI相关心肌炎的患者,以此降低ICI相关心肌炎的发病率。