神经免疫心血管界面在动脉粥样硬化中的研究进展
2023-11-21陈艳华孙慧
陈艳华 孙慧
(1.山东第一医科大学,山东 济南 250000; 2.山东第一医科大学附属中心医院心血管科,山东 济南 250000)
动脉粥样硬化斑块形成于动脉内膜层,斑块可能损害重要器官的血液供应,导致心血管疾病(cardiovascular disease,CVD)、脑卒中及其他危及生命的事件,是工业化国家死亡的主要原因[1]。众所周知,动脉粥样硬化的发病机制至今尚未彻底阐明,特别是神经方面的作用。到目前为止,人们传统上认为神经系统不直接参与动脉粥样硬化的发病机制,因为斑块不受神经支配,而免疫系统对斑块的反应是在动脉外膜形成白细胞浸润[2]。Mohanta等[1]发现,在载脂蛋白E缺乏(apolipoprotein E deficiency,ApoE-/-)小鼠中,感觉神经纤维和交感神经纤维在主动脉外膜分布极丰富,轴突网络在邻近动脉粥样硬化斑块的节段中显著增加,在动脉第三淋巴器官(arterial third lymphoid orga,ATLO)(类似于慢性炎症部位淋巴结样结构的免疫细胞聚集体)和靠近中膜平滑肌细胞外层的外膜-中膜边界处稳定分布,形成广泛的神经免疫心血管界面(neuroimmune cardiovascular interfaces,NICI),此发现为神经调控动脉粥样硬化的研究奠定了基础。此外急性应激和昼夜节律的动力性,遗传学技术的特定性也为神经免疫学方法治疗动脉粥样硬化提供了一定的方向。现就动脉粥样硬化形成机制中神经免疫系统及驱动因素方面进行综述,以提高动脉粥样硬化的预防与治疗水平。
1 NICI
众所周知,动脉粥样硬化的发病机制目前尚未彻底阐明。而对于神经免疫方面,近年来Mohanta等[3]通过结合神经血管联系和神经免疫学的原理,发现神经系统、免疫系统和心血管系统在三方而非两方相互作用中进行复杂的交叉作用,形成NICI。并建立了广泛的动脉-脑回路(artery-brain circuit,ABC),即可使斑块诱导的感觉神经纤维通过信号转导来驱动大脑神经重塑,进而刺激动脉外膜交感神经和副交感神经的新生长,促进斑块的进一步生长。此发现也为临床医师在诊疗救治方面提供了新的方向和治疗方案。
1.1 神经系统
1.1.1 周围神经系统
血管壁分为内膜层、中膜层和外膜层。内膜层由一层内皮细胞组成,中膜层一般由弹力纤维等组成,外膜层由上皮细胞组成。尽管血管的内膜层无神经支配,但周围神经系统(peripheral nervous system,PNS)可与血管的最外层即外膜层连接。PNS除了稳态控制动脉血压外,越来越多的证据也表明交感神经系统的激活可调节动脉炎症的发生和发展。Mohanta等[1]通过对小鼠动脉粥样硬化中轴突密度与粥样斑块大小的相关性的一系列实验数据监测,进一步证实了ApoE-/-小鼠的交感神经和伤害性感受器轴突末梢直接支配外膜。外膜神经支配由直接支配外膜的轴突末梢和指向远处目标的其他传递纤维组成。轴突新生仅限于整个主要动脉树区域的动脉粥样硬化段,且这些反应与疾病进展平行。外膜轴突生长随年龄增长而增加,在ApoE-/-小鼠中,与非ATLO区域相比,ATLO中轴突生长明显更多。有趣的是,斑块和ATLO大小的增加与PNS广泛的神经炎症呈正相关[4]。鉴于交感神经依赖去甲肾上腺素介导的信号,可发现降低去甲肾上腺素水平或外科切断支配外膜的神经传导通路,因内皮细胞活化和应激诱导的白细胞流入动脉粥样硬化斑块的数量将减少,使斑块体积缩小[5]。神经系统似乎通过调节免疫细胞动员和迄今未知的机制渗透到炎症部位来防止疾病进展。尽管动脉粥样硬化斑块不受神经支配,但消融这些区域的交感神经支配可减轻动脉粥样硬化斑块的形成,这是斑块进展的神经调节的一个潜在证据,也是一种潜在的新治疗策略。
1.1.2 ABC
由于PNS将外膜作为其到达远处目标的主要通道[6],Mohanta等[1]通过假设外周神经可能直接与病变动脉相互作用,发现广泛的NICI出现在小鼠和人类动脉粥样硬化病变的外膜节段中,显示出扩展的轴突网络,包括免疫细胞和介质平滑肌细胞附近轴突末端的生长锥。另外,Mohanta等[1]也发现小鼠NICI建立了ABC即腹主动脉外膜痛觉传入[7]通过脊髓T6~T13背根神经节进入中枢神经系统(central nervous system,CNS),多个感觉及交感CNS神经元被追踪到脑干和杏仁核神经元,交感神经通过脊髓中间外侧神经元和腹腔神经节从延髓和下丘脑神经元投射到动脉外膜。局部神经血管炎症通过ABC激活CNS的不同区域。此外,ABC中PNS成分被激活:脾脏交感神经和腹腔迷走神经活动随着疾病进展而增加,而对PNS进行化学去神经支配或外科腹腔神经节切除术后发现,经过处理的小鼠表现出动脉粥样硬化减轻,其特征是ATLO的数量、大小和细胞组成减少,斑块更稳定、更小[1](见图1)。
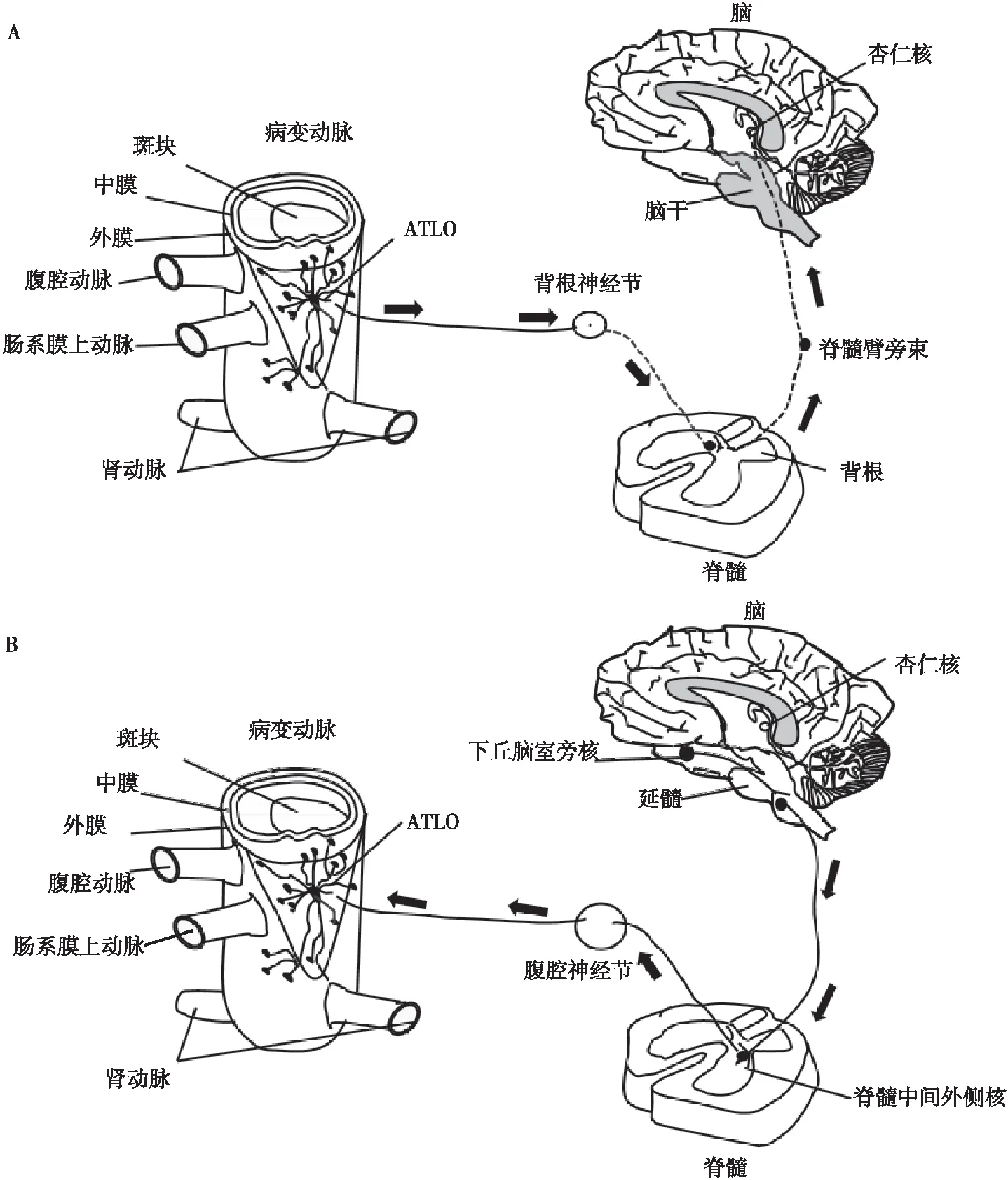
注:A,ABC传入通路;B,ABC传出通路。图1 ABC传入及传出通路图
1.2 免疫细胞
免疫细胞是指参与免疫应答或与免疫应答相关的一类细胞群。动脉粥样硬化斑块形成是一个复杂过程的结果,包括亚内皮脂质滞留、免疫细胞迁移、蛋白水解损伤,这些都会导致大动脉壁的慢性炎症反应,最终导致斑块形成[8]。Coller[9]发现,全身白细胞计数升高与心血管并发症风险增加之间存在相关性。具体而言,白细胞向组织的募集过程以及黏附的白细胞与血液中其他自由流动成分之间的相互作用加剧了血管闭塞的危险性和脂多糖诱导的致死性[10]。炎症细胞,主要是中性粒细胞和炎性单核细胞[11],通过E选择素、P选择素、趋化因子、白细胞整合素[包括淋巴细胞功能相关抗原-1(CD11a/CD18)]和巨噬细胞抗原-1(CD11b/CD18)与细胞间黏附分子-1和血管细胞黏附分子-1[12]等相互作用滚动并黏附于血管内皮上,从而激发血管的炎症反应,最终导致动脉粥样硬化斑块形成。另外,Mohanta等[1]通过实验检查了小鼠较大的神经、血管周围神经节和体感背根神经节,发现老年ApoE-/-小鼠的血管周围神经节和背根神经节中存在广泛的炎症。巨噬细胞、T细胞和肥大细胞在血管周围神经节和背根神经节的胞体中浸润和/或扩张。内膜免疫细胞浸润在动脉树中系统性扩张,一些免疫细胞聚集体在小鼠和人动脉床的不同部位发育成结构良好的ATLO[13-14]。因ATLO类似于慢性炎症部位淋巴结样结构的免疫细胞聚集体,因此调节ATLO的形成可成为调节动脉粥样硬化免疫反应的一个途径,也为控制动脉粥样硬化的进展提供了一个全新的平台[15]。
1.3 血管系统
动脉粥样硬化病变从一个有序结构的动脉壁演变而来,形成一个由驻留细胞和新招募细胞组成的复杂集合体[8]。斑块,也称为动脉粥样硬化,形成于动脉内层(内膜)。成熟的动脉粥样硬化通常在纤维帽下含有富含脂质的中心核。内皮细胞单层位于斑块表面,提供与血液的关键界面[8]。动脉粥样硬化是一种炎症性疾病,针对炎症的治疗策略已被证明能有效降低不良心血管事件的发生率[16]。促炎和抗炎过程之间的不平衡性,不仅能驱动动脉血管壁中的慢性炎症,也能决定动脉粥样硬化斑块的命运,致斑块极其不稳定(如斑块破裂和侵蚀)[17]。动脉的外结缔组织层,即外膜,被神经系统用作到达外周组织的主要通道[6]。神经纤维轴突网络可在邻近动脉粥样硬化斑块的节段中显著增加,在ATLO和靠近中膜平滑肌细胞外层的外膜-中膜边界处稳定分布,形成广泛的NICI。因此,血管系统[18]在动脉粥样硬化中的三方而非双向组织相互作用中具有双重作用:外膜层直接启动与PNS和免疫系统的相互作用,作为神经系统不可或缺的支架[19],而其内膜层通过管腔侧的内皮细胞募集白细胞以促进斑块生长[20]。因此,未来可进一步探究外膜NICI内三方而非双向相互作用的这些主张,并可有效解决血管系统在动脉粥样硬化以外的多种无法解决的神经免疫学相关疾病。
2 动脉粥样硬化的驱动因素
2.1 急性应激
据临床和流行病学研究[21]表明,急性应激所包含的方面极广,如压力,压力是动脉粥样硬化的一个关键危险因素,精神压力的增加会加速CVD的风险,并对动脉粥样硬化的发生和发展起重要作用。而且,长期精神紧张也可导致血清胆固醇水平的升高,也是驱动动脉粥样硬化斑块形成的一个危险因素。因此,通过减轻压力来改善心理健康状况是预防压力性CVD的一个治疗前沿。从机制上讲,急性应激通过内皮细胞和巨噬细胞的去甲肾上腺素依赖性调节,通过激活内皮细胞上的细胞黏附分子以增强白细胞向组织的募集,从而驱动血管炎症和动脉粥样硬化斑块的进展。除了压力,越来越多的证据也证实了伤害性感受和免疫系统之间存在着强烈的关系,也是通过与以上所述的压力类似的机制来影响炎症过程的[4]。另外,控制压力和焦虑的心理干预或药理学方法在CVD患者中更为普遍,且与疾病的预后息息相关,也是一个很好的临床治疗方向。健康状况下降、睡眠质量差、疼痛评分高、血管老化以及衰老期间体力活动减少,均可增加免疫细胞浸润和血管炎症,引发应激性动脉粥样硬化,使成年人更易患CVD等疾病[4]。Mohanta等[1]研究发现在降低CVD负担的机制中靶向神经递质如去甲肾上腺素和多功能分子如Netrin-1也是治疗CVD的可行新候选药物。因此,可将抑制去甲肾上腺素能信号转导的药物如β受体阻滞剂,作为改善急性冠脉综合征预后的一线治疗,并作为高危患者降低CVD发病率和死亡率的二级预防措施。
2.2 昼夜节律
动脉粥样硬化病变的白细胞浸润作为动脉粥样硬化消退的主要驱动因素,已被证明受到昼夜节律的严格控制[22]。事实上,交感神经失神经或抑制β2肾上腺素受体信号转导后,动脉白细胞募集的昼夜节律振荡消失。白细胞、内皮细胞或动脉壁细胞中核心时钟基因Bmal1(也称为Arntl)的缺失均以血管类型特异性的不同方式影响了振荡。因此,白细胞昼夜黏附在急性血管炎症的发病时间中起着关键作用[23-24]。昼夜节律的周期长度约为24 h,在生物体适应环境中有节奏的明暗变化方面也起着关键作用[25]。光可携带这些节律,导致下丘脑视交叉上核的节律同步,后者构成生物体的主时钟[22]。因此也使外周组织的时钟同步,从而在全身设置一个共同的相位。至此,交感神经系统调节肾上腺皮质激素、肾上腺素和去甲肾上腺素的节律性和全身性释放也可得到很好的解释。此外,交感神经直接支配组织,并可通过从静脉曲张中释放去甲肾上腺素来调节局部生理学,局部和全身应用炎症刺激可导致中性粒细胞到达炎症部位的能力不同[26],表明炎症反应中受限环境信号的重要性。Juan等[22]观察到静脉中白细胞黏附的强烈振荡,但与动脉相比,这种节律表现出意外的相移。在动脉中,粘连在凌晨达到高峰,并在午夜左右出现。相比之下,静脉中的白细胞黏附在早晨达到低谷,在午夜达到高峰。白细胞血管内黏附反应的节律性导致动静脉血管在不同的时间段与血小板的相互作用达高峰,因此血管在不同的时间段内发生急性血栓的风险是有差异的。因此可看出,有效控制时间依赖性血管类型特异性血栓形成在预防和治疗动脉粥样硬化方面有一定的潜在意义。
3 讨论
研究发现,遗传学技术包括光遗传学和化学遗传学,提供了以特定类型和区域的方式调节神经元的能力,这些技术可通过采用遗传策略在特定神经元中插入可光激活的离子通道或设计药物选择性激活的设计受体,实现对不同神经系统区域中特定神经元亚群的靶向激发和抑制[27]。在最近的一项研究中应用的光遗传学和化学遗传学方法表明,大脑中不同的区域以不同的方式快速控制循环中应激诱导的免疫细胞波动,这会损害免疫功能并增强对疾病的易感性[28],但也增强了对CVD进行靶向免疫调节的希望。光遗传学和化学遗传学等生物技术以及CRISPR/Cas9等基因组编辑工具的最新研究进展能加深对脑器官通信的理解,开发能精细调节参与动脉粥样硬化的神经免疫轴的工具,对于在不确定普遍免疫抑制和其他非靶向效应的情况下实现组织靶向免疫调节至关重要,并将有助于确定精准医学的新治疗靶点[4]。动脉粥样硬化中神经支配、白细胞、血管外膜三者相互作用形成广泛的NICI,遗传学技术的靶向调节作用也为神经免疫学方法预防和治疗血管炎症和斑块形成提供了一定的方向。
神经免疫研究进展[29-30]使笔者考虑了以下可能性:在动脉粥样硬化形成过程中出现了不同的NICI参与活性结构ABC的形成,瞄准ABC的交感神经系统参与动脉粥样硬化进展的控制。且除了结构ABC外,PNS轴突在动脉粥样硬化段外膜局部释放肾上腺素和其他介质,也可刺激免疫细胞聚集形成[1]。因此从CNS投射的异常电活动和β2肾上腺素受体激活刺激免疫细胞的局部模型可能是调节动脉粥样硬化的神经免疫轴的基础[31]。总之,目前已知的神经系统、脉管系统和免疫系统三方的相互关系有助于疾病的发展。但仍需更加全面和深入的研究来定义外周炎症激活神经元系统的详细分子机制,以及了解神经系统和压力等危险因素如何控制炎症部位的免疫细胞功能,来进一步加强对动脉粥样硬化发展和治疗的理解,优化治疗方案,达到改善患者临床预后的目的。