3 种高温大曲发酵过程中细菌群落结构演替规律
2023-11-20黄魏李浪金谢丹吴成程平言张健尤小龙胡峰
黄魏,李浪金,谢丹,吴成,程平言,张健,尤小龙,胡峰
(贵州习酒股份有限公司,贵州 习水 564622)
高温大曲是酱香白酒的糖化发酵剂,是保证其质量和风格的关键,高温大曲制作过程采用自然固态发酵,发酵仓内不同部位温度、水分等存在差异,导致安曲曲坯在入仓发酵后产生黄曲、白曲、黑曲3 种形态。入仓堆积于中层,溶氧较好易形成黄曲;入仓堆积于中下层,溶氧少,湿气重,水分大,热曲时间长则易形成黑曲;入仓堆积于上层,水分挥发快,热曲时间短则易形成白曲[1],3 种大曲在生产中自然形成的比例约为黄曲88%,白曲9%,黑曲3%[2],3 种大曲发酵过程动态变化如图1 所示。

图1 黄曲、白曲、黑曲发酵过程动态变化Fig.1 Characteraction during fermentation process of yellow Daqu,white Daqu and black Daqu
近年来,针对3 种高温大曲的差异研究陆续见报道,班世栋等[3]研究了不同颜色大曲酶活差异,发现白曲的液化酶、糖化酶、酸性蛋白酶和脂肪酶活力相对较高,黑曲的中性和碱性蛋白酶、纤维素酶和果胶酶活力较高,黄曲酶活力介于两者之间。Deng 等[4]研究了不同颜色高温大曲的差异:白曲表现出更高的蛋白酶活性和更低的酸度,黄曲糖化率最高,酯化率最低;功能预测表明,白曲和黄曲中编码细菌酶的基因丰度较高,与白曲(59%)和黄曲(87%)中Kroppenstedtia 丰度较高有关,黑曲Thermomyces 丰度最高(80%)导致编码真菌酶的基因丰度最高。张巧玲等[5]基于18 种游离氨基酸建立拆仓的白曲、黄曲、黑曲判别模型,提供了新的酱香型大曲类型判别方法。陈良强等[6]研究了出仓白曲(20 个)、出仓黄曲(21 个)、成品曲(113 个),结果表明微生物群落结构信息与3 种典型曲种具有强关联性并以此为依据建立了高温大曲类别判别模型。柳习月等[7]利用多组学技术对黄曲、白曲、黑曲进行解析,明确了不同曲种中微生物、代谢物的组成及差异,揭示了微生物以及代谢物之间的关联性。Gan 等[8]对半成品曲(黄曲、白曲)微生物组成进行研究,填补了成熟大曲微生物群中间阶段的研究空白,同时对比分析了半成品曲和成品曲在微生物组成和功能方面的差异,揭示了茅台大曲微生物群落与功能特性关系。
3 种高温大曲具备不同功能,对酱香白酒生产都有重要意义,目前业界对3 种高温大曲的研究主要集中在其发酵结束阶段,即半成品曲之间的差异,但由于3 种大曲在发酵之初就已形成差异,因此,本研究首次采用可培养结合未培养方法,深入解析黄曲、白曲、黑曲细菌菌群结构演替规律,同时探究物种相关性和理化因子对菌群结构多样性的贡献,从内在和外在初步揭示细菌菌群演替的驱动因素和调控机制,为保障3种高温大曲产量连续性,提高制曲优质品率提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品的采集与保存
样品采集自贵州习酒股份有限公司制曲车间,压制成型的曲坯作为安曲样品(发酵第0 天,直接取500 g作为一个样品),分别于一次翻曲(发酵第8 天)、二次翻曲(发酵第14 天)、拆曲(发酵第39 天)各采集3 块黄曲,粉碎混匀后取500 g,白曲、黑曲样品采集方式参照黄曲,同时对样品进行编号:AQ 代表安曲;YF-Y 代表一次翻曲黄曲,EF-Y 代表二次翻曲黄曲,CQ-Y 代表拆曲黄曲;YF-W 代表一次翻曲白曲,EF-W 代表二次翻曲白曲,CQ-W 代表拆曲白曲;YF-B 代表一次翻曲黑曲,EF-B 代表二次翻曲黑曲,CQ-B 代表拆曲黑曲,以上共计10 个样品,于-80 ℃冰箱中密封保存、备用。
1.1.2 试剂
孟加拉红培养基、营养琼脂:北京奥博星生物技术有限责任公司;WL 培养基:上海博微生物科技有限公司;E.Z.N.ATMMag-Bind Soil DNA Kit 试剂盒:美国OMEGA BioTek 公司;Qubit3.0 DNA 检测试剂盒:美国Life Invitrogen 公司;聚合酶链式反应引物:上海翌圣生物科技股份有限公司。
1.2 仪器与设备
无菌操作台(SW-CJ-2F):苏州净化设备有限公司;自动蒸汽灭菌器(KG-AP32L):日本ALP 公司;电泳仪(DYCZ-21):北京市六一仪器厂;凝胶成像系统(FR-1000):上海复日科技有限公司;Qubit3.0 荧光定量仪:美国Life Invitrogen 公司;PCR 仪(ETC811):北京东胜创新生物科技有限公司。
1.3 试验方法
1.3.1 可培养细菌分离筛选、鉴定
称取10 g 样品于90 mL 无菌水中,150 r/min 振荡30 min 得到10-1原液,然后吸取1 mL 加入9 mL 无菌水中得到10-2样液,进一步梯度稀释为10-3、10-4,取10-2、10-3、10-4涂布,每个梯度3 个平行,37 ℃静置培养2 d,挑取每个培养皿上不同形态的菌落划线分离,得到纯种菌株,每种形态采用甘油管平行保藏3 株,选取代表菌株送生工生物工程(上海)有限公司进行分子鉴定,测序结果运用美国生物技术信息中心(National Center of Biotechnology Information,NCBI) 数据库的碱基局部对准检索工具(Basic Local Alignment Search Tool,BLAST)进行序列比对。
1.3.2 样品DNA 提取、测序及生物信息学分析
总DNA 提取及聚合酶链式反应(polymerase chain reaction,PCR):采用E.Z.N.ATMMag-Bind Soil DNA Kit试剂盒提取样本总DNA,具体操作流程见试剂盒说明。引物341F (5'-CCTACGGGMSGCAGCAG-3')和805R(5'-GACTACHVGGGTATCTAATCC-3'),PCR 扩增条件:95 ℃预变性3 min;94 ℃变性20 s;55 ℃退火20 s;72 ℃延伸30 s;25 次循环;72 ℃终延伸5 min 降至4 ℃。PCR 反应体系:2×HieffR Robust PCR Master Mix 15 μL,正向及反向引物各1 μL,DNA 模板20~30 ng,使用ddH2O 补齐体系至30 μL。
测序:使用Illumina MiseqTM测序平台,分别对细菌16S rRNA 基因V3~V4 区进行高通量测序。
物种注释:下机数据经预处理得到有效序列,按照97%相似性对非重复序列(不含单序列)进行操作分类单元(Operational Taxonomic Units,OTU)聚类,在聚类过程中去除嵌合体,得到OTU 代表序列,采用核糖体数据库(ribosomal database project,RDP)完成比对。
多样性分析:用chao1 算法估计群落中含OTU 数目的指数;用Shannon、Simpson 指数估算样品中微生物多样性。用Coverage 表征各样品文库覆盖率,反映测序结果是否代表样本的真实情况[9]。
1.3.3 理化指标检测
大曲温度测量方式为取样时将特制温度计插入曲坯中心,待温度稳定后读取、记录数据;还原糖采用斐林法[10]测定;酸度、水分、糖化力参考QB/T 4257—2011《酿酒通用大曲分析方法》进行测定[11]。
1.4 数据处理
1.4.1 物种间相关性分析
选取所有样品中属水平相对丰度≥1 %的物种,采用SPSS24.0 软件计算Spearman 相关性系数,选择显著性p<0.05 的物种,采用Cytoscape5.0 软件绘制相关性网络图。
1.4.2 冗余分析(redundancy analysis,RDA)
采用理化指标与所有样品中属水平相对丰度排名前10 的优势物种丰度数据,使用Canoco5.0 软件进行RDA 分析。
2 结果与分析
2.1 3 种高温大曲发酵过程可培养细菌差异性
3 个曲种发酵过程共分离筛选到8 个属的12 种细菌,共保藏132 株,其中,发酵初始阶段即安曲样品共分离筛选到4 种细菌,黄曲发酵过程共分离筛选到7 种细菌,白曲发酵过程共分离筛选到6 种细菌,黑曲发酵过程共分离筛选到8 种细菌,见表1。
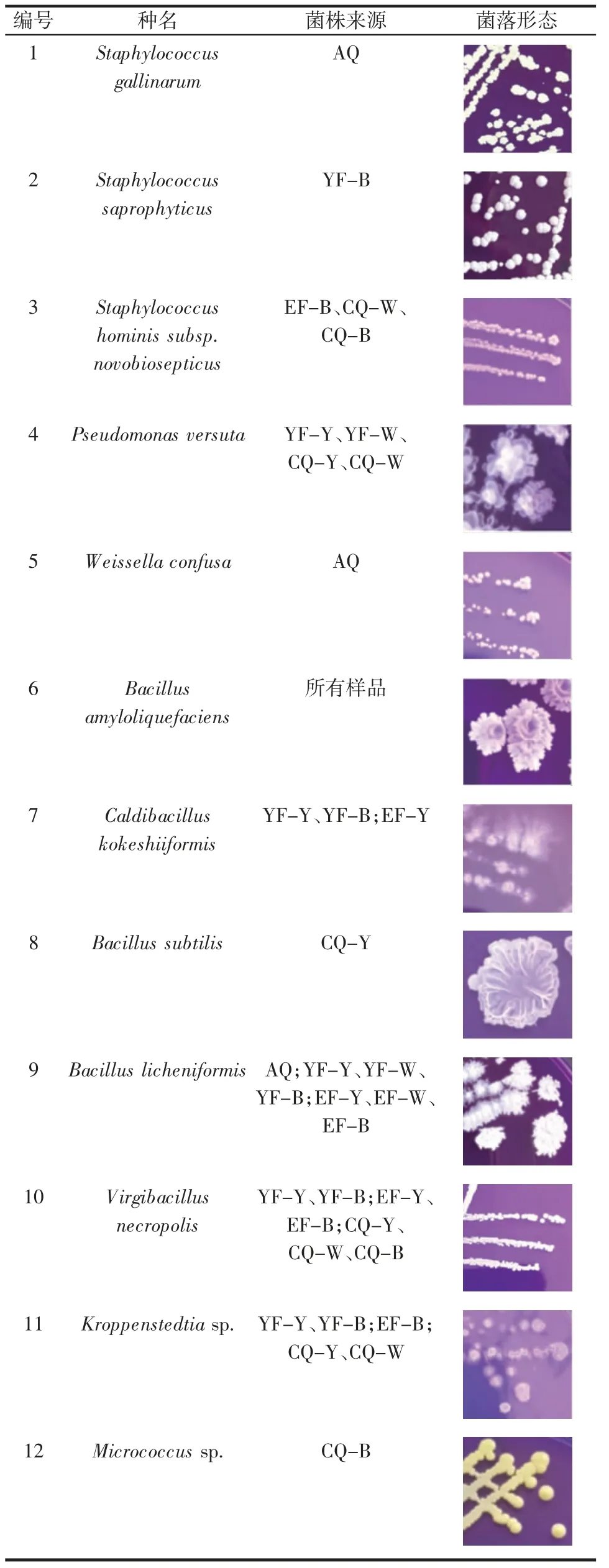
表1 可培养细菌来源及形态Table 1 Source and morphology of culture-dependent bacteria
由表1 可知,分布频率较高的菌种有Bacillus amyloliquefaciens、Bacilluslicheniformis、Virgibacillusnecropolis、Kroppenstedtiasp.,尤其是Bacillusamyloliquefaciens,在所有曲种每个发酵阶段均有检出,Bacillus属细菌可以产生淀粉酶、糖化酶以及吡嗪等风味物质[12-14]。仅在安曲样品筛选到的可培养细菌有Staphylococcus gallinarum、Weissella confusa,仅在黄曲发酵过程筛选到的菌有Bacillus subtilis,研究报道黄曲糖化率高[4],可能与Bacillus subtilis 产淀粉酶和糖化酶有关,仅在黑曲发酵过程筛选到的有Staphylococcus saprophyticus、Micrococcus sp.,Staphylococcus 作为大曲样品中的可培养核心细菌,具有可耐受高酸、高乙醇等特性[15],而白曲发酵过程未分离筛选到特有菌种,整体而言,黄曲和黑曲发酵过程的可培养细菌多样性高于白曲。
2.2 3 种高温大曲发酵过程未培养细菌差异性
2.2.1 α 多样性
本次测序共检出307 869 条有效序列,共检出15 个门、44 个纲、84 个目、157 个科、276 个属、404 个种的细菌,α 多样性指数见表2。
样品文库的覆盖率均达到99.8%以上,表明此次测序结果足以代表样本真实情况。由表2 可知,白曲Chao1 指数低于黄曲和黑曲,说明白曲物种丰富度低于黄曲和黑曲。黄曲和黑曲Simpson 指数和Shannon指数呈现动态变化,说明黄曲和黑曲发酵过程中其微生物多样性发生了较大的演变。白曲Simpson 指数呈现增加趋势,Shannon 指数呈现减少趋势,说明随着发酵进行白曲细菌多样性不断减少。AQ 样品Shannon 指数最低,Simpson 指数最高,其微生物多样性最低。
2.2.2 细菌菌群结构多样性
属水平相对丰度见图2。
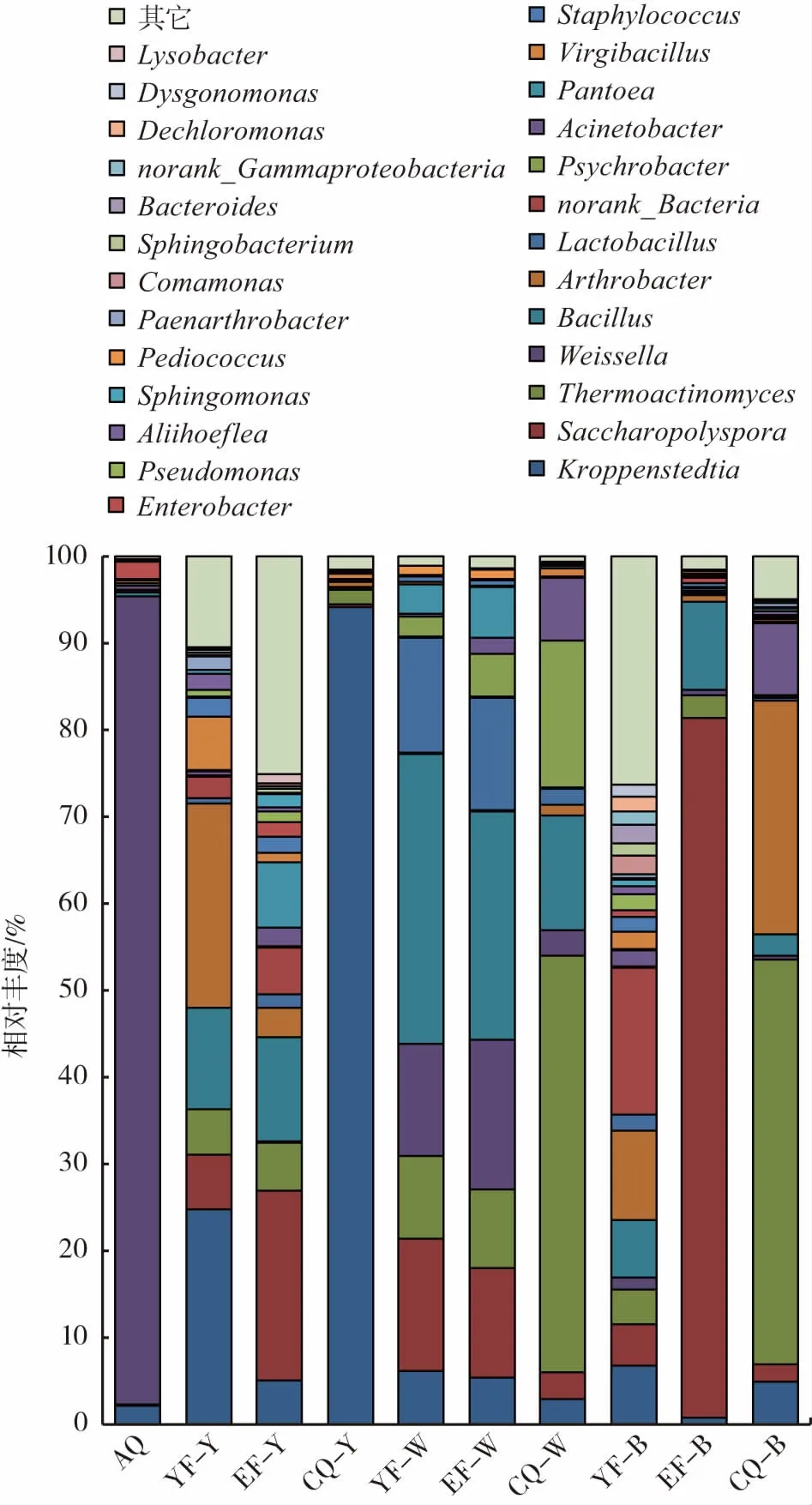
图2 属水平相对丰度图Fig.2 Plot of relative abundance at genus level
安曲曲坯微生物主要来源于母曲、原料等[16],优势细菌有Weissella (93.06%)、Kroppenstedtia (2.17%)、Enterobacter(2.00%),其中,Weissella 是绝对优势菌,周天慈等[17]研究中高温大曲微生物来源时也发现,该曲种在发酵开始阶段Weissella 是主要细菌,并且初步探明了在该生产工艺下,Weissella 主要来源于室内草席,值得一提的是,Weissella 在黄曲和黑曲后续发酵阶段均未呈现优势,表明Weissella 菌属可能并非这两种曲形成的关键微生物。
黄曲发酵前期的优势菌属主要为Kroppenstedtia、Arthrobacter、Bacillus、Thermoactinomyces、Saccharopolyspora 以及Virgibacillus,发酵中期由Saccharopolyspora、Bacillus、norank_Bacteria、Pantoea、Kroppenstedtia、Thermoactinomyces 替代,发酵后期的绝对优势菌属为Kroppenstedtia,丰度达到90%以上,据文献报道,Kroppenstedtia 菌属耐热能力强,在高温大曲中经常被检测到,但针对其发酵特性研究较少,需进一步揭示[18],而Saccharopolyspora 在黄酒麦曲中作为优势菌属被报道,麦曲发酵最高温度能达到50 ℃~60 ℃,表明该菌属能在极端环境下以芽孢的方式生存[19]。白曲发酵初期 以 Bacillus、Saccharopolyspora、Lactobacillus、Weissella、Thermoactinomyces、Kroppenstedtia 为主,发酵中期演替为Bacillus、Saccharopolyspora、Weissella、Lactobacillus、Thermoactinomyces、Pantoea、Kroppenstedtia,而其发酵后期则由Thermoactinomyces、Bacillus、Psychrobacter、Acinetobacter 主导,Thermoactinomyces 菌属的微生物具有较好的耐高温特性,常在高温大曲中检出,如Thermoactinomyces daqus 分泌的高温蛋白酶对大曲原料降解及大曲特征风味前体物质的形成具有潜在价值[20-21]。黑曲发酵过程中,norank_Bacteria、Arthrobacter、Kroppenstedtia、Bacillus 是发酵初期的优势微生物,发酵中期优势菌群为Saccharopolyspora、Bacillus,而发酵后期Thermoactinomyces、Arthrobacter、Acinetobacter 成为优势细菌,Li 等[22]研究茅台大曲中心黑色部分的细菌结构发现,排名前三的种分别是Bacillus sp.(45%)、Thermoactinomyces sp.(24%) 以及Saccharopolyspora sp.(21%),在本研究中,这3 个属的微生物丰度也占了相当大一部分比例,与该研究相似。
2.3 可培养与未培养方法结果比较
未培养测序技术具有快速分析鉴定样本中微生物群落组成的能力,特别是小类菌群的组成,可培养方法能够获得实体菌株,其可作为后续研究的物质基础。本研究通过未培养方法检测到的丰度排名前十的菌属为Kroppenstedtia、Weissella、Saccharopolyspora、Thermoactinomyces、Bacillus、Arthrobacter、norank_Bacteria、Lact-obacillus、Psychrobacter、Pantoea,可培养方法分离筛选到的优势菌属有Kroppenstedtia、Weissella、Bacillus、Staphylococcus、Pseudomonas、Virgibacillus、Caldibacill-us、Micrococcus,两种方法均检测到了Kroppenstedtia、Weissella、Bacillus,但是可培养方法并未筛选得到未培养检测到的其他优势菌属,是由于可培养方法存在工作量大、筛选不彻底等局限性,但就目前而言,可培养方法依然是获得实体菌株并研究其生长代谢特征不可或缺的手段,两种方法联用能够优势互补,更全面解析菌群结构多样性及其功能。
2.4 优势物种相关性
细菌属水平相关性网络图见图3。
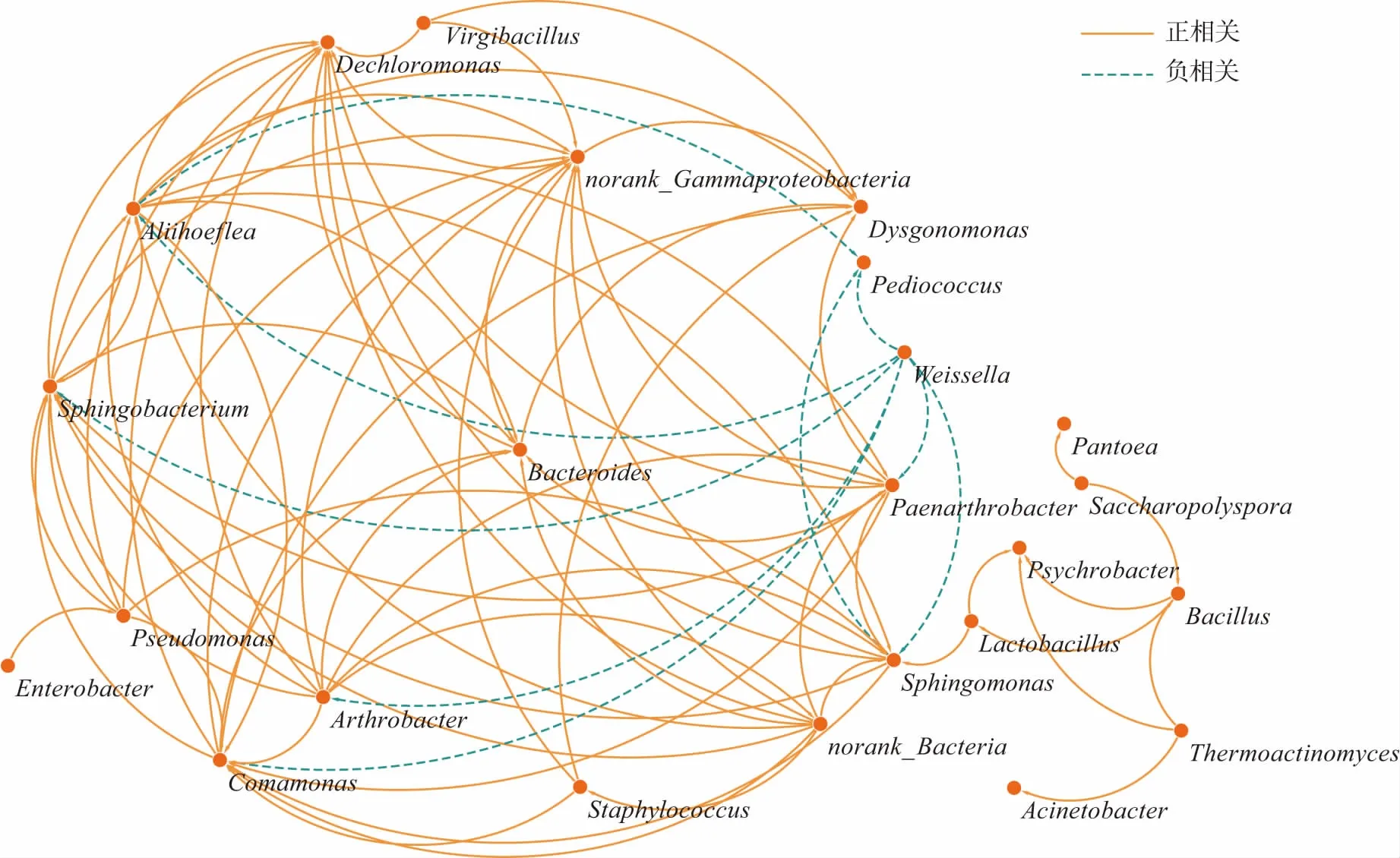
图3 细菌属水平相关性网络图Fig.3 Horizontal correlation map of bacteria at genus level
由图3 可知,24 个菌属间存在74 个正相关,9 个负相关关系,绝大多数细菌为正相关关系。其中,Weissella、Pediococcus 与其他菌属间只存在负相关关系,尤其是Weissella,与Arthrobacter 呈显著的负相关关系,Arthrobacter 在黄曲(23.58%)和黑曲(10.27%)发酵初始阶段均作为优势菌存在,但在白曲发酵初期其丰度接近于零,这可能是Weissella 生长受到Arthrobacter 的抑制,并未在黄曲和黑曲发酵过程保持其生长优势的原因。
Psychrobacter 与Thermoactinomyces 为正相关关系,两者在白曲发酵过程中,丰度均呈现逐渐增长的趋势,最终形成了以这两种菌属为优势的白曲菌群结构(丰度之和达到65.11%);黑曲发酵过程中,Arthrobacter与Thermoactinomyces 间的显著正相关关系,可能驱动黑曲最终形成以Arthrobacter 与Thermoactinomyces 为主导(丰度之和达到73.67%)的菌群结构,而黄曲发酵过程的优势菌属Kroppenstedtia 与任何一种细菌间无显著相关性,可能是由于黄曲发酵的环境因子更适合该菌属的生长,最终黄曲形成以该菌做为绝对优势菌的菌群结构。
2.5 优势物种与理化指标RDA 分析
理化指标结果见表3。优势物种与理化因子RDA分析图见图4。
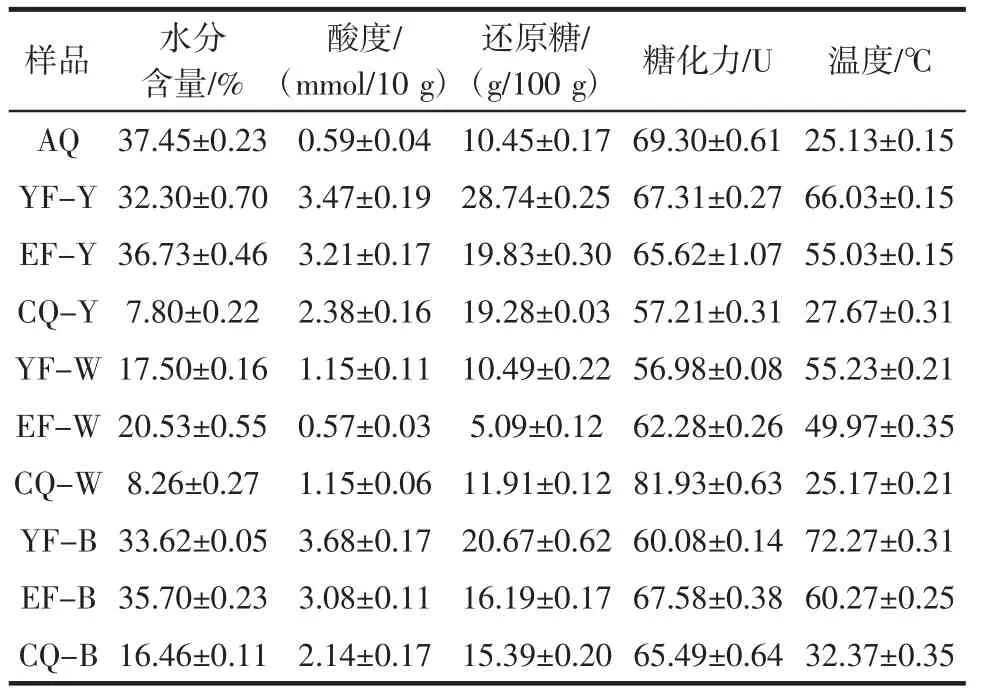
表3 理化指标Table 3 Physicochemical index
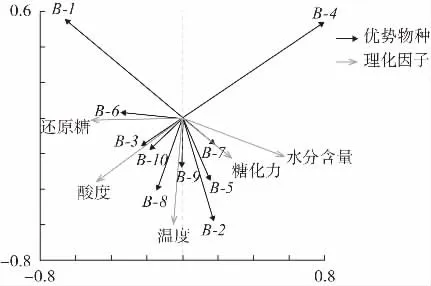
图4 优势物种与理化因子RDA 分析图Fig.4 RDA analysis diagram of dominant genus and physicochemical factors
利用冗余分析(RDA)探究理化因子对优势物种的影响,结果表明,Kroppenstedtia 与水分呈显著负相关,较低的水分含量有利于该菌生长,结合黄曲发酵过程来看,随着发酵进行水分逐渐降低,Kroppenstedtia 丰度逐渐升高,最终成为绝对优势菌;Saccharopolyspora、Bacillus 与温度和糖化力呈正相关,该研究结论与左乾程等[23]研究机械化制曲过程中细菌菌群结构演替的结论一致,大曲淀粉转化力通常用糖化力和液化力来衡量,Bacillus、Saccharopolyspora 与糖化力的正相关关系暗示了这两种微生物能产生糖化酶,而Bacillus 在白曲发酵前期、中期作为优势菌存在,这可能是白曲糖化力要高于黄曲和黑曲的主要原因[24];Thermoactinomyces 与酸度呈显著正相关,与水分含量呈负相关,结合理化指标来看,黑曲在发酵前期和中期酸度高于其余两种大曲,相对较高的酸度为该菌属提供了适宜的生长环境,这可能是该菌属最终在黑曲发酵结束形成优势的原因。Weissella 与酸度呈显著负相关,表明酸度过大会抑制其生长,这就解释了Weissella 在安曲阶段是优势菌,但是随着发酵进行,曲坯酸度上升,该菌属相对丰度锐减。
3 讨论与结论
高温大曲生产采用开放式自然发酵,许多不可控的内生环境因子会影响其微生物菌群结构[25],而不同的微生物菌群结构代谢特征差异大,因此采用可培养结合未培养方法,具有很好的互补性,两种技术联用解析菌群结构与功能特性更全面[26]。本研究中,可培养及未培养结果均表明,相对于黄曲和黑曲而言,白曲细菌多样性低,结构稳定性高,这与Wang 等[27]研究不同类型成品曲的细菌结构得出的结论一致。
值得一提的是,在本研究中,一是无论是可培养还是未培养方法检测到的初始阶段的绝对优势菌Weissella,在后续发酵过程并未一直延续其生长优势,而未培养方法检测到部分初始丰度极低的细菌反而随着发酵进程不断富集,在发酵结束成为了主导微生物,例如黄曲中的Kroppenstedtia;白曲中的Thermoactinomyces、Psychrobacter;黑曲中的Thermoactinomyces、Arthrobacter,上述特征性差异为3 种高温大曲的最终判别提供了新的借鉴。二是某些细菌在安曲环节并未检出但在后续发酵过程中检出,例如可培养细菌Bacillus subtilis,Virgibacillus necropolis 等,未培养检测中安曲阶段丰度为零,但在后续发酵过程检出,有的甚至在某一阶段形成绝对优势,例如Psychrobacter 在白曲拆曲,norank_Bacteria 在黑曲一次翻曲,这部分细菌的来源及其作用,有进一步研究的价值。
物种相关性分析结果表明,大部分细菌之间存在正相关关系,少部分细菌之间存在负相关关系,发酵过程中微生物间存在的共生、竞争及拮抗等关系,形成了复杂的相互调控机制控制着微生物间的此消彼长,而冗余分析则进一步揭示了理化因子对不同大曲细菌结构的重要影响:黄曲发酵结束时的绝对优势细菌Kroppenstedtia 与水分呈强负相关;Bacillus 在白曲前两个发酵阶段都作为优势菌存在,该菌与糖化力呈正相关,这可能是导致白曲糖化力较高的原因;而黑曲发酵后期的优势细菌Thermoactinomyces 则与酸度呈正相关,与水分呈负相关。最新研究表明,理化性质和代谢图谱可明确区分3 种不同类型的高温大曲[28],在此基础上,以该类研究为参考,结合代谢组学技术明晰发酵过程微生物菌群与发酵环境、代谢产物的关系,进一步明晰3 种高温大曲形成的驱动因素,保证不同曲种的产量和质量奠定理论基础是今后的主要研究方向。
