桑葚玫瑰果酒发酵工艺优化及体外抗氧化活性测定
2023-11-20吴均吴俊葶黄传书黄越赵珮宋长贵王晓静马婧秋
吴均,吴俊葶,黄传书,黄越*,赵珮,宋长贵,王晓静,马婧秋
(1.重庆市蚕业科学技术研究院,重庆 400700;2.中国人民解放军陆军勤务学院,重庆 401331)
桑葚又名桑椹、乌葚、桑果、桑实等,无外表皮,不耐贮藏,易霉变,目前主要以鲜食为主,其他加工产品有桑葚汁、桑葚粉、桑葚干、桑葚膏、桑葚醋、桑葚酵素、桑葚酒等[1-5],营养丰富,具有抗氧化、抗衰老、抑制动脉粥样硬化和降血糖等多种生理活性功能[6-9]。
玫瑰又称赤蔷薇、徘徊花、穿心玫瑰、笔头花、湖花、刺玫花等,是蔷薇科多年生落叶灌木植物[10-11]。玫瑰花目前主要以观赏和制作产品为主,比如玫瑰酱、玫瑰花茶、玫瑰花酵素、玫瑰精油、玫瑰浴盐、玫瑰花露等[12-16],营养丰富,具有抗氧化、抗衰老、抗肿瘤、抑菌、降血糖、降血脂等多种生理活性功能[17-19],能够疏肝解郁、理气活血、缓解疲劳、美容养颜、治疗月经不调、便秘等[20-22]。
近年来,温和低度具有保健功能的发酵果酒越来越受到消费者的喜爱,原汁发酵果酒不仅保留了大部分营养成分,还生成了有利于身体生长发育的醇类物质和次级代谢产物[23]。目前,关于桑葚玫瑰果酒的研究较少,将桑葚和玫瑰这两种材料复配开发出新的果酒产品既能融合桑葚和玫瑰的花香果香风味,又能使它们的营养价值和功能活性叠加,极大地满足人们的消费需求。因此,本试验以桑葚和玫瑰花瓣为研究对象,按一定比例将其混合发酵,进行单因素和响应面试验,得到桑葚玫瑰果酒的最佳发酵工艺,并测定其微生物、功能成分和抗氧化能力,以期为提高桑葚玫瑰果酒品质提供参考和科学依据。
1 材料与方法
1.1 材料与试剂
桑葚(紫金6 号):重庆市蚕业科学技术研究院;玫瑰(平阴1 号):重庆市璧山区基诚花卉苗木股份合作社;白砂糖(食品级):南京甘汁园股份有限公司;果胶酶(10 万U/g)、无水柠檬酸(食品级):河南万邦实业有限公司;RW 酵母:安琪酵母股份有限公司;焦亚硫酸钾(食品级):山东齐鲁生物科技集团有限公司;浓盐酸(分析纯):国药集团化学试剂有限公司;氢氧化钠、硝酸铝、乙醇、碳酸钠、乙酸钠、硝酸钠(均为分析纯):成都市科隆化学品有限公司;VC(分析纯)、芦丁(标准对照品):北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(分析纯):合肥博美生物科技有限责任公司;没食子酸、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS](均为分析纯):上海麦克林生化科技有限公司;福林酚(分析纯):上海源叶生物科技有限公司。
1.2 仪器与设备
S7 破壁机:广州市祈和电器有限公司;HPX-Ⅱ-400 生化培养箱:上海跃进医疗器械有限公司;H200原汁机:上海韩惠人爱家电科技有限公司;LDZH-100KBS 高压灭菌锅:上海申安医疗器械厂;PHS-3C pH 计:上海雷磁仪器厂;HH-S8A 恒温水浴锅:北京科伟永兴仪器有限公司;PAL-α 折光仪、PAL-33 酒精计:日本爱拓公司;ULTRA-3600 紫外可见光分光光度计:北京普源精电科技有限公司。
1.3 方法
1.3.1 果酒制作工艺
桑葚→解冻→榨汁→酶解→灭酶→过滤→添加破碎玫瑰花瓣→匀浆→调节pH 值→调节糖度→添加偏重亚硫酸钾→接种酵母→发酵→过滤→装瓶→灭菌→果酒。
1.3.2 操作要点
原料挑选:挑选颗粒饱满、无腐烂变质,成熟度高的紫金6 号桑葚作为原料;挑选花瓣完整,颜色鲜艳,无病虫害的平阴1 号玫瑰作为原料。
果汁调整:桑葚解冻后经原汁机压榨得到果汁,加入0.1%的果胶酶进行酶解,过滤后加入一定质量比的玫瑰花瓣,用破壁机使其破碎混合均匀,添加柠檬酸和白砂糖调整原浆pH 值和糖度,添加偏重亚硫酸钾进行杀菌。
酵母活化:将干酵母与5%的葡萄糖溶液按一定比例混合均匀,37 ℃水浴锅放置30 min,备用[24]。
发酵:将调整好的桑葚玫瑰混合物装入高压灭菌后的三角瓶,24 ℃培养箱发酵,每天固定时间摇匀发酵液,发酵前4 d 发酵瓶中有大量泡沫,发酵第7 天泡沫消失液体澄清,发酵接近终点。
1.3.3 桑葚汁与玫瑰质量比的确定
将桑葚汁与玫瑰质量比设置为2∶1、3∶1、4∶1、5∶1、6∶1,添加偏重亚硫酸钾将SO2浓度调整为100 mg/L,固定初始糖度25 °Bx,pH3.8,酵母接种量40 mg/L,发酵温度24 ℃,发酵8 d,测定感官评分、花色苷含量和酒精度。
1.3.4 桑葚玫瑰果酒发酵工艺单因素试验
桑葚汁与玫瑰质量比固定为4∶1,在初始糖度分别为21、23、25、27、29 °Bx,发酵时间分别为6、7、8、9、10 d,酵母接种量分别为20、30、40、50、60 mg/L,发酵温度分别为20、22、24、26、28 ℃,初始pH 值分别为3.4、3.6、3.8、4.0、4.2,SO2浓度分别为60、80、100、120、140 mg/L条件下发酵桑葚玫瑰果酒,考察初始糖度、发酵时间、酵母接种量、发酵温度、初始pH 值、SO2浓度对桑葚玫瑰果酒花色苷含量和酒精度的影响。
1.3.5 响应面试验优化桑葚玫瑰果酒发酵工艺
在单因素试验结果的基础上,以初始糖度(A)、酵母接种量(B)和发酵时间(C)为考察变量,以花色苷含量为响应值,采用三因素三水平的响应面法进行优化,因素水平设计见表1。
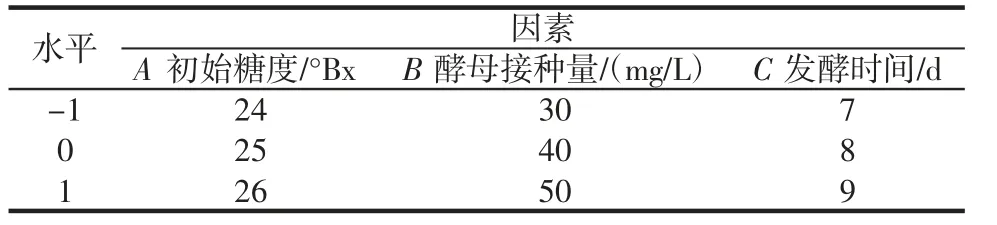
表1 Box-Behnken 设计试验因素水平及编码Table 1 Levels and codes of variables for Box-Benhnken design
1.3.6 桑葚玫瑰果酒抗氧化能力测定
1.3.6.1 DPPH 自由基清除率
分别取10、20、30、40、50、60、70 μL 桑葚玫瑰果酒于试管中,无水乙醇补充至4 mL,加入0.2 mmol/L DPPH 溶液4 mL,混匀后避光放置30 min,以无水乙醇为空白,于517 nm 处测定吸光度;以6 mg/mL 的VC作为阳性对照[25]。DPPH 自由基清除率计算公式如下。
式中:S 为DPPH 自由基清除率,%;A0为DPPH溶液的吸光度;Ai为DPPH 溶液与样品混合溶液的吸光度;Aj为样品的吸光度。
1.3.6.2 ABTS+自由基清除率
分别取3、4、5、6、7、8、9 μL 样品于试管中,添加无水乙醇补充至0.2 mL,加入6 mL ABTS 工作液,混合均匀后避光反应30 min,以无水乙醇为空白对照,于734 nm处测定吸光度;以30 mg/mL 的VC作阳性对照[26]。ABTS+自由基清除率计算公式如下。
式中:H 为ABTS+自由基清除率,%;A0为ABTS 溶液与无水乙醇混合溶液的吸光度;Ai为ABTS 与样品混合溶液的吸光度;Aj为样品与无水乙醇混合溶液的吸光度。
1.3.7 指标测定
菌落总数:参照GB 4789.2—2022《食品安全国家标准食品微生物检验菌落总数测定》的方法进行测定;大肠菌群:参照GB 4789.3—2016《食品安全国家标准食品微生物检验大肠菌群计数》的方法进行测定;沙门氏菌:参照GB 4789.4—2016《食品安全国家标准食品微生物检验沙门氏菌检验》的方法进行测定;金黄色葡萄球菌:参照GB 4789.10—2016《食品安全国家标准食品微生物检验金黄色葡萄球菌检验》的方法进行测定;酒精度:蒸馏后用酒精计测定;花色苷含量:采用pH 值示差法进行测定[27];总糖含量:采用蒽酮硫酸法进行测定[28];总酚含量:采用Folin-Ciocaileu 法进行测定[29];黄酮:采用比色法进行测定[30]。
1.3.8 桑葚玫瑰果酒的感官评定
桑葚玫瑰果酒的感官评定标准见表2。
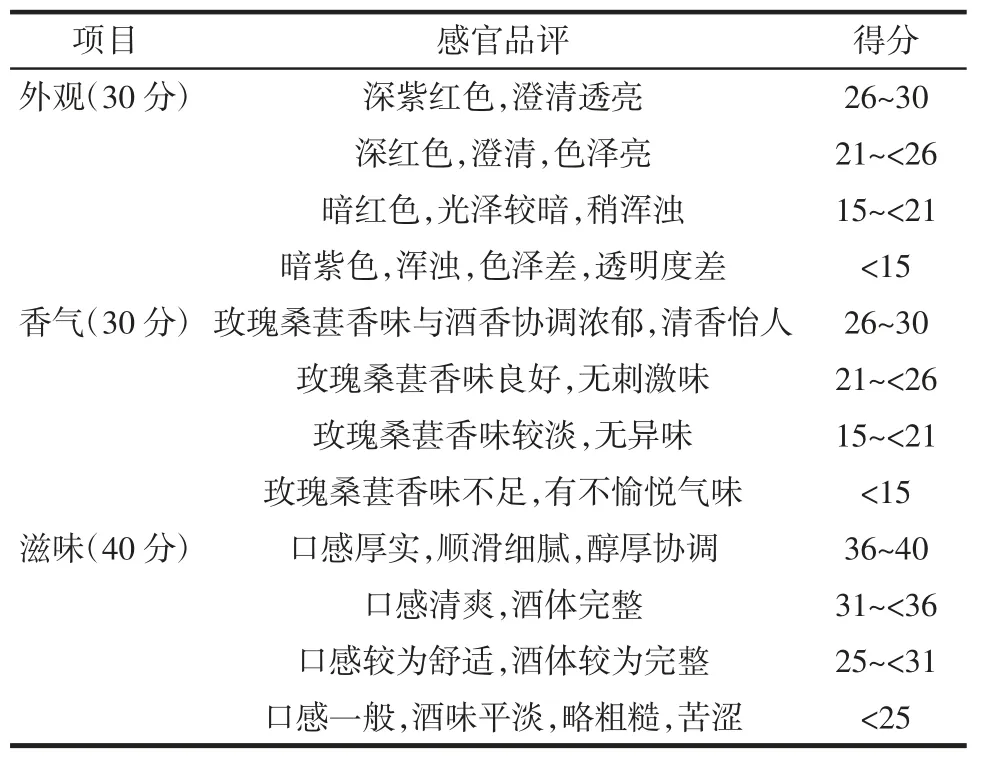
表2 感官评定标准Table 2 The sensory evaluation criteria
1.4 数据处理
每组试验重复3 次,使用Design-Expert 8.0.6.1 进行响应面设计及分析,Origin 9.0 进行数据处理并画图。
2 结果与分析
2.1 桑葚汁与玫瑰质量比
桑葚汁与玫瑰质量比对花色苷含量、酒精度和感官评分的影响见图1。

图1 不同桑葚汁与玫瑰质量比对花色苷含量、酒精度和感官评分的影响Fig.1 Effects of different mass ratios of mulberry and rose on anthocyanin,alcohol content,and sensory score
由图1 可知,桑葚汁与玫瑰质量比对酒精度的影响不大;花色苷含量随着桑葚汁添加量的增加而降低,可能是由于玫瑰的花色苷含量高于桑葚,玫瑰添加量降低花色苷的含量随之降低。感官评分随着桑葚汁添加量的增加先升高后降低,当桑葚汁与玫瑰质量比达到4∶1 时感官评分达到最大值93.02,桑葚汁添加量较低时,玫瑰中所含的单宁物质使果酒偏苦涩,玫瑰花香浓郁而掩盖了桑葚的果香,从而影响感官评分;桑葚汁添加量较高时,玫瑰含量较少花香不明显。因此,桑葚汁与玫瑰最佳质量比为4∶1。
2.2 单因素试验结果
2.2.1 初始糖度
初始糖度对桑葚玫瑰果酒品质的影响见图2。
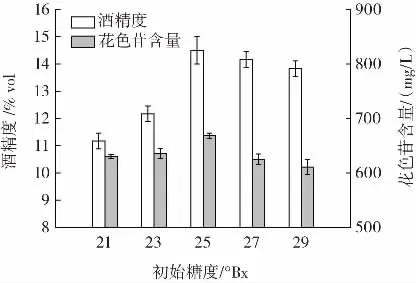
图2 初始糖度对桑葚玫瑰果酒品质的影响Fig.2 Effects of initial sugar concentration on the quality of mulberry rose wine
由图2 可知,随着初始糖度的不断增加,花色苷含量和酒精度呈现先升高后降低的变化趋势。初始糖度为25 °Bx时二者均达到最大值。当初始糖度小于25 °Bx时,糖主要用于酵母的生长繁殖,而用于果酒发酵的糖量不足,使得果酒的酒精度较低;当初始糖度大于25 °Bx时,高渗透压抑制了酵母的活性,发酵速率降低使得发酵不完全而酒精较低残糖量较高。因此,选择初始糖度为24、25、26 °Bx进行后续试验。
2.2.2 发酵时间
发酵时间对桑葚玫瑰果酒品质的影响见图3。
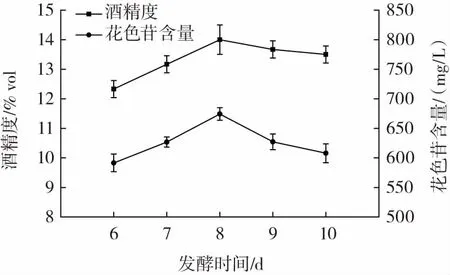
图3 发酵时间对桑葚玫瑰果酒品质的影响Fig.3 Effects of fermentation time on the quality of mulberry rose wine
由图3 可知,随着发酵时间的不断延长,花色苷含量和酒精度均呈现先升高后降低的变化趋势。发酵到第8 天时酒精度和花色苷含量均达到最大值,分别为14% vol 和674.38 mg/L,当发酵时间小于8 d 时,随着发酵时间的延长酒精度不断增加,花色苷不断溶出积累;当发酵时间大于8 d 时,酵母活性降低,发酵能力下降,酒精度降低,同时β-葡萄糖苷酶会分解糖苷键,造成花色苷不稳定而不断分解[31]。因此,选择发酵时间为7、8、9 d 进行后续试验。
2.2.3 酵母接种量
酵母接种量对桑葚玫瑰果酒品质的影响见图4。
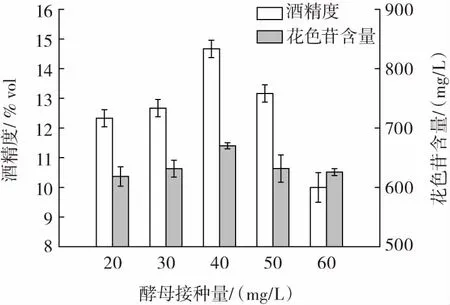
图4 酵母接种量对桑葚玫瑰果酒品质的影响Fig.4 Effects of yeast inoculation amount on the quality of mulberry rose wine
由图4 可知,随酵母接种量的不断增加,花色苷含量和酒精度呈现先增加后降低的变化趋势。酵母接种量为40 mg/L 时,桑葚玫瑰果酒的花色苷含量和酒精度均达到最大值。当酵母接种量小于40 mg/L 时,酵母数量较少,桑葚玫瑰发酵不彻底,酒精度低,花色苷溶出较少,从而使酒精度和花色苷含量较低;当酵母接种量大于40 mg/L 时,酵母大量生长繁殖,用于发酵的糖量减少,产生的代谢物质过多又抑制了酒精的转化,并且酒体中的花色苷吸附于酵母细胞壁,从而使桑葚玫瑰果酒酒精度和花色苷含量较低[32]。因此,选择酵母接种量为30、40、50 mg/L 进行后续试验。
2.2.4 发酵温度
发酵温度对桑葚玫瑰果酒品质的影响见图5。
由图5 可知,随着发酵温度的不断升高,花色苷含量和酒精度均呈现先增加后减小的变化趋势。发酵温度为24 ℃时,花色苷含量和酒精度均达到最大值;当发酵温度低于24 ℃时,酵母生长繁殖速度缓慢,酶活力较低,酒精积累不足,花色苷溶出较少[33];当发酵温度高于24 ℃时,酵母生长繁殖过于迅速,大量消耗糖,酒精度较低,提前衰老产生大量副产物影响果酒风味,同时高温会加快花色苷的分解。因此,桑葚玫瑰果酒最佳的发酵温度为24 ℃。
2.2.5 初始pH 值
初始pH 值对桑葚玫瑰果酒品质的影响见图6。
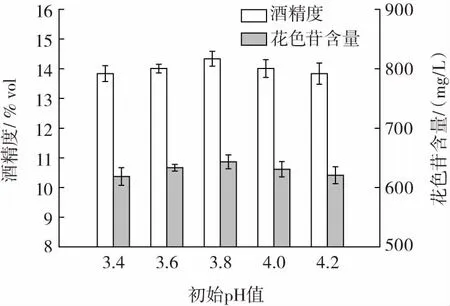
图6 初始pH 值对桑葚玫瑰果酒品质的影响Fig.6 Effects of initial pH on the quality of mulberry rose wine
由图6 可知,随着初始pH 值的不断增加,花色苷含量和酒精度呈现先增加后降低的变化趋势。初始pH值为3.8 时,花色苷含量和酒精度达到最大值。初始pH 值小于3.8 时,酵母的生长繁殖缓慢,酒精累积少,花色苷溶出较少;初始pH 值大于3.8 时,抑制了酵母的生长繁殖,酒精度低,花色苷不断分解。因此,桑葚玫瑰果酒最佳的初始pH 值为3.8。
2.2.6 SO2浓度
SO2浓度对桑葚玫瑰果酒品质的影响见图7。
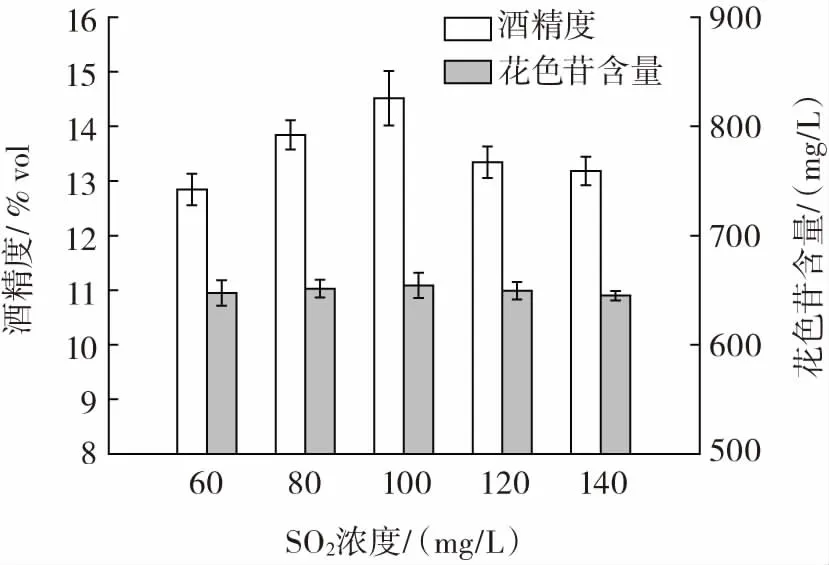
图7 SO2 浓度对桑葚玫瑰果酒品质的影响Fig.7 Effects of sulfur dioxide concentration on the quality of mulberry rose wine
研究表明,SO2具有抑菌、护色、澄清酒体和抗氧化的作用,能够提高果酒的品质。由图7 可知,SO2浓度对桑葚玫瑰果酒花色苷含量影响不明显;桑葚玫瑰果酒的酒精度随着SO2浓度的增加先升高后降低,SO2浓度为100 mg/L 时酒精度达到最大值。当SO2浓度小于100 mg/L 时,杂菌生长速度快,酵母生长和发酵受到抑制,发酵不完全而酒精度较低;当SO2浓度大于100 mg/L时,桑葚玫瑰发酵液中的酸度上升,酵母生长和发酵缓慢[34-35]。因此,桑葚玫瑰果酒最佳的SO2浓度为100 mg/L。
2.3 响应面试验
2.3.1 响应面试验设计与结果
Box-Behnken 试验设计方案及结果见表3,方差分析见表4。
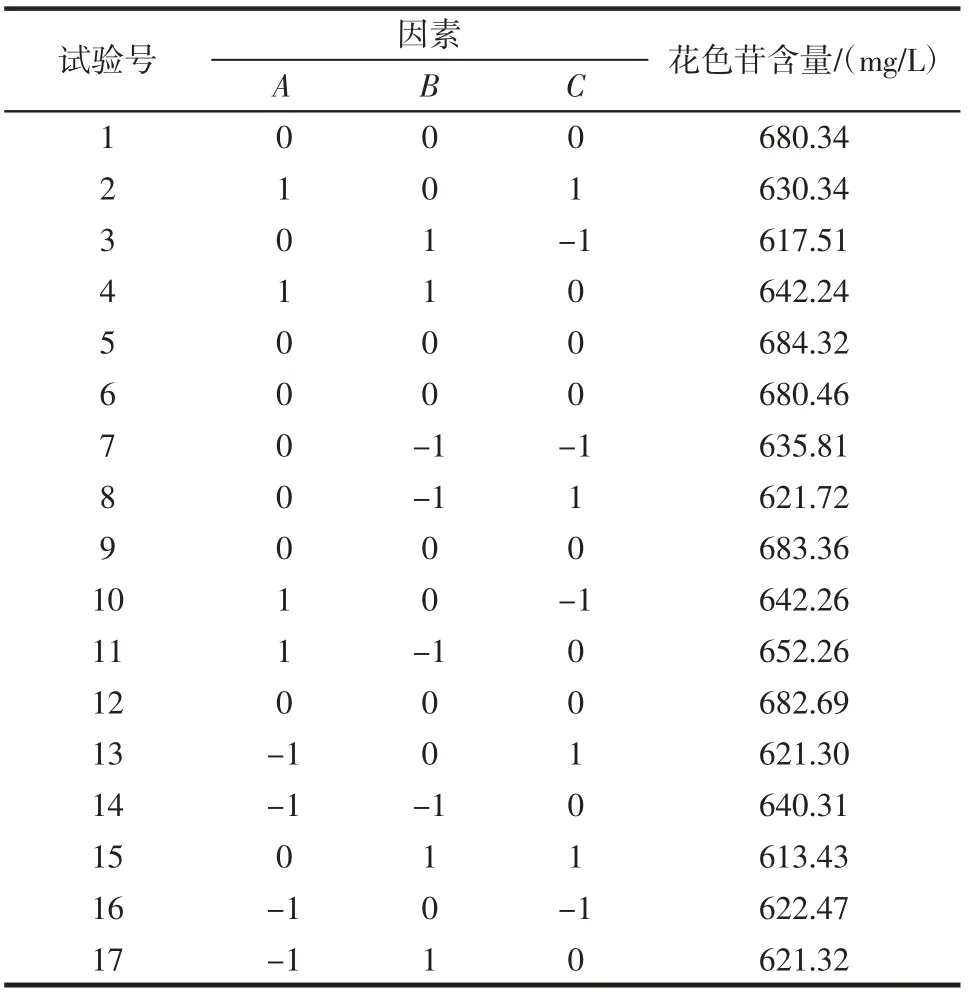
表3 Box-Behnken 试验设计方案及结果Table 3 Results of Box-Behnken central composite design
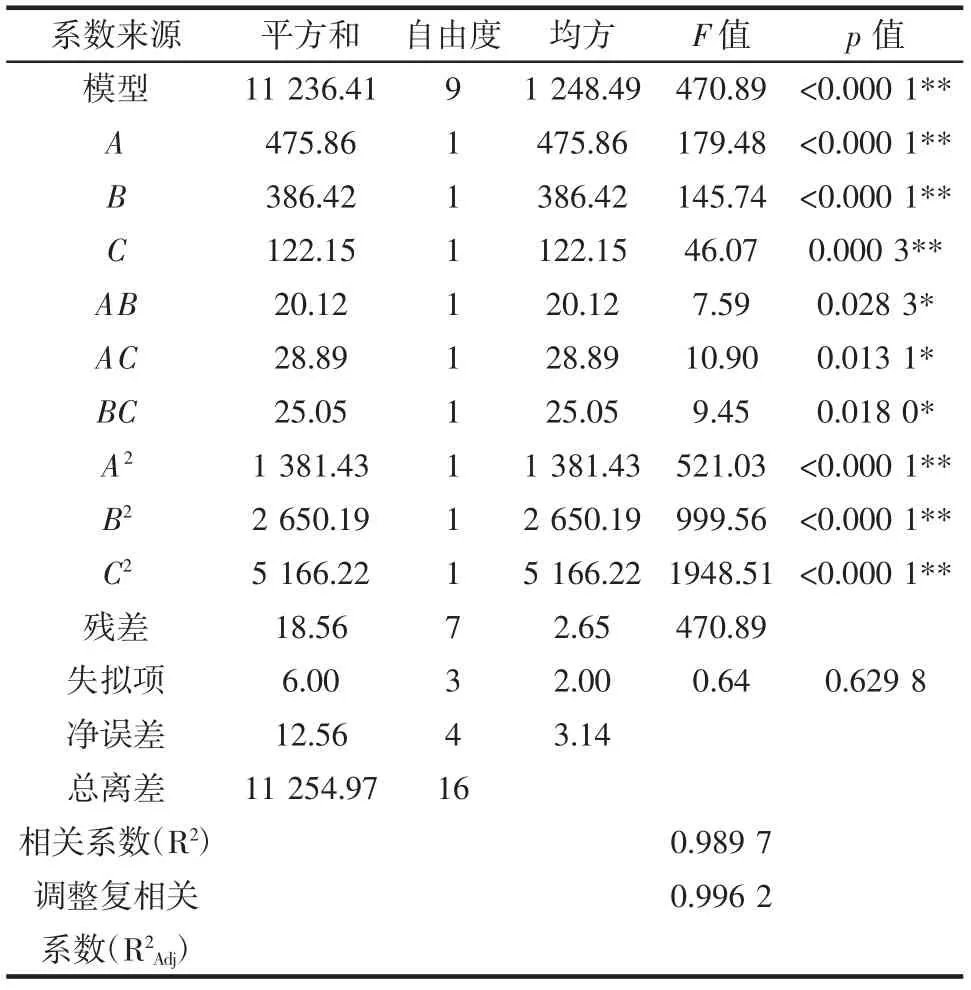
表4 方差分析Table 4 Analysis of variance
根据软件预测得到二元多次回归方程:花色苷含量=682.23 +7.71A-6.95B-3.91C +2.24AB-2.69AC +2.550BC-18.11A2-25.09B2-35.03C2。
由表4 可知,该模型p<0.000 1,极显著,失拟项p=0.629 8>0.05,不显著,说明该模型拟合度较好。一次项A、B、C、二次项A2、B2、C2对桑葚玫瑰果酒花色苷含量的影响均为极显著(p<0.01),交互项AB、AC、BC 对桑葚玫瑰果酒花色苷含量的影响均为显著(p<0.05),R2=0.989 7,R2Adj=0.996 2,说明模型预测的花色苷含量与试验的花色苷含量相关性好,拟合度较好,能很好地反映花色苷含量与它们三者之间的关系。根据F 值可知,影响桑葚玫瑰果酒花色苷含量的各因素大小顺序为初始糖度(A)>酵母接种量(B)>发酵时间(C)。
2.3.2 响应面交互作用
各因素交互作用对花色苷含量影响见图8。
由图8 可以看出,AB、AC、BC 等高线呈椭圆形,较为陡峭,说明初始糖度、发酵时间和酵母添加量之间的两两交互作用对花色苷含量的影响显著。
通过响应面软件分析,在发酵时间7.93 d,初始糖度25.21 °Bx,酵母接种量38.68 mg/L 的条件下,桑葚玫瑰果酒花色苷含量的预测值为683.64 mg/L;为了方便操作,将发酵条件调整为发酵时间8 d,初始糖度25.2 °Bx,酵母接种量39 mg/L,在此条件下进行3 次重复试验,测定桑葚玫瑰果酒花色苷的含量为679.24 mg/L,真实值与预测值相符度高,说明该工艺可行。
2.4 桑葚玫瑰果酒抗氧化能力的测定
2.4.1 DPPH 自由基清除能力
桑葚玫瑰果酒对DPPH 自由基的清除能力见图9。

图9 桑葚玫瑰果酒对DPPH 自由基的清除能力Fig.9 Scavenging ability of mulberry rose wine on DPPH free radical wine
由图9 可知,桑葚玫瑰果酒对DPPH 自由基的清除能力大于VC。桑葚玫瑰果酒和VC的DPPH 自由基清除率随着样品体积的增加呈现先增加后趋于平稳的趋势,当样品体积达到50 μL 时,桑葚玫瑰果酒和VC的DPPH 自由基清除率达到98.23%和95.58%。
2.4.2 ABTS+自由基清除能力
桑葚玫瑰果酒对ABTS+自由基的清除能力见图10。
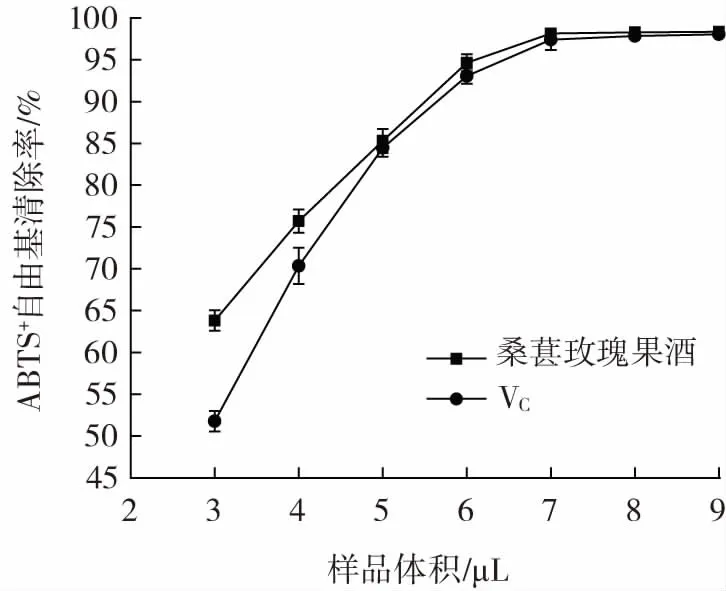
图10 桑葚玫瑰果酒对ABTS+自由基的清除能力Fig.10 Scavenging ability of mulberry rose wine on ABTS+ free radical
由图10 可知,桑葚玫瑰果酒对ABTS+自由基的清除能力大于VC。桑葚玫瑰果酒的ABTS+自由基清除率随着样品体积的增加呈现先增加后趋于平稳的趋势。当样品体积达到7 μL 时,桑葚玫瑰果酒和VC的ABTS+自由基清除率分别达到98.15%和97.42%。
2.5 桑葚玫瑰果酒品质分析
其各项指标测定结果如表5 所示。
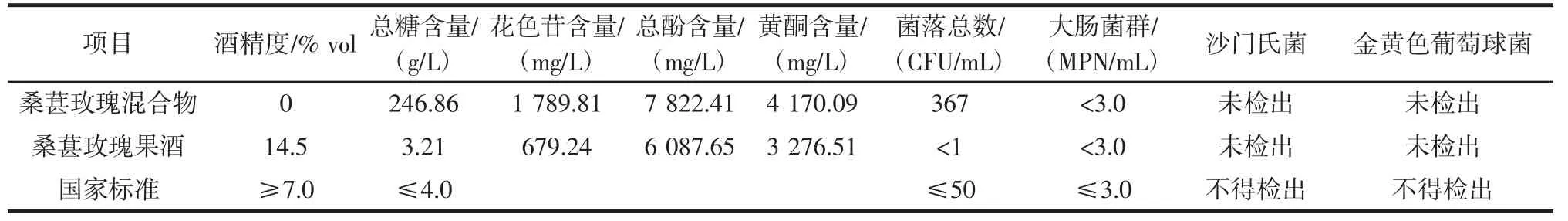
表5 桑葚玫瑰果酒发酵前后各指标分析Table 5 Analysis of indexes of mulberry rose wine before and after fermentation
最佳工艺条件发酵得到的桑葚玫瑰果酒口感柔和,呈透明紫红色,酒香浓郁,带有桑葚和玫瑰的花果香味,发酵前后总糖含量、花色苷含量、总酚含量、黄酮含量均有所下降,酒精度、总糖和微生物各项指标均符合国家标准。
3 结论
通过单因素和响应面试验得到桑葚玫瑰果酒的最佳发酵工艺条件为初始糖度25.2 °Bx、酵母接种量39 mg/L、发酵时间8 d。在此条件下,桑葚玫瑰果酒花色苷含量为679.24 mg/L,黄酮含量为3 276.51 mg/L,总酚含量为6 087.65 mg/L,酒精度为14.5% vol,总糖含量为3.21 g/L,微生物指标达到国家标准。50 μL 桑葚玫瑰果酒的DPPH 自由基清除率为98.23%,7 μL 桑葚玫瑰果酒的ABTS+自由基清除率为98.15%。桑葚玫瑰果酒是一种抗氧化能力较强的功能型花果酒,本研究为开发桑葚玫瑰复合产品提供了新思路,对桑葚玫瑰果酒的开发具有指导意义。
