超微粉碎预处理对碱提和水提麦麸多糖理化特性的影响
2023-11-20王乐姣岳陈林瑞杨林伟陈银基
王 缓,王乐姣,岳陈林瑞,罗 程,祝 媛,杨林伟,张 涛,,李 超,,陈银基
(1.南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心,江苏南京 210023;2.雨润集团肉品加工与质量控制国家重点实验室,江苏南京 210041)
小麦麸皮是小麦籽粒的糊粉层及外皮层,是小麦谷脱粒或磨粉加工后的残留物,约占小麦颗粒的20%~25%[1]。而多糖是小麦麸皮的重要活性成分,主要由淀粉多糖与非淀粉多糖组成,具有预防肥胖、糖尿病,防治结肠癌、降血糖、降血脂、抗肿瘤,提高免疫力等生理活性[2]。此外,我国是粮食生产与消费大国,仅2022 年小麦产量高达1.38 亿吨[3],麸皮产量约三千万吨。但麸皮中膳食纤维口感粗糙、不易被人体消化吸收且加工条件差,消费者难以接受,造成其在食品领域得不到广泛应用[4]。目前的应用方法仅限于饲料、酿造等行业,经济价值较低。附加值尚未能得到充分开发,市场上关于麦麸的产品也很少见[5]。因此,小麦麸皮的利用不仅可以提高麦麸副产物的综合利用价值,还可以创造经济效益,对农业增效和农民增收都具有重要的意义。
对麦麸多糖的提取利用已经研发出各种物理、化学和生物提取方法,包括热水浸提法[6]、酸碱浸提法[7]和酶解法[8]。每种方法在工艺复杂性、时间和材料成本以及食品安全和环境影响方面都有其独特的优点和缺点。麦麸多糖由于其相互作用及与细胞壁其他成分之间相互作用较强,水法得率很低,碱法提取量也有限,为了进一步释放有效成分,也为了提高麦麸多糖的得率,释放细胞壁中多糖[9],通常会采用一些辅助技术,包括微波辅助[10]、超微粉碎辅助[11]及超声辅助提取[12]等。而超微粉碎技术是一种将材料研磨成微米甚至纳米级的新型食品加工和改性方法[13],通过物理的机械剪切挤压方式来破坏物料内部凝聚力,从而使物料粒径极大地减小[14]。其最大的特点是在密闭的环境中迅速将物料研磨成颗粒均匀的超细粉,最大可能降低物料中有机营养成分的损失和破坏,实现原材料最大化利用[15]。它可以改善物料粉体的口感和理化特性,增大粉体的比表面积和孔隙率,使其具有更好的分散性、溶解性和吸附性[16]。寇福兵[11]采用球磨超微粉碎(BMSG)和气流超微粉碎(JSG)两种技术分别对板栗进行超微粉碎预处理,并添加到面团及面条中,实验结果表明,经过超微粉碎处理后,板栗粉亮度和溶解度增加,粒径分别降低为7.42±0.03、7.08±0.04 μm。同时,蛋白质、可溶性膳食纤维及淀粉等营养成分含量得到显著提高。
为了提高麦麸多糖的得率及释放更多活性成分。本实验以麦麸原料为研究对象,通过采用不同超微粉碎预处理时间,并与普通粉碎预处理进行比较,研究超微粉碎对麦麸多糖理化特性(得率、化学组成、红外光谱、电位、粒径、溶解度、微观结构及单糖组成)的影响,以期获得高得率、高含量的麦麸多糖,进而扩大麦麸副产物的应用范围,为麦麸高值化、深加工应用中提供参考依据。
1 材料与方法
1.1 材料与仪器
麦麸粉(烟农19)2022 年3 月购自安徽皖丰种业有限公司;糖化酶 10 万 U/g,博立生物制品有限公司;中温蛋白酶 110 万 U/g,仰韶生物科技有限公司;α-高温淀粉酶 5 万 U/g,山东隆科特酶制剂有限公司;β-葡聚糖酶 5 万 U/g,和氏璧生物科技有限公司;NaOH 分析纯,广东光华科技有限公司;盐酸、硫酸 分析纯,南京化学试剂有限公司;无水乙醇 分析纯,无锡市亚盛化工有限公司;间苯三酚、溴化钾 分析纯,上海麦克林生化科技有限公司;牛血清蛋白、甘氨酸、考马斯亮蓝G-20 分析纯,北京索莱宝科技有限公司;苯酚、葡萄糖 分析纯,西陇化工股份有限公司;甲醇、双氧水 分析纯,国药集团化学试剂有限公司;磷酸 分析纯,天津市科密欧化学试剂有限公司。
FW110 型高速万能粉碎机 天津泰斯特仪器有限公司;TYM100 型超微粉碎机 济南天宇专用设备有限公司;BLUEWAVE 型激光粒度仪 量子科学仪器贸易(北京)有限公司;UV-6100 型紫外分光光度计 上海美普达仪器有限公司;马尔文激光粒度分析仪 英国Malvern 有限公司;PE SP2 型傅里叶红外光谱仪 天津博天盛达科技有限公司;Heidolph Advangtage 旋转蒸发仪 上海合臣科技有限公司;TM 3000 型扫描电镜 苏州赛恩斯仪器有限公司;Thermo ICS5000 型离子交换色谱 上海硅仪生化科技有限公司;FreeZone 12 L 真空冷冻干燥机 美国Labconco 公司。
1.2 实验方法
1.2.1 实验材料的制备
1.2.1.1 麦麸粗粉制备 根据参考文献[17],略作调整,原料麦麸置于烘箱中干燥处理1.5 h 至恒重,冷却至室温后置于万能粉碎机中粉碎5 min 后过100目筛,得到样品,记为超微粉碎0 min。
1.2.1.2 超微粉的制备 根据参考文献[17],略作调整,将超微粉碎0 min 的麦麸粗粉分别置于超微粉碎机(960 r/min,1100 W)分别粉碎10、20、30 min 。获得均一稳定的麦麸超微粉,样品分别记为超微粉碎10、20、30 min。
1.2.1.3 碱提法制备麦麸多糖 根据文献[18],将上述抽滤得到的沉淀,烘箱干燥后,按固液比1:10 g/mL,加入含过氧化氢(0.5%)的碱性NaOH 溶液(pH11.5),室温下搅拌反应4 h,然后使用4.0 mol/L 盐酸溶液调节pH 至7.00。离心(5000 r/min,30 min)得到上清液,并使用4.0 mol/L盐酸溶液调节pH 至4.00,添加0.5%β-葡聚糖酶,40 ℃保持20 min,然后,升温至100 ℃,保持20 min,进行处理;最后冷却至室温,将悬浮液置于旋转蒸发仪进行浓缩,缓慢加入无水乙醇溶液并不断搅拌,使乙醇体积分数为65%,4 ℃搅拌10 h 后离心(5000 r/min,15 min),得到沉淀复溶于水并搅拌,再次离心(5000 r/min,5 min),重复上述碱法提取工艺,所得上清液进行冷冻干燥即为碱提麦麸多糖。
1.2.1.4 水提法制备麦麸多糖 参照苏东民等[18]方法,按m(麦麸粉):v(水)=1:7 制备小麦麸皮悬浮液,用磁力搅拌器搅1 h 以到充分溶解,并在水浴锅中加热至75 ℃;加入耐高温2%α-淀粉酶,并搅拌均匀,升温至90 ℃,保持30 min,冷至室温;加0.1% 中性蛋白酶,并搅拌均匀,55 ℃保持4 h;最后,升温至100 ℃,保持20 min,进行灭酶处理;冷至室温后,用布氏漏斗抽滤,将布氏漏斗抽滤后得到的溶液,离心(5000 r/min,15 min)得到上清液,以4.0 mol/L 的盐酸调节上清液的pH 至4.8;加入0.3%糖化酶,60 ℃保持10 h,然后加热至100 ℃,保持20 min,进行灭酶处理;加入2% 硅胶粉并调节pH 至4.60±0.20,室温混30 min,除去悬浮液中残留蛋白质。将悬浮液离心(5000 r/min,15 min),得上清液。将悬浮液置于旋转蒸发仪进行浓缩,将所得上清液进行冷冻干燥即为水提麦麸多糖。
1.2.2 麦麸粉粒径测定 根据文献[19]略作修改,取适量处理后麦麸粉分散于蒸馏水中,倒入激光粒度仪进样器中,测量样品的粒径。
1.2.3 麦麸多糖得率计算 麦麸多糖得率计算的公式为:
式中:M1为麦麸多糖质量,g;M2为麦麸粉末质量,g。
1.2.4 麦麸多糖化学组成分析 阿拉伯木聚糖(AX)含量测定(间苯三酚法):参考Douglas 等[20]的方法,取20 mg 麦麸多糖、110 mL 冰醋酸、2 mL 浓盐酸、5 mL 20%间苯三酚-乙醇溶液及1 mL 1.75%葡萄糖水溶液于具塞比色管中,沸水浴反应30 min,期间振荡两次,反应结束用冰水浴冷却5 min 终止反应,为消除己糖的影响,用紫外分光光度计分别在552 nm与510 nm 处测吸光值,并计算差值。其中标准曲线如下:
蛋白质含量测定(考马斯亮蓝法):参考Bradford 法[21],取10 mg 麦麸多糖、0.5 mg 考马斯亮蓝G-250、0.25 mL 95%乙醇、0.6 mL 85%磷酸于具塞比色管中,振荡混匀,室温放置2 min 后,用分光光度计595 nm 处测吸光度值。其中标准曲线如下:
总糖含量测定(苯酚-硫酸法)参考Dubios 等[22]的方法,取50 mg 麦麸多糖、50 mg 葡萄糖、1 mL 6%苯酚、5 mL 浓硫酸,摇匀,室温放置20 min 于490 nm 测吸光值。其中标准曲线如下:
阿魏酸含量(比色法):参考Malunga 等[23]的方法,取1 mg 麦麸多糖、900 μL(pH10,0.04 mol/L)甘氨酸-氢氧化钠缓冲溶液,用涡旋仪混匀,5 min 后测345 和375 nm 处吸光度值,用摩尔吸光系数Ɛ(L/(mol·cm))表示。其中公式如下:
式中:[FA]c为结合阿魏酸含量,μg/g;[FA]f为游离阿魏酸含量,μg/g;Ɛ345为游离阿魏酸在345 nm 处吸光系数,Ɛ345=19662 L/(mol·cm);Ɛ375为游离阿魏酸在375 nm 处吸光系数,Ɛ375=7630 L/(mol·cm);Ɛ'345为结合阿魏酸在345 nm 处吸光系数,Ɛ'345=23064 L/(mol·cm);Ɛ'375为结合阿魏酸在375 nm 处吸光系数,Ɛ'375=31430 L/(mol·cm)。
1.2.5 傅立叶红外变换光谱分析 根据参考文献[24],略作调整,将各组麦麸多糖分别与溴化钾按1:100比例均匀混合,真空压缩成片。利用傅立叶红外光谱仪在4000~400 cm-1范围下扫描样品,每个样品扫描32 次。
1.2.6 粒径及电位测定 根据参考文献[25],略作调整,准确称取麦麸多糖配制成5 mg/mL 麦麸多糖溶液,4000 r/min,离心15 min 取上清,于纳米粒度仪测定溶液中麦麸多糖的粒径及Zeta 电位。
1.2.7 溶解度测定 根据刘慧君[26]方法,略作调整,准确称取一定质量麦麸多糖常温加水配成50 mg/mL,静置30 min,每隔5 min 涡旋振荡10 s,重复操作30 min,取上清液10 mL,冷冻真空干燥,称量干燥后固体质量,溶解度表征为每毫升水中溶解的麦麸多糖质量。
1.2.8 扫描电镜观察 根据参Wang 等[27]方法,略作调整,取适量不同处理组麦麸多糖置于粘有胶带的样品台上,用吸耳球吹拭多余麦麸多糖并使其平铺均匀,将样品台置于真空喷锻仪内进行真空喷金处理,并在扫描电镜放大5000 倍条件下观察麦麸多糖样品形态。
1.2.9 高效离子交换色谱法测定单糖组成 根据参考文献[27],略作调整,取干净的色谱瓶,精确称量多糖样品5 mg(±0.05 mg),加入1 mL 的2 mol/L TFA溶液,121 ℃加热2 h。通氮气,加入甲醇清洗,再吹干,重复甲醇清洗2~3 次。加入无菌水溶解,转入色谱瓶中待测。色谱分析条件:Thermo ICS5000 离子色谱系统,电化学检测器,液相色谱柱:Dionex™CarboPac™ PA20(150×3.0 mm,10 μm);进样量为5 μL。流动相A(0.1 mol/L NaOH),流动相B(0.1 mol/L NaOH,0.2 mol/L NaAc),流速0.5 mL/min;柱温为30 ℃;洗脱梯度:0 min A 相/B 相(95:5,V/V),30 min A 相/B 相(80:20,V/V),30.1 min A 相/B 相(60:40,V/V),45 min A 相/B 相(60:40,V/V),45.1 min A 相/B 相(95:5,V/V),60 min A 相/B 相(95:5,V/V)。
1.3 数据处理
实验数据均重复3 次,实验结果以平均值±标准差表示。采用Origin 2021 软件作图、IBM SPSS Statistics 22.0 软件对数据进行单因素ANOVA 分析,P<0.05 为统计学上显著差异。
2 结果与分析
2.1 超微粉碎对麦麸粉粒径的影响
如图1 所示,由普通粉碎和超微粉碎后的麦麸粉粒径分布可知,超微粉碎后麦麸粉的粒径显著小于对照组超微粉碎0 min,且随着超微粉碎时间的延长,麦麸粉的粒径不断减小。主要由于麦麸粉组织结构的内部凝聚力被超微粉碎机的机械剪切挤压力所破坏,从而使得麦麸粉粒径极大地减小[15]。超微粉碎20 和30 min 粒径分布呈现正态分布,表明超微粉碎技术对麦麸粉粉碎效果明显且粉体的均匀性较好[28]。

图1 不同超微粉碎预处理对麸粉粒径的影响Fig.1 Effects of different ultra-fine grinding pre-treatments on grain size of bran powder
2.2 超微粉碎预处理对麦麸多糖得率的影响
由图2 可知,超微粉碎预处理较对照组超微粉碎0 min 对麦麸多糖得率具有显著影响(P<0.05)。在其他提取条件不变情况下,水提麦麸多糖得率与碱提麦麸多糖得率增加趋势基本一致,由1.34%和6.6%分别增加至6.28%和15.03%,由于超微粉碎技术可以迅速将麦麸粉研磨成粗细均匀的超细粉,增大粉体与溶液的接触面积,从而提高麦麸多糖得率[28]。此外,水提麦麸多糖的得率远低于碱法提取,主要是麦麸多糖与其他非淀粉多糖(纤维素、半纤维素、木质素)是构成小麦各组织细胞壁的主要成分,只有碱液破坏细胞壁的结构后,麦麸多糖才会释放出来[29]。
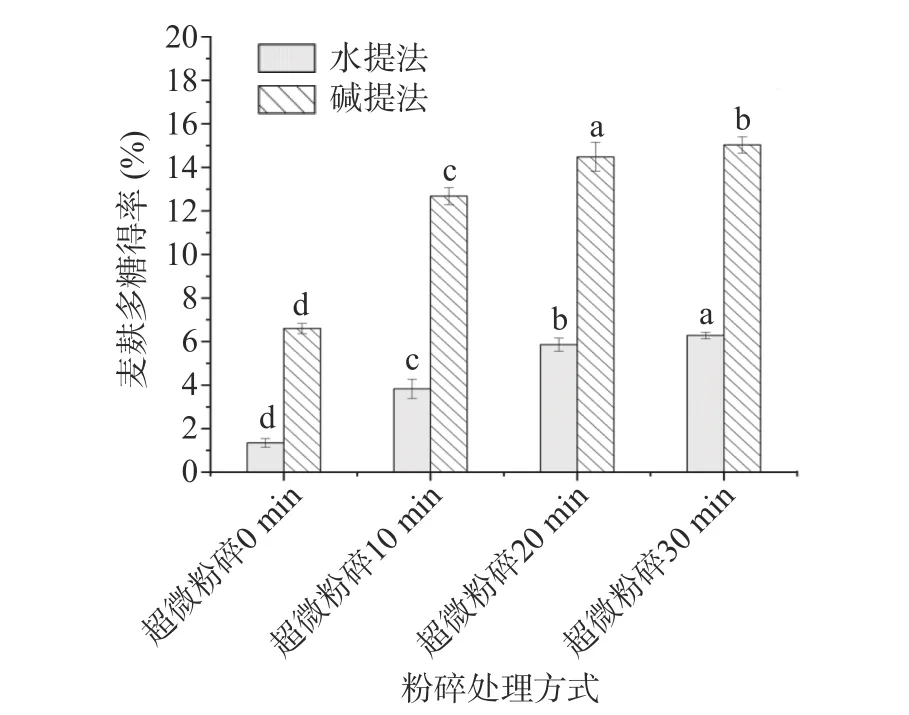
图2 不同超微粉碎预处理对麦麸多糖得率的影响Fig.2 Effects of different ultra-fine grinding pre-treatments on the extraction rate of wheat bran polysaccharides
2.3 超微粉碎预处理对麦麸多糖化学组成的影响
不同粉碎预处理对麦麸多糖基本化学组成影响的结果如表1 及表2 所示,不同粉碎预处理制备得到的麦麸多糖主要由阿拉伯木聚糖(AX)、总糖、蛋白质及阿魏酸构成。两种麦麸多糖AX、总糖含量经超微粉碎预处理后均显著性提高(P<0.05),且两种麦麸多糖AX 含量经过超微粉碎20 min 处理达到最大值。此外,碱提麦麸多糖AX、总糖的含量远高于水提麦麸多糖。这可能是由于超微粉碎处理破坏麦麸粉细胞壁结构,促使多糖分子链断裂,分子间作用力下降,部分多糖尤其是AX 溶出,从而导致总糖含量增加[30]。此外,麦麸多糖中蛋白质含量随超微粉碎时间的增加而不断减小,可能是超微粉碎破坏麦麸粉结构,使细胞壁结构中蛋白质游离出来[31]。不同超微粉碎预处理条件下,水提麦麸多糖中结合型与游离型阿魏酸含量均有显著性差异(P<0.05),而碱提麦麸多糖中结合型与游离型阿魏酸含量却不断减小,可能超微粉碎预处理使麦麸粉颗粒变小,增大其与碱液的接触面积,从而对阿魏酸结构的破坏性更强[29]。

表1 超微粉碎预处理对碱提麦麸多糖化学组成的影响Table 1 Effect of ultrafine pulverization pretreatment on chemical composition of alkali-extracted wheat bran polysaccharides

表2 超微粉碎预处理对水提麦麸多糖化学组成的影响Table 2 Effect of ultrafine pulverization pretreatment on chemical composition of water-extracted wheat bran polysaccharides
2.4 超微粉碎预处理对麦麸多糖红外光谱的影响
不同粉碎预处理的麦麸多糖红外图谱结果如图3 所示,对照图谱分析可知,3600~3200 cm-1波数范围内是糖分子内-OH 伸缩振动峰;3000~2800 cm-1波数范围内是糖类物质C-H 伸缩振动产生的,这两峰共同组成糖类物质特征吸收峰[32]。1650~1500 cm-1是蛋白吸收谱带[9];1400~1200 cm-1为 C-H 的变角振动;1300~1000 cm-1范围是由吡喃糖环上C-O-C、糖苷键和糖醛酸上的C-O 共同产生的;532 cm-1附近的峰是由C-C-O 变形振动产生[33]。由图3(a)所示,对照组超微粉碎0 min 麦麸多糖峰值在1647.76 cm-1处较为尖锐,此处为蛋白质的特征吸收峰,说明对照组超微粉碎0 min 提取的麦麸多糖蛋白质残留量较多[9]。此外,对照组超微粉碎0 min 麦麸多糖峰值在1043.55 cm-1处较为尖锐,表明吡喃糖环上C-O-C、糖苷键和糖醛酸上的C-O 含量较多。由图3(b)不同粉碎处理组间麦麸多糖红外谱图无显著差异,表明超微粉碎预处理对水提麦麸多糖官能团无显著影响。对比图3 水提法与碱提法麦麸多糖的特征吸收峰之间的差异变化,发现二者峰的种类基本一致,但峰的波数随着超微粉碎时间的增加而减小,表明超微粉碎预处理并未改变麦麸多糖的官能团结构,但可以破坏麦麸多糖的有序结构,与牛潇潇等[34]得出超微粉碎处理并未在马铃薯渣中引入新的官能团或新的化合物的结论相一致。由上述分析可知,不同粉碎预处理得到的麦麸多糖均为α、β-D-构型吡喃型杂多糖,且超微粉碎对麦麸多糖的官能团结构影响较小,但可以破坏麦麸多糖的有序结构[35]。

图3 不同超微粉碎预处理对麦麸多糖红外光谱的影响Fig.3 Effect of different ultra-fine grinding pre-treatments on the infrared spectra of wheat bran polysaccharides
2.5 超微粉碎预处理对麦麸多糖溶解度及电位的影响
不同粉碎预处理麦麸多糖的溶解度、Zeta 电位及粒径结果见表3 及表4,不同粉碎预处理组碱法提取麦麸多糖和水法提取麦麸多糖的溶解性总体呈现增加趋势,表明超微粉碎预处理会增加麦麸多糖的溶解性,这是由于麦麸多糖经过超微粉碎预处理后,麦麸多糖的粒径不断减小,比表面积的增大,从而增加麦麸多糖的溶解性[36]。超微粉碎组的麦麸多糖Zeta电位绝对值较对照组超微粉碎0 min 小,且水法提取麦麸多糖Zeta 电位值远小于碱法提取麦麸多糖。两种麦麸多糖溶液的电位绝对值均小于30 mV 且绝对值较对照组超微粉碎0 min 降低,表明超微粉碎预处理后所提取的麦麸多糖粉体间静电排斥力较小,容易发生团聚,造成麦麸多糖溶液稳定性较差,容易产生絮凝[25]。D50代表样品粒径累计分布为50%时所对应的粒径,常用来表示粉体的平均粒径。两种麦麸多糖的粒径随超微粉碎时间的增加而不断减小,说明超微粉碎均可有效地使麦麸多糖的粒径减小,与吴金辉[37]利用超微粉碎技术制备海带膳食纤维得出的粒径结果相一致。分散指数(PDI)可以反映溶液中粒径分布情况,通常,PDI 越大,多糖分子量分布越宽,PDI 越小,分子量分布越均匀。由表4 所示,水法提取麦麸多糖分散系数较大,表明溶液中多糖粒径分子分散较差,体系不稳定[25]。

表3 超微粉碎处理对碱提法麦麸多糖Zeta 电位、粒径及溶解度的影响Table 3 Effect of ultrafine pulverization on Zeta potential,particle size and solubility of alkali-extracted wheat bran polysaccharides

表4 超微粉碎处理对水提法麦麸多糖Zeta 电位、粒径及溶解度的影响Table 4 Effect of ultrafine pulverization on Zeta potential,particle size and solubility of water-extracted wheat bran polysaccharides
2.6 超微粉碎预处理对麦麸多糖微观结构的影响
不同粉碎预处理组麦麸多糖微观结构如图4 所示,对照组超微粉碎0 min 提取的麦麸多糖颗粒光滑圆润,呈现出紧密包裹的空间结构。而经过超微粉碎预处理后,随着超微粉碎时间的增加,碱法提取与水法提取麦麸多糖的颗粒形状从大颗粒转为碎片状且多糖之间发生黏附与团聚[35]。这可能是由于麦麸多糖经超微粉碎后,粉体比表面积增大,颗粒之间表现出较强的黏着力,尤其是碱法提取麦麸多糖经超微粉碎30 min 预处理后,多糖颗粒发生严重的黏附与团聚,无明显的球状空间构型[15]。此外,与对照组超微粉碎0 min 相比,随着超微粉碎时间的增加,超微粉碎组麦麸多糖的有序结构破坏程度加剧,且碱法提取麦麸多糖结构的有序性破坏远比水法提取严重。
2.7 超微粉碎预处理对麦麸多糖单糖组成的影响
由表5 及表6 所示,不同粉碎预处理组麦麸多糖均主要由阿拉伯糖和木糖组成,含有少量半乳糖、葡萄糖、甘露糖、岩藻糖、半乳糖醛酸和葡萄糖醛酸。超微粉碎预处理提取的麦麸多糖中阿拉伯糖和木糖含量较对照组超微粉碎0 min 组含量显著增加(P<0.05),且碱提麦麸多糖超微粉碎30 min 组阿拉伯糖和木糖含量最高,主要由于超微粉碎机能够将物料研磨成颗粒均匀的超细粉,增大麦麸粉的比表面积和孔隙率,进而促进细胞壁中阿拉伯糖和木糖成分的释放与溶出[36]。与梅新等[37]对甘薯渣进行超微粉碎预处理,得出膳食纤维中单糖组成含量均有所增加的结果相一致。与对照组超微粉碎0 min 相比,超微粉碎有助于降低提取工艺中半乳糖、葡萄糖、甘露糖、岩藻糖、半乳糖醛酸及葡萄糖醛酸的含量。由表7及表8 所示,超微粉碎预处理可以明显提高麦麸多糖中阿拉伯糖和木糖所占的百分比。此外,超微粉碎组半乳糖、甘露糖、岩藻糖、半乳糖醛酸、葡萄糖醛酸的含量较对照组超微粉碎0 min 明显减少,且两种提取方式所得麦麸多糖的主要成分差异较大,碱法提取的麦麸多糖中主要单糖成分为阿拉伯糖和木糖,水法提取的麦麸多糖主要单糖成分除阿拉伯糖和木糖,还有半乳糖和葡萄糖。

表6 超微粉碎预处理对水提法麦麸多糖单糖组成含量的影响Table 6 Effect of ultrafine crushing pretreatment on the composition of monosaccharides of water-extracted wheat bran polysaccharides

表7 超微粉碎预处理对水提法麦麸多糖单糖组成各组分所占百分比的影响(%)Table 7 Effect of ultrafine crushing pretreatment on percentage of components of water-extracted wheat bran polysaccharide monosaccharides (%)
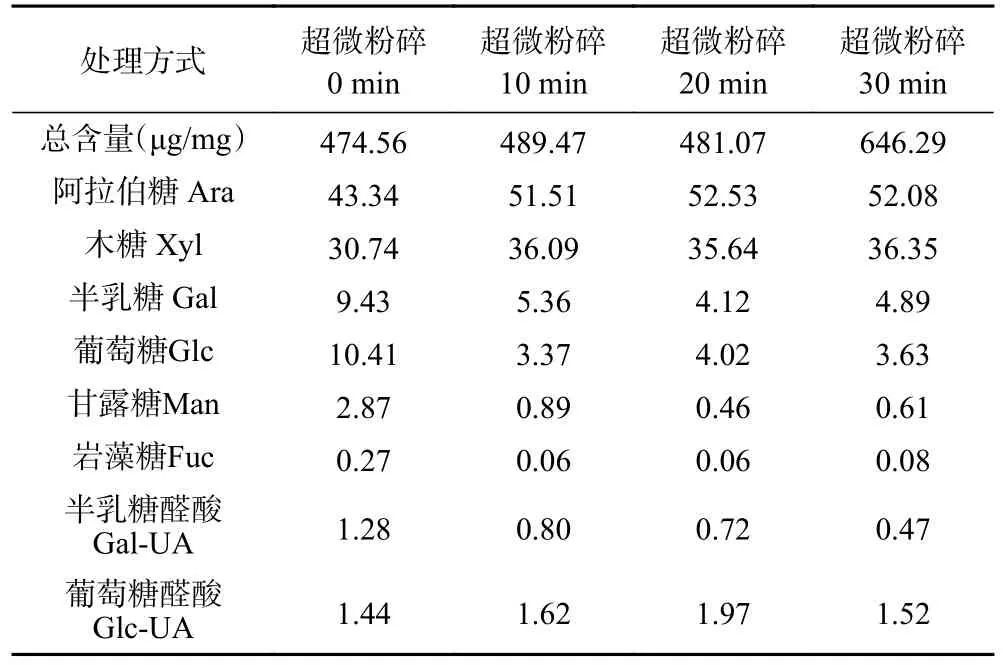
表8 超微粉碎预处理对碱提法麦麸多糖单糖组成各组分所占百分比的影响(%)Table 8 Effect of ultrafine pulverization pretreatment on percentage of components of alkali-extracted wheat bran polysaccharide monosaccharides (%)
3 结论
本实验对麦麸粉原料进行不同时间的超微粉碎预处理,研究超微粉碎预处理对麦麸多糖的理化特性的影响。结果表明,随着超微粉碎时间的增加,麦麸多糖的粒径显著减小(P<0.05),碱提与水提麦麸多糖的粒径从308.47 和919.23 nm 分别降低至203.8和168.03 nm。得率、阿拉伯糖与木糖含量及占比不断增加,碱提与水提麦麸多糖的AX 含量由53.13%和33.32%分别增加至73.35%和37.52%。此外,红外光谱图显示,超微粉碎预处理对碱提和水提麦麸多糖官能团结构影响较小。扫描电镜显示,超微粉碎预处理能够增大粉体的比表面积,且颗粒之间表现出较强的黏附性。
综上所述,超微粉碎预处理可以有效的破坏麦麸粉的细胞壁结构,促进阿拉伯糖、木糖等有效成分的释放,从而获得高得率、高含量及小粒径的麦麸多糖。麦麸粉由于产量高,价格低廉,将其进行超微粉碎预处理提取多糖,将有效拓宽麦麸副产物的应用价值。从而为超微粉碎技术在麦麸副产物中高值化的应用奠定理论基础。此外,超微粉碎技术作为一种新型的食品改性方法,在食品加工领域具有广阔的前景。
