线栓法建立卒中后吞咽障碍的大鼠模型
2023-11-20黄志霖徐发邵施静黄淦刘梅芳张霞辉
黄志霖, 徐发邵, 施静, 黄淦, 刘梅芳, 张霞辉
1.云南中医药大学,云南昆明市 650500;2.云南中医药大学第一附属医院/云南省中医医院,云南昆明市 650021通信作者:张霞辉,E-mail: 754258082@qq.com
0 引言
脑卒中已成为我国成年人死亡、残疾的首要病因,其高发病率、高致残率、高复发率、高死亡率的特点,给患者、家庭和社会造成严重的经济负担和困扰[1]。脑卒中后引起的一系列并发症是影响患者康复的重要因素[2]。吞咽障碍是脑卒中患者最常见的并发症之一,急性卒中后吞咽障碍的发生率可达37%~78%[3]。吞咽障碍可增加误吸的风险,导致吸入性肺炎的发生,而吸入性肺炎是缺血性脑卒中患者和出院后短暂性脑缺血发作患者死亡的主要原因之一[4-5]。此外吞咽障碍还会导致食物、液体摄入量减少,进而造成营养不良和脱水,对患者的身体健康和疾病的后期恢复造成严重影响[5]。神经电刺激疗法[6-7]、针刺疗法[8-9]、功能锻炼[10]等可以改善卒中后吞咽障碍的部分症状,但对于发病的机制仍不明确,早期诊断标准不统一,缺乏卒中后吞咽障碍的靶向治疗手段[11]。
为了明确卒中后吞咽障碍的发病机制,进一步改善卒中后吞咽障碍的诊疗水平,本研究尝试构建一种卒中后吞咽障碍模型。
1 材料与方法
1.1 实验动物
清洁级健康雄性Sprague-Dawley大鼠22只,体质量180~220 g,购自湖南斯莱克景达实验动物有限公司,许可证号SCXK(湘)2019-0004,均于云南省中医医院中心实验室饲养1周,光照与黑暗12 h轮流交替,充足饲料与饮用水,自由进食与饮水。
采用随机数字表法将大鼠随机分为正常组(n= 11)和造模组(n= 11)。
本研究通过云南省中医医院实验动物伦理委员会审查(No.DW-2023-004),对动物的处理严格遵守《关于善待实验动物的指导性意见》。
1.2 主要仪器与试剂
TTC:德国SIGMA 公司。数码成像及分析系统:CELLSENS STANDARD 公司。TUNEL 细胞凋亡检测试剂盒(MK1025):武汉博士德生物公司。Alpine BioMed ApS 肌电图(electromyogram, EMG)机:丹麦DANTEC公司。
1.3 模型制备
10%水合氯醛1 mL/300 g 腹腔注射麻醉大鼠,固定于操作台上,备皮消毒,颈中央切口约1.5 cm。分离颈部筋膜以及肌肉,暴露右侧颈三角后分离右侧颈总动脉、颈外动脉和颈内动脉。用微动脉夹钳夹闭右颈总动脉,并在离颈动脉分叉3~4 mm 处进行颈外动脉的结扎。将颈内动脉附近的筋膜向颅底方向分开,再用微动脉钳将其暂时夹紧。在颈外动脉上剪一小口,插入线栓,在颈外动脉剪口附近打结,取下颈内动脉的微动脉夹,再将线栓插入颈内动脉,进线长度约距颈总动脉分叉处(10.5±0.5) mm,这时进线可以感觉到一丝阻力,栓子刚好堵塞大脑中动脉的开口处。用活结固定,将主动脉上的微动脉夹取下。缺血90 min 后,2%异氟烷0.4 L/min 吸入麻醉,将线栓取出,并将颈外动脉扎闭。缝合伤口,消毒。注意保暖,待大鼠苏醒后放回笼内,饲养1周。
1.4 观察指标
1.4.1 第1次吞咽的发作潜伏期和吞咽的次数测定
分别于造模后第3天和第7天记录实验大鼠第1次吞咽的发作潜伏期和吞咽的次数。10% 水合氯醛1 mL/300 g 腹腔注射麻醉,仰卧位固定,体温保持37 ℃。输液连接管插至大鼠咽部,并连接微量泵,微量泵速度设置为21.8 mL/h,时间为2 min,重复输注3次,每次间隔6 min。同心圆电极插入舌骨与下颌骨中间,记录右下颌舌骨肌肌电活动。用1 000 Hz 后离线分析采样率的数据记录器将肌电信号数字化。吞咽反射由输入的液体溶液引起的EMG 信号识别,并分析在输液过程中的吞咽和第1 次吞咽的发作潜伏期。2 min内的吞咽频率测量为吞咽的次数。第1次吞咽潜伏期被定义为从刺激开始引起的第1 次吞咽动作产生所需的时间。
典型肌电活动见图1。
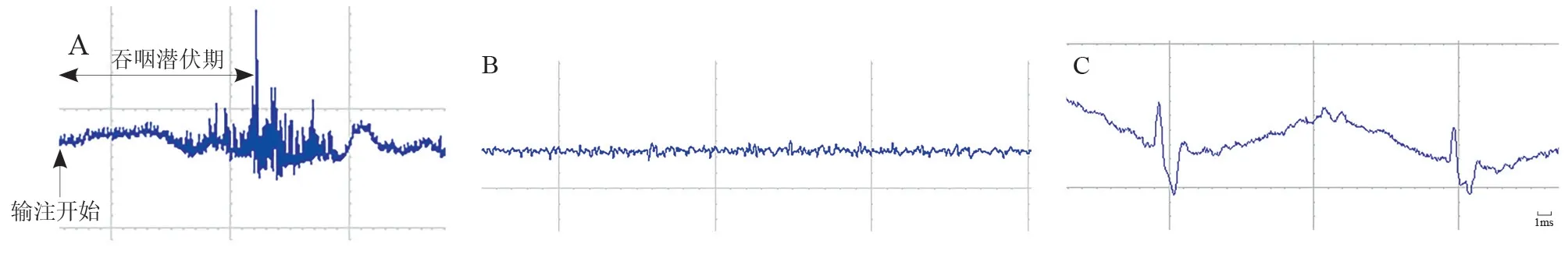
图1 典型肌电活动的EMG
1.4.2 体质量
两组分笼饲养,提供充足的食物和饮用水,保持大鼠自由进食和饮水,于造模前、造模后1~7 d 每天上午8点测量两组体质量。
1.4.3 TTC染色检测缺血半暗带
造模7 d 后,处死大鼠取材。取材前12 h 大鼠禁食,自由饮水。将大鼠脱颈椎处死,取出全脑放置-20 ℃冰箱30 min,待脑组织冻硬后冠状位连续切片,片厚约2 mm,取5 片放入1% TTC 染液5 mL 中,37 ℃孵育15 min。取出放入4%多聚甲醛中浸泡固定24 h,用高拍仪拍照。
1.5 TUNEL染色
取出脑组织,4%多聚甲醛固定,自来水冲洗24 h,乙醇梯度脱水,二甲苯透明,常规石蜡包埋,连续切片,厚5 μm,贴片,晾干备用。
将切片置于65 ℃恒温烘箱中至少30 min,取出后常规脱蜡至水,加入新鲜配制的3% H2O2,室温放置10 min;蒸馏水洗涤2 min×3 次;加0.01 mol/L TBS 1∶200新鲜稀释Proteinase K,37 ℃消化10 min;0.01 mol/L TBS 洗2 min×3 次;加标志缓冲剂(Labeling Buffer) 20 μL/片保持切片湿润。每张切片取TdT和DIG-d-UTP 各1 μL,加入18 μL 标记缓冲液中,混合均匀。将切片上的多余液体甩出,每片加入20 μL混合液。0.01 mol/L TBS 洗2 min×3 次。加封闭液50 μL/片,室温下放置30 min,甩掉封闭液,不洗。抗体稀释液1∶100 稀释生物素化抗DGX 抗体,混匀后加50 μL 至标本片上。置样品于湿盒中,37 ℃反应30 min。0.01 mol/L TBS 洗2 min×3 次。用抗体稀释液1∶100 稀释SABC (取1 mL 抗体稀释液加SABC 10 μL),混匀后加50 μL 至标本片上。37 ℃反应30 min。0.01 mol/L TBS 洗5 min×4 次。DAB 显色,室温下5~15 min,蒸馏水终止显色。烘干,脱水,透明,封片,显微镜下观察。苏木素复染:苏木素溶液浸泡2 min,自来水脱去浮色,1%盐酸乙醇脱色1~2 s,自来水冲洗终止,染核为蓝色。烘干,在65 ℃恒温烘箱烘干1 h。二甲苯透明10 min,中性树胶封片,照片采集。
细胞核中有棕黄色颗粒者为阳性细胞,即凋亡的细胞。
1.6 统计学分析
采用SPSS 25.0 进行统计学分析。采用Shapiro-Wilk法对计量数据进行正态性检验,符合正态分布且方差齐的数据以(±s)表示,采用单因素方差分析;不符合正态分布或方差不齐的数据以M(QL,QU)表示,采用Kruskal-Wallis 秩和检验;采用Bonferroni 法进行组间两两比较;重复测量数据采用重复测量方差分析。显著性水平α= 0.05。
2 结果
研究过程中,造模组于造模后第2 天死亡1 只、第4天死亡3只,正常组无死亡。
2.1 第1次吞咽的发作潜伏期
与正常组比较,造模组造模3 d后第1次吞咽发作潜伏期有所延长,但无显著性差异(P> 0.05);造模7 d 后造模组第1 次吞咽发作潜伏期延长(P< 0.05)。见表1。

表1 各组第1次吞咽发作潜伏期 单位:s
2.2 吞咽次数
与正常组相比,造模3 d 后和造模7 d 后造模组吞咽次数均有所降低,但均无显著性差异(P> 0.05)。见表2。

表2 各组吞咽次数比较单位:次·(2 min)-1
2.3 体质量
各组体质量的时间、组别以及时间和组别的交互效应均显著(P< 0.001)。造模后,造模组各时间点体质量均小于正常组(P< 0.05)。见表3。

表3 各组不同时间点体质量比较 单位:g
2.4 病理学形态
与正常组相比,造模7 d 后,造模组脑组织有明显白色梗死区域;正常组脑组织神经细胞多呈淡蓝色,形态饱满,且排列整齐有序,几乎未见凋亡细胞。造模组脑组织可见大量阳性细胞,细胞核可见明显固缩浓染,表现为棕黄色,排列杂乱无序,形状不规则。见图2和图3。

图2 各组脑组织TTC染色结果
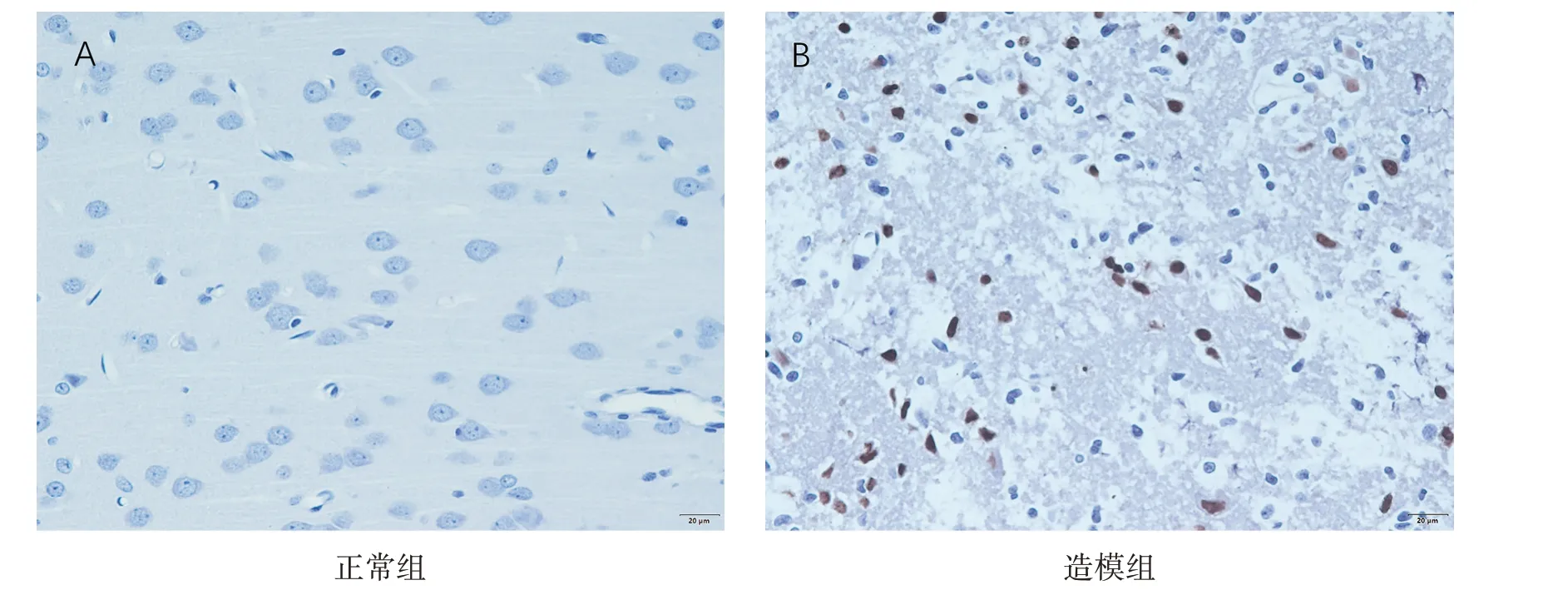
图3 各组凋亡细胞检测结果(TUNEL染色,×40)
3 讨论
卒中后吞咽障碍动物模型的建立对卒中后吞咽障碍的机制及其治疗的研究具有重要价值。临床上由于伦理、患者依从性、个体差异性,经济学等方面的限制,针对卒中后吞咽障碍的研究多局限于经验总结或小样本的前瞻性临床试验[12]。动物模型作为研究疾病病理机制及研发新治疗方案的重要工具,广泛应用于疾病的基础研究[13]。相对于人类受试者,动物模型有助于解决某些人类受试者伦理和道德上的限制[14],良好的卒中后吞咽障碍相关动物模型可为该领域的研究提供两个关键贡献。一是提供比人类试验更为完整的生理和病理的描述,以探索其发病机制。二是为寻求治疗靶点,为治疗和评估手段的发展提供基础。
EMG 是评估吞咽功能障碍的常用方法之一,它通过采集肌肉活动的肌电信号,对神经肌肉功能做定量和定性分析,同时还可以用来推测神经肌肉的病变特性[15]。目前针对于人类受试者的EMG 测定多为无创性的表面肌电图(surface electromyography, sEMG),但吞咽动作是由多肌肉协同合作产生的[16],sEMG 仅能测定表层肌肉的肌电信号,无法区分某些精细部位的肌电活动,如对吞咽动作产生起重要作用的舌骨下肌群,难以精确测量肌电活动。而在动物模型上,可通过在深层肌肉植入电极,准确测量肌电活动[17-18]。本研究在右下颌舌骨肌植入电极,并监测吞咽动作,无吞咽时捕捉呼吸、心电干扰的肌电活动,以排除呼吸运动、心脏活动对肌电活动的干扰。
目前常用于吞咽障碍模型建立的动物主要有大鼠、小鼠[4,19]等啮齿类动物,猕猴[20]等非人灵长类动物,以及猪[21]等哺乳类动物,但针对卒中后吞咽障碍的动物模型较为少见[12]。2014 年,Naoto Sugiyama 利用线栓法进行大鼠单侧短暂性大脑中动脉闭塞,建立卒中后吞咽障碍模型[4],成功模拟出卒中后吞咽障碍的部分临床症状,后续研究者多沿用此方法。但该方法造模后1~3 周进行吞咽反射的评定,这与人类脑卒中患者吞咽障碍的时间点存在一定差异;且该研究在造模过程中开放大鼠气道,虽然可以一定程度避免误吸的风险,但可能会对大鼠造成伤害,影响造模成功率。
本研究采用Sprague-Dawley 大鼠制作模型,相对于其他动物模型,具有易繁殖、成本低、模型稳定的优势,且在解剖生理学、遗传学等方面与人类有许多相似之处[10]。
现有针对动物模型吞咽功能的评估包括吞咽造影检查(video fluoroscopic swallowing study, VFSS) 和EMG。VFSS 可检测舌肌、喉部等吞咽表现[22]。EMG可用于分析吞咽次数和吞咽潜伏期等[4]。VFSS常用于人及灵长类动物吞咽功能的评估,虽然现在已有针对鼠类等小型动物的VFSS协议[23-24],但该方法操作较为繁琐且技术门槛较高,不利于普及。此外,纤维内镜吞咽评估、舌压力测量、神经功能评估、模型动物的体质量与进食量变化皆为动物模型吞咽功能的常用评估方法[12,18]。本研究采用EMG 分析大鼠第1 次吞咽的发作潜伏期、2 min 吞咽次数以及大鼠体质量的变化作为卒中后吞咽障碍的评价指标。
吞咽潜伏期延长是卒中后吞咽障碍的显著特征之一[25],吞咽潜伏期指的是吞咽动作启动所需的时间。卒中后吞咽障碍患者吞咽潜伏期延长的发生率高达90.1%,吞咽潜伏期延长会导致患者吞咽过程中食物滑落至会厌后壁或梨状窦区域,从而溢入喉及气管内导致误吸,进而增加吸入性肺炎的风险,同时也会导致食物和液体摄入减少,造成营养不良、脱水等并发症[11,26-28]。张耀文等[29]发现,利用神经肌肉电刺激改善卒中后吞咽障碍患者吞咽启动延迟,误吸风险也随之降低。
本研究显示,造模大鼠卒中后3 d 开始出现吞咽启动延迟迹象,与人类卒中后吞咽障碍的时间点相似[30]。
吞咽次数减少是人类卒中后吞咽障碍较为常见的临床表现[25]。本研究中,造模大鼠吞咽次数虽有所减少,但无显著性差异,这可能是一种补偿机制或者喂食效率低的指标。吞咽功能由感觉输入、中央控制和肌肉功能协调完成。以往研究显示,卒中后吞咽障碍模型大鼠造模后1 周出现舌肌力降低,但吞咽次数并未发生明显改变[24];临床研究发现,吞咽功能的降低与卒中后口腔敏感性的改变相关[31]。本研究吞咽次数减少不明显,可能与此相关。
良好的营养支持是脑卒中患者保持良好康复效果的基础[32],而脑卒中吞咽障碍患者由于吞咽障碍导致食物摄入减少,同时易发生腹泻、感染等,增加身体消耗,出现体质量减小、营养不良等症状[33-34],影响后期康复疗效。本研究中,大鼠造模后体质量减小,提示营养不良的风险,表明该模型复现了卒中后吞咽障碍的相关表现。
本实验仍存在不足之处。卒中后吞咽障碍多发生于老年患者[35],后期可在此基础上,控制大鼠的年龄,以期建立与人类卒中后吞咽障碍更贴合的模型。
4 结论
本研究中造模后大鼠在组织学和病理学上出现脑组织梗死,神经细胞大量凋亡,在行为学上出现吞咽潜伏期延长和体质量减小,证明该模型作为脑卒中后吞咽障碍动物模型可行。
利益冲突声明:所有作者声明不存在利益冲突。
