超声波辅助韧化改性甘薯淀粉的结构及理化特性
2023-11-16李姝颖谢钰欣赵国华叶发银
李姝颖, 谢钰欣, 张 蕾, 赵国华,3, 叶发银,3
(西南大学食品科学学院1, 重庆 400715)(西南大学西塔学院2, 重庆 400715)(重庆市甘薯工程技术研究中心3, 重庆 400715)
甘薯淀粉是生产粉条(丝)、酸辣粉的优质原料,还作为增稠剂、稳定剂、填充剂或持水剂用于汤料、酱汁、肉品等现代食品工业。天然甘薯淀粉存在糊的透明度低[1]、易老化[2]、析水率高以及对酸、热[3]、剪切等环境及加工因素的抗性较差等问题,限制了其应用。甘薯淀粉的改性手段包括物理、化学或生物学手段,其中物理手段因其安全、绿色、有效而被广泛接受。Zheng等[1]发现双频超声处理可显著提升甘薯淀粉糊的透光率。Guo等[2]发现甘薯淀粉依次采用生麦芽糖α-淀粉酶、β-淀粉酶、转葡糖苷酶处理,回生性能显著降低,淀粉凝胶质地改善、透明度提高。Trung等[4]报道湿热处理和韧化提高了甘薯淀粉的抗性淀粉含量。
韧化是常用的淀粉物理改性方法。韧化是在过量水分(质量分数>60%)或平衡水分(质量分数40%~55%),温度高于淀粉玻璃化转变温度(Tg)而低于淀粉糊化起始温度(To)条件下进行的水热处理[5]。Hu等[3]报道甘薯淀粉经韧化可显著改善糊化特性,淀粉糊的耐剪切能力提高,糊的回生性减弱。韧化在不破坏淀粉颗粒形态的情况下影响淀粉链之间的相互作用,使淀粉内部分子结构重新排列,从而改变淀粉的结构和理化性质[5]。但是,韧化时间通常相对较长(24 h~数天),有些淀粉通过韧化只能在很小程度上进行改性,甚至无法达到期望的改性效果[6]。
不少研究者将韧化与其他方式(如湿热、干热、超声波、微波、酶法等)相结合,以缩短韧化时间或提高其改性效果[6]。Babu等[7]发现小米淀粉在韧化前进行超声波处理,可使耐酸性从改性前的0.74增加到0.94、抗剪切性从0.42增加到0.68、抗性淀粉质量分数从18.20%增加到45.59%。Chang等[8]发现脱支蜡质玉米淀粉在韧化前进行超声波处理,可使其RS质量分数从46.2%增加到65.4%。超声波是一种由频率高于人类听觉阈值的高能机械波[9],其产生的机械效应、热效应和空化效应形成的高压、高温,可在短时间内诱导淀粉链剧烈运动,改变分子链之间相互作用和使其重新排列[10]。尽管超声波辅助韧化在其他淀粉中取得了有益效果,但是该方式用于改善甘薯淀粉加工特性方面缺乏研究。以单一韧化为对照,考察超声波辅助韧化对甘薯淀粉加工特性的改性效果,以期为双重物理改性甘薯淀粉和设计开发具有期望质地的甘薯淀粉凝胶食品提供参考。
1 材料与方法
1.1 材料与试剂
甘薯淀粉;氢氧化钠、乙酸、乙酸钠、溴化锂、叠氮化钠:分析纯;二甲基亚砜:色谱纯;异淀粉酶:1 400 U/mg。
1.2 仪器与设备
HWS-26电热恒温水浴锅,KQ-700DE数控超声波波清洗器,DHG-9140电热恒温鼓风干燥箱,SARTORIUS电子天平,IRPrestige-21红外光谱仪,TechMaster快速黏度分析仪,Phenom Pro10102扫描电镜,X'Pert3 Powder10300 X射线衍射仪,TA. XT Plus质构仪,DHR-2流变仪,Thermo ICS5000+离子色谱系统,DAWN HELEOS-Ⅱ激光光散射检测器,OPTILAB T-rex示差检测器。
1.3 方法
1.3.1 样品制备
韧化:称取400 g的甘薯淀粉(NS),加入蒸馏水调至水质量分数为70%,放置于蒸煮袋中密封,在4 ℃下平衡12 h,将平衡后的样品置于55 ℃水浴中韧化16 h,取出抽滤,放入烘箱40 ℃烘干24 h,标记为ANN。超声波辅助韧化:分别在韧化前段(5%)、中段(50%)和后段(95%)超声波(55 ℃、280 W、40 kHz)处理20 min,超声波处理后停止韧化或继续韧化。对样品进行抽滤,放入40 ℃烘箱干燥24 h。各样品分别标记为ANN-5%US、ANN-50%US、ANN-5%US-ANN、ANN-50%US-ANN、ANN-95%US-ANN。
1.3.2 扫描电镜观测
淀粉粉末用导电胶粘于载物台上,喷金吹氮后,置入扫描电镜观测,加速电压10 kV,放大倍数×3 000。
1.3.3 直链淀粉含量测定
参照GB/T 15683—2008《大米直链淀粉含量的测定》。
1.3.4 淀粉分子质量测定[11]
将5 mg淀粉与5 mL含质量分数0.5% LiBr 的DMSO溶液充分混合,使用恒温器在80 ℃加热3 h。采用凝胶色谱(SEC)-示差(RI)-多角度激光光散射(MALLS)系统液相系统测定各组分的多分散性和分子质量。采用DAWN HELEOS-Ⅱ型激光光散射检测器(He-Ne激光器,λ=663.7 nm),测定DMSO溶液中各组分的质量和数均分子质量(Mw和Mn)和多分散指数(Mw/Mn)。根据化合物的性质,采用合适分子质量范围的凝胶排阻色谱柱:Ohpak SB-805 HQ(300 mm×8mm),Ohpak SB-804 HQ(300 mm×8 mm),Ohpak SB-803 HQ(300 mm×8mm);柱温60 ℃;进样量100 μL;流动相0.5% LiBr的DMSO溶液;流速0.3 mL/min;等度洗脱。利用软件ASTRA 6.1处理色谱数据。
1.3.5 支链淀粉链长分布测定[11]
称取样品5 mg,重悬于5 mL水中,沸水浴60 min,间断涡旋混匀;加入50 μL醋酸钠(0.6 mol/L,pH 4.4)、10 μL质量分数2%的NaN3和10 μL异淀粉酶(1 400 U),37 ℃孵育24 h。加入质量分数0.5%硼氢化钠溶液,涡旋混匀后放置20 h。取600 μL于离心管中,室温氮吹干燥。溶于30 μL 1 mol/L NaOH 60 min,之后加入570 μL水稀释,12 000 r/min离心5 min,取上清上样。采用Thermo ICS 5000离子色谱系统,色谱柱DionexTMCarboPacTMPA200(250×4.0 mm,10 μm),进样量5 μL。流动相A相:0.2 mol/L NaOH;B相:0.2 mol/L NaOH/0.2 mol/L NaAc,柱温30 ℃,采用电化学检测器对组分进行分析检测。流速0.4 mL/min;洗脱梯度:0 min A/B(体积比90∶10),10 minA/B(体积比90∶10),30 minA/B(体积比40∶60),50 min A/B(体积比40∶60);50.1 min A/B(体积比90∶10);60 min A/B(体积比90∶10)。利用Thermo ICS 5000+处理谱图数据。
1.3.6 热特性测定
将淀粉和蒸馏水按照1∶2的质量比,放入铝盘(Ф 5.4 mm×2.0 mm)并密封。将样品在室温下平衡过夜,使淀粉充分水化。以10 ℃/min的升温速度将样品从20 ℃加热到120 ℃。使用TA Instruments TRIOS version 4.4分析起始温度(To)、峰值温度(Tp)、终止温度(Tc)以及糊化焓(ΔH)。
1.3.7 糊化特性测定
称取样品3.00 g(干基)放入铝筒中,然后加入25 mL蒸馏水,混合均匀,然后运行程序。最初10 s以960 r/min进行搅拌,之后保持160 r/min至实验结束。采用升温/降温程序:RVA初始温度为50 ℃,从50 ℃提高到95 ℃,保持95 ℃,从95 ℃降至50 ℃,保持50 ℃。获得淀粉在测试过程中的黏度变化曲线以及7个特征点,糊化温度、峰值时间、峰值黏度、谷值黏度、崩解值、最终黏度和回升值。
1.3.8 X-射线衍射分析
取少量样品使用X-射线衍射仪测定。在管压40 kV,管流40 mA的条件下,以4°~40°的衍射角(2θ)扫描,扫描速度为2(°)/min。用MDI-Jade 6.5软件计算样品的相对结晶度。
1.3.9 傅里叶变换红外光谱分析
在傅里叶变换红外光谱仪进行分析,扫描范围600~4 000 cm-1,扣除空气背景,每4 cm-1扫描64次,记录样品的FT-IR光谱。用PeakFit v 4.12软件计算特征峰面积比值。
1.3.10 凝胶特性的测定
称取一定质量的淀粉样品,加蒸馏水配制成质量分数6%的淀粉悬浮液,置于沸水浴中加热20 min,期间不断搅拌使其完全糊化。糊化结束后取出冷却至室温,在4 ℃条件下储藏24 h后用于测定。选择TPA模式,采用圆柱形探针(P36/R)进行测量,测定参数为:测前速率1.0 mm/s,测试速率1.0 mm/s,测后速率1.0 mm/s;触发力:5 g;压缩比:50%。
1.3.11 流变学特性的测定[12]
采用流变仪进行淀粉凝胶动态流变分析,该分析仪配备平板(直径为40 mm,间隙为1 mm)。制备质量浓度为6%的淀粉悬浮液,然后在沸水浴中加热20 min,不断搅拌,糊化结束后冷却至室温,在4 ℃条件下储藏24 h后用于测定。在 25 ℃和振荡频率1Hz条件下,进行应变0.01%~100%的范围扫描,确定其线性黏弹区。在温度25 ℃、应变1%的条件下,测定振荡频率在0.1~100 rad/s内储能模量(G′)、损耗模量(G″)、损耗角正切值(tanδ)变化的情况。
1.4 数据统计与分析
除特别说明外,所有实验均平行3次以上,数据采用平均值±标准差表示。采用Origin 2018绘图。使用SPSS 26软件进行ANOVA分析,采用LSD检验,P<0.05为显著性差异。
2 结果与分析
2.1 超声波辅助韧化对甘薯淀粉颗粒形态的影响
如图1所示,天然甘薯淀粉(图1a)表面光滑,多呈多角形、椭圆形、球形,少数不规则。韧化后的淀粉(图1b)颗粒形态无明显变化。由于处理温度低于淀粉糊化温度,韧化对淀粉颗粒形态无影响[5]。由图1c~图1g可见,超声波辅助韧化改性甘薯淀粉的颗粒形态无明显变化。Babu等[7]报道超声波辅助韧化导致淀粉颗粒表面变得不光滑。Monroy等[12]研究显示,随着超声波处理时间延长,淀粉颗粒的表面逐渐粗糙,但淀粉颗粒的完整性不受影响。但是,Pinto等[13]报道经过超声波处理的淀粉颗粒没有明显的裂纹和缺口;Sujka等[14]研究表明经超声波处理的大米淀粉颗粒未见明显裂纹。这表明,在研究中超声波处理条件(20 min、280 W、40 kHz)所产生的机械效应、热效应和空化效应不足以改变甘薯淀粉颗粒的形态。

注:a为NS; b为ANN; c为ANN-5%US; d为ANN-50%US; e为ANN-5%US-ANN; f为ANN-50%US-ANN;g为ANN-95%US为ANN。余同。
2.2 超声波辅助韧化对甘薯淀粉表观直链淀粉含量和分子结构的影响
2.2.1 表观直链淀粉含量
如表1所示,改性使甘薯淀粉的表观直链淀粉含量产生一定程度的变化。韧化淀粉(样品b)的表观直链淀粉含量最低;与韧化相比,超声波辅助韧化提高了甘薯淀粉的表观直链淀粉含量,而且后段施加超声波(样品g)的最高。这可能是影响了直链淀粉的螺旋构象,改变其与碘的结合能力有关[15,16]。超声波产生的机械效应、热效应和空化效应促进了韧化过程中淀粉分子链的运动,影响了淀粉分子链之间的相互作用,提高了与碘结合的能力。此外,超声波诱导水分子分解形成羟自由基和氢自由基,这些自由基非选择性地攻击C—H键的氢,因此表观直链淀粉的增加也可能来自于直链淀粉的部分解聚[17]。
2.2.2 淀粉的分子质量
色谱分析结果表明(图2),甘薯淀粉的大、小分子质量组分呈现良好分离。RI色谱图(图2a)第Ⅰ峰为高分子质量峰,在洗脱约38 min时浓度最大,为支链淀粉;第Ⅱ峰为低分子质量峰,在洗脱约47 min时浓度最大,为直链淀粉[18]。经过韧化的甘薯淀粉分子质量没有发生变化,这表明淀粉分子链未受韧化的影响(表1)。在韧化后段施加超声波显著降低了甘薯淀粉的分子质量,而前段和中段施加超声波对甘薯淀粉的分子质量影响不显著。这可能在于施加超声波之前的韧化时间较长促进了淀粉链的运动,促进了后段施加超声波对聚合物团簇的分解[19]。Mw/Mn代表聚合物分散性的均匀性,其值越大表明聚合物链长链和短链混杂。样品g的Mw/Mn为2.637,这表明后段施加超声波处理对聚合物团簇的分解。
2.2.3 支链淀粉链长分布
支链淀粉链长分布根据聚合度(DP)可分为4类:A链(DP 6-12)、B1链(DP 13-24)、B2链(DP 25-36)和B3链(DP≥37)[20]。其中B1链属短B链,B2和B3链属长B链,均为内链;A链是支链淀粉的外链,它通过α-1,6糖苷键与B链相连[21]。如表1所示,甘薯支链淀粉的B1链占比最高,B3链占比最低。甘薯支链淀粉链长分布因改性未见显著性变化(P>0.05)。改性淀粉的平均链长组间无显著差异(P>0.05)。这表明超声波辅助韧化很可能没有导致支链侧链断裂。Pinto等[13]研究发现韧化不影响支链淀粉链长分布。超声波能否影响支链淀粉的侧链分布,或与实验处理条件有关[9]。与Babu等[7]研究发现超声波能引起支链淀粉侧链分子断裂不同,本研究的超声波处理未达到这一程度。
2.3 超声波辅助韧化对甘薯淀粉长程和短程有序结构的影响
2.3.1 长程结构
天然甘薯淀粉呈现C-型淀粉结晶峰,在5.6°(2θ)有个小的衍射峰,2θ=15.1°、17.2°、18.1°和22.9°处有较强的衍射峰(图3a)[1]。超声波辅助韧化对淀粉的晶体结构有一定影响,5.6°(2θ)在一些样品组(b、f)中有减弱现象。天然甘薯淀粉的相对结晶度为31.98%,韧化改性使其相对结晶度降低至29.68%,并随着后续韧化时间延长而降低。改性淀粉e、f和g的相对结晶度分别降低至28.56%、25.71%和28.19%。这可能是由于韧化温度55 ℃时发生了淀粉半晶结构部分熔化,促进了淀粉晶体重新排列[5,22]。超声波辅助韧化时,超声波优先破坏半晶区,并进一步使晶区被破坏[23, 24]。

图3 韧化-超声波对甘薯淀粉的长程和短程有序结构的影响
2.3.2 短程有序结构
如图3b,FT-IR图谱上1 047和1 022 cm-1处的峰分别反映淀粉的短程有序结构和无定型结构。两处峰的吸光度比值R1 047/1 022常用于衡量淀粉双螺旋短程结构有序度,比值越大,表明其有序度越高[25];995 cm-1处的吸收峰对水分子敏感,吸光度比值R1 022/995用来量化淀粉的无序程度[26]。天然甘薯淀粉的R1 047/1 022和R1 022/995分别为0.618 5和0.608 9。与天然甘薯淀粉相比,改性没有造成R1 047/1 022显著变化。但是,样品g的R1 047/1 022(0.639 9) 显著高于样品b(R1 047/1 022=0.577 8),这说明后段超声波处理使双螺旋结构重新排列,增加了短程有序性。与天然甘薯淀粉相比,改性淀粉(b~g)的R1 022/995显著升高,其中样品f(0.760 1)最高,这表明超声波辅助韧化增大了甘薯淀粉无定形区的无序性。
2.4 超声波辅助韧化对甘薯淀粉热特性的影响
由表2可知,韧化淀粉的To和Tp高于天然甘薯淀粉,而Tc、ΔT和ΔH与天然甘薯淀粉之间无显著差异;超声波辅助韧化显著提高了淀粉的To、Tp和ΔH值。To和Tc分别与最弱和最强的淀粉分子结构的熔化有关,ΔH表示破坏这些结构所需的能量。淀粉稳定的双螺旋比不稳定的双螺旋需要更多的能量展开和熔化[27]。超声波辅助韧化促进了淀粉双螺旋有序化,改善了淀粉的结晶完善度,从而使To、Tp和ΔH增加[8]。

表2 超声波辅助韧化对甘薯淀粉热特性和糊化特性的影响
2.5 超声波辅助韧化对甘薯淀粉糊化特性的影响
与天然甘薯淀粉相比,韧化淀粉具有更高的糊化温度、峰值黏度、谷值黏度、最终黏度和回升值,具有更低的崩解值(表2),这可能与韧化淀粉更高的溶胀力和直链淀粉浸出程度上升有关[28]。Yadav等[29]研究证实韧化会影响淀粉颗粒的内聚力,导致淀粉形成淀粉糊化需要吸收更多的热能。在本研究中,超声波辅助韧化使甘薯淀粉的回升值升高、崩解值降低。这可能是因为超声波影响了韧化过程淀粉的无定形区,增加了淀粉链的迁移率和直链淀粉浸出程度,促进了溶出的直链淀粉和支链淀粉相互作用,导致黏度增加,淀粉链与链之间更容易形成稳定缔合,使淀粉的抗热、抗剪切和回生性提高[15]。
2.6 超声波辅助韧化对甘薯淀粉流变学特性的影响
储能模量(G′)表示弹性形变过程中储存能量的大小,代表体系弹性。损耗模量(G″)表示黏性形变过程中损耗能量的大小,代表体系黏性[30]。如图4所示,所有凝胶的G′和G″值都随着频率变化,呈现频率依赖性。G′总是高于G″,tanδ<1,体系的黏弹性以弹性为主。超声波辅助韧化显著提高了淀粉体系的黏弹性,改性淀粉凝胶的G′与G″值均高于天然甘薯淀粉。淀粉凝胶的黏弹性行与淀粉颗粒的溶胀性有关,G′与G″值越大,淀粉颗粒的溶胀程度越高[31]。Khur-shida等[32]研究发现超声波处理增强了木薯淀粉的胶凝能力。超声波辅助韧化增强了直链淀粉溶出程度,使淀粉链之间的相互作用增强,淀粉链缠结点增多,形成了强大缠结的大分子淀粉凝胶网络。损耗角正切值tanδ为G″与G′之间的比值,反映黏弹性比例。tanδ越大,则体系中的黏性特征越占主导[33]。超声波辅助韧化改性淀粉(样品c~g)的tanδ值高于韧化改性淀粉(样品b),表明施加超声波使韧化淀粉的黏性增加。样品g的tanδ值甚至高于天然甘薯淀粉,显示出最高的黏性。
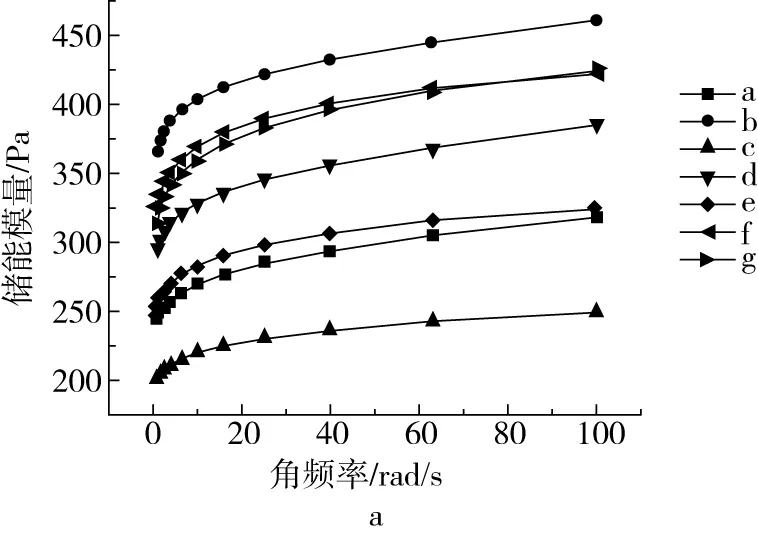
图4 甘薯淀粉凝胶的储能模量、损耗模量和损耗因子随动态扫描频率变化图谱
2.7 超声波辅助韧化对甘薯淀粉凝胶特性的影响
淀粉凝胶的结构性质与淀粉的分子结构和形成的双螺旋聚集体有关[34]。超声波施加方式的不同可导致甘薯淀粉凝胶呈现不同质地特征(表3)。在韧化前期施加超声波可大幅提高淀粉凝胶的硬度、胶黏性和胶黏性(P<0.05),而后期施加超声波使其硬度、胶黏性和胶黏性大幅下降;值得注意的是,在前期施加超声波后即停止韧化的样品组,指标与天然甘薯淀粉相比无显著变化。
3 结论
超声波辅助韧化不影响甘薯淀粉颗粒形态,其表观直链淀粉含量以及支链淀粉的侧链分布也没有因改性而发生显著性变化。超声波辅助韧化对甘薯淀粉分子质量有一定影响。在韧化后段施加超声波使淀粉的数均分子质量显著下降,多分散性指数增加。超声波辅助韧化在一定程度上改变了甘薯淀粉的结晶结构,其中,在韧化中段施加超声波使相对结晶度从原来的31.98%减少至25.71%。超声波辅助韧化可提高甘薯淀粉回升值和降低崩解值,改善回生性能。超声波辅助韧化改性甘薯淀粉凝胶的G″与G′值均高于天然甘薯淀粉,增强了淀粉体系的弹性和黏性。在韧化前期施加超声波提高了甘薯淀粉凝胶的硬度、胶黏性和咀嚼性,使甘薯淀粉的凝胶特性得到改善。
