甜瓜瓜类蚜传黄化病毒侵染响应基因鉴定
2023-11-14杨思语宫子惠胡仲远张明方杨景华
杨思语,宫子惠,胡仲远,2,张明方,2,杨景华,2*
(1.浙江大学农业与生物技术学院,浙江 杭州 310058;2.浙江大学海南研究院,海南 三亚 572025)
甜瓜(Cucumis melo)是我国重要的葫芦科经济作物之一,在我国有着3 000多年的栽培历史。据国家统计局(https://data.stats.gov.cn)数据,2020年全国甜瓜栽培面积已超37.61万hm2。瓜类蚜传黄化病毒(cucurbit aphid-borne yellows virus, CABYV)属于黄体病毒科(Luteoviridae)马铃薯卷叶病毒属(Polerovirus),在自然界中依赖介体传播。CABYV在我国很多省份均有发生,尤其是在我国西北地区,目前已成为限制甜瓜产业健康发展的重要因素[1]。CABYV侵染后的甜瓜叶片逐渐增厚,颜色由绿色变为明黄色,并引起花叶症状,果实的外部形态无明显变化,但平均结果数量显著降低[2]。该病毒侵染后的症状与田间常见其他生理病害的症状相似,如叶片老化、营养元素缺乏等,所以在田间调查时很容易被忽视,大面积发病时可造成减产、绝收等[2]。
目前对于甜瓜抗CABYV的遗传规律和侵染后响应基因的研究较少,影响了甜瓜抗CABYV 育种进程。早在1997年,DOGIMONT等[3]对印度甜瓜抗病品系‘PI124112’和感病品系‘Védrantais’杂交群体进行研究时发现,‘PI124112’中对CABYV 的抗性由2个互补隐性基因(命名为cab-1和cab-2T)共同调控。KASSEM 等[4]利用‘TGR-1551’抗性甜瓜品系与西班牙易感品系‘Bola de Oro’构建遗传群体,发现‘TGR-1551’对CABYV 的抗性至少由3 个基因控制,其中一个为显性基因。由此可见,甜瓜抗CABYV 的遗传机制较为复杂,在不同的品种中表现出不同的遗传规律。在作物抗病机制研究中,转录组测序技术如RNA 测序(RNA sequencing,RNA-Seq)被广泛应用于研究各类植物与病原菌互作机制。2021 年,张欢[5]从转录组水平比较分析了花生抗青枯病品种‘远杂9102’及感病亲本‘徐州68-4’对青枯菌的响应差异,鉴定到一个新的花生抗青枯病基因Arahy.5D95TJ。贺苗苗[6]对‘青薯9 号’在晚疫病不同侵染时间点进行了转录组测序,通过差异表达基因(differentially expressed genes, DEGs)k均值聚类算法分析,发现侵染24 h 后亚聚类1(subcluster_1)及亚聚类4(subcluster_4)有大量的差异基因上调表达,推测侵染24 h 为晚疫病菌与‘青薯9号’互作的关键阶段。
侵染性克隆载体已经在多种作物抗病机制研究中广泛应用,是植物虫传病毒响应基因挖掘和遗传定位中常用的手段。蚜虫是传播CABYV的重要媒介,同时,蚜虫取食植物叶片也是一种生物胁迫,可能对甜瓜抗CABYV遗传定位研究造成干扰。构建侵染性克隆载体接种甜瓜可以模拟CABYV的侵染,并排除蚜虫伤害对植株可能造成的影响。本研究采用pCB301-CABYV侵染性克隆载体接种甜瓜‘西州蜜’(XZM),对接种0 dpi(days post inoculation,感染后时间)、5 dpi、10 dpi、15 dpi、20 dpi 的甜瓜叶片进行转录组测序,挖掘CABYV侵染后的响应基因,为进一步解析甜瓜抗CABYV分子机制和抗病育种提供依据。
1 材料与方法
1.1 试验材料与试剂
本研究所采用的甜瓜品种为‘西州蜜’(XZM),甜瓜原始病叶由新疆农业科学院张学军研究员馈赠。侵染性克隆载体pCB301-CABYV由本实验室构建并保存,农杆菌菌株为GV3101。
实验相关试剂:利福平(rifampicin, Rif)、卡那霉素(kanamycin, Kana)、乙酰丁香酮(acetosyringone,AS)、酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)试剂盒(上海酶计生物科技有限公司)、RNA提取试剂盒(浙江易思得生物科技有限公司)、cDNA 反转录试剂盒(日本TOYOBO 公司)、实时荧光定量反转录聚合酶链反应(real time quantitative reverse polymerase chain reaction, RTqPCR)试剂盒(SYBR Green Master Mix,南京诺唯赞生物科技股份有限公司)、Gibson Assembly 无缝连接试剂盒(美国New England Biolabs 公司)、PCR酶试剂盒(KOD One Master Mix,日本TOYOBO公司)。
1.2 pCB301-CABYV 侵染性克隆载体构建
将带有CABYV的甜瓜病叶进行RNA提取,反转录后分段扩增CABYV DNA片段,并利用无缝克隆技术拼接获得全长CABYV DNA(GenBank 登录号:OQ980415),与pCB301 载体重组构建得到pCB301-CABYV 侵染性克隆载体。将以上侵染性克隆载体分别接种甜瓜与本氏烟,经病情调查发现甜瓜与本氏烟叶片分别于20 dpi、60 dpi 时发病明显,结果如附图1~2(http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2023.05.121)所示;RT-qPCR 鉴定发病植株时得到阳性条带,如附图3~4(http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2023.05.121)所示。ELISA 结果显示,发病植株样品病毒含量均大于临界值,表现为阳性,与RT-qPCR结果一致。经鉴定确认该pCB301-CABYV侵染性克隆载体具有侵染活性,将其转入农杆菌后,置于本实验室-80 ℃冰箱中保存,备用。

图1 甜瓜‘西州蜜’接种pCB301-CABYV后在5个时间点的叶片病征Fig.1 Disease symptoms of melon XZM leaves inoculated with pCB301-CABYV at five time points
1.3 农杆菌活化培养
取含有pCB301-CABYV 质粒的农杆菌甘油菌液500 μL,加入含有25 µg/mL Kana和25 µg/mL Rif的抗性液体培养基,于28 ℃、250 r/min 下活化约24 h;取活化好的菌液50~200 µL,置于10 mL含有抗性的Luria-Bertani(LB)液体培养基(50 µg/mL Kana、50 µg/mL Rif、10 mmol/L 2-吗啉乙磺酸生物缓冲液、25 µmol/L 乙酰丁香酮)中,于28 ℃下过夜并摇菌至菌液D(600 nm)=1.5;常温下以6 000 r/min离心10 min 后弃上清液,加入5 mL 诱导缓冲重悬液。将接种液和植物在室温下避光静置4 h。
1.4 甜瓜接种
取‘西州蜜’甜瓜种子浸泡于1.5%硝酸钾溶液中,并在65 ℃下加热30 min,再于温水中浸泡3 h后用流水清洗。种子播种后,于温室中黑暗培养4 d,待发芽后,选择长势相对一致的甜瓜苗移栽于正常光照周期(16 h光照/8 h黑暗)环境中培养。待甜瓜长至一叶一心时,进行黑暗处理24 h,随后对子叶注射1 mL pCB301-CABYV 侵染性克隆载体菌液,同时设置阴性对照叶片处理组(注射空载体菌液),接种完成后再次进行黑暗处理24 h,之后恢复正常光照周期。对侵染0 dpi、5 dpi、10 dpi、15 dpi、20 dpi的甜瓜叶片分别取样并调查叶片发病症状。
1.5 感病鉴定
1.5.1 CABYV 包被蛋白基因的RT-qPCR 扩增
提取侵染20 dpi 的甜瓜发病叶片RNA,并反转录成cDNA。根据CABYV 的病毒包被蛋白(coat protein,CP)基因保守区域,设计上、下游特异性引物(CP-F/R),由浙江有康生物科技有限公司合成。RT-qPCR在不含核糖核酸酶的反应管中进行:加入cDNA 模板200 ng,CP-F/R 各1 µL,PCR 酶25 µL,加水补足至50 µL。扩增程序如下:98 ℃预变性5 min;98 ℃变性10 s,60 ℃退火5 s,68 ℃延伸5 s,35个循环;72 ℃延伸7 min。所用引物序列:CP-F,5´-AAGTCGAGGAGTCCTCAAAACTGGAATT-3´;CP-R,5´-TCGTGCCATTCCATCCCGTTGAT-3´。
1.5.2 ELISA 反应
对侵染20 dpi 的甜瓜发病叶片取样,参照ELISA试剂盒说明书检测甜瓜植株叶片中CABYV的含量,通过标准曲线计算样品中CABYV 含量。实验结果判定的临界值(cut off)为病毒载量0.58 ng/g,超过该阈值即判定为阳性。
1.6 转录组测序
1.6.1 甜瓜叶片取样与测序
结合植株发病情况、ELISA和RT-qPCR分析结果,分别选取CABYV 接种0 dpi、5 dpi、10 dpi、15 dpi、20 dpi后鉴定为阳性的9株植株混合,每个处理取3 个生物学重复,转录组测序由北京诺禾致源科技股份有限公司完成。
1.6.2 差异表达基因富集分析
得到测序原始数据后,过滤获得高质量读长,再将其比对到甜瓜参考基因组DHL92(v4.0)(http://cucurbitgenomics.org/ftp/genome/melon/DHL92/v4.0/)上,筛选差异表达基因并标注集合[7]。采用集群分析R语言包、基因本体(gene ontology, GO)功能注释、京都基因和基因组数据库(Kyoto Encyclopedia of Genes and Genomes, KEGG)富集分析等方法对差异表达基因进行富集和功能分析[8]。
1.6.3 基因共表达与互作分析
对处理组差异表达基因数量进行共表达统计,并找到对应的富集通路以进行互作分析。蛋白质-蛋白质互作(protein-protein interaction, PPI)网络分析可视化基于蛋白质互作数据库STRING(https://cn.string-db.org/),即将甜瓜共有差异基因通过以上数据库分析后选取同源性最高的拟南芥基因进行后续分析。采用Cytoscape 软件建立互作网络并进行k均值聚类算法分析,得到各处理组间共有差异基因富集通路,并获得候选基因。
1.7 RT-qPCR 扩增
根据MELO3C021057(RIN4)基因的编码序列,利用qPrimerDB 网站(https://biodb.swu.edu.cn/qprimerdb/)设计引物M21057-F/R,产物大小为80~150 bp。设计完成后,在葫芦科数据库CuGenDB(http://cucurbitgenomics.org/v2/)检测引物的特异性,内参基因引物选择actin-F/R,引物均由浙江有康生物科技有限公司合成。每个反应设置3个生物学重复,3次技术重复。RT-qPCR扩增在不含核糖核酸酶的PCR管中进行:RT-qPCR酶10 µL,cDNA(250 ng/µL)2 µL,M21057-F/R(10 µmol/L)各0.8 µL,加水补足至20 µL。扩增程序:95 ℃预变性60 s;60 ℃退火30 s,95 ℃变性15 s,40个循环。引物序列如下:M21057-F,5´-TCATCGACAATTCACATGAAGC-3´;M21057-R,5´-CCTCTCATGAGTGGTAGGTTTT-3´;actin-F,5´-ATGGTCAAGGCTGGATTTGC-3´;actin-R,5´-TGAGCTTCATCACCAACATAGGC-3´。
采用2-ΔΔCT法[9]计算基因相对表达量,采用SPSS 23.0软件中的独立样本t检验对数据进行差异显著性分析,以P<0.05和P<0.01表示差异有统计学和高度统计学意义。
2 结果与分析
2.1 pCB301-CABYV 侵染后甜瓜病情鉴定
2.1.1 接种pCB301-CABYV 后甜瓜叶片症状
对接种pCB301-CABYV 后的‘西州蜜’进行病情鉴定,如图1所示:在接种后0~20 dpi内,叶片病征逐渐变化,5 dpi时甜瓜叶片出现小部分叶片增厚和不规则褪绿黄斑,10 dpi时叶片局部略微褪绿,15 dpi时叶片边缘逐步黄化、出现明黄色,20 dpi时整个叶面明显褪绿但叶脉仍为绿色,且叶片明显增厚。
2.1.2 叶片中CABYV 的CP基因表达与鉴定
由2.1.1 节可知,pCB301-CABYV 侵染甜瓜20 dpi 时叶片发病明显,为进一步确定pCB301-CABYV侵染情况,分别取0 dpi、5 dpi、10 dpi、15 dpi、20 dpi 的发病叶片与阴性对照叶片,以其cDNA 为模板,用CP-F/R 引物进行RT-qPCR 扩增。琼脂糖凝胶电泳分析结果显示:阴性对照组未显示条带,20 dpi 处理组中大部分可见750 bp 左右的目的条带,说明在接种病毒后的植株中存在CABYV的CP基因(图2)。

图2 20 dpi时甜瓜叶片中CABYV的CP基因扩增情况Fig.2 Amplification of CP gene of CABYV in melon leaves at 20 dpi
2.1.3 叶片中CABYV 含量测定
ELISA 结果发现,接种pCB301-CABYV 的甜瓜发病叶片中CABYV含量超过阈值的植株与RTqPCR检测的结果基本一致(图3)。

图3 被侵染甜瓜叶片中CABYV含量的ELISA结果Fig.3 ELISA results of CABYV contents in the infected melon leaves
2.2 差异表达基因鉴定结果
利用Illumina高通量测序技术对以上样品进行转录组测序,结果显示:平均每个样本产生42 900万个读长,转录组比对率为94.96%~96.52%,Q20(碱基错误识别概率小于1%)均在96.5%以上,Q30(碱基错误识别概率小于0.1%)均在90.8%以上。主成分分析(principal component analysis, PCA)和皮尔逊相关系数可用于评估组间差异以及同组内样本重复情况。本实验中,各样本皮尔逊相关系数均超过0.900(图4A),表明组内各样本聚合情况良好,样本质量较好;PCA 表明不同组间的样本较为分散,而组内各个样本聚合良好(图4A),可用于后续实验。
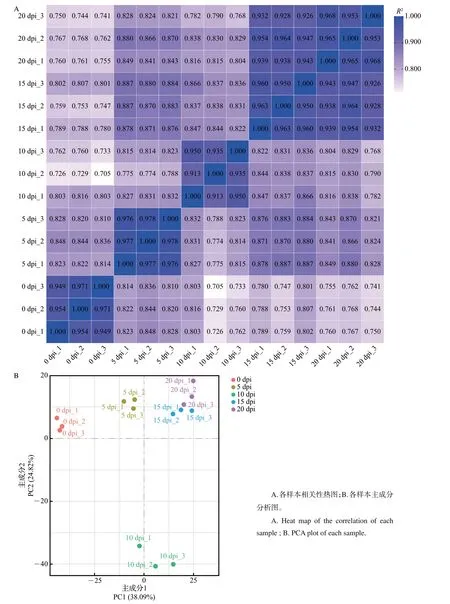
图4 各转录组样本的相关性分析与主成分分析Fig.4 Correlation and PCA analyses of samples for transcriptome
通过比对和统计分析发现,相比0 dpi 处理组,pCB301-CABYV 侵染甜瓜后5 dpi、10 dpi、15 dpi、20 dpi 时的差异表达基因分别有4 548、5 702、5 422、5 959个。其中,在5 dpi、10 dpi、15 dpi、20 dpi时下调的差异表达基因分别有2 666、2 642、3 045、3 391个,上调的差异表达基因分别有1 882、3 060、2 377、2 568个(图5)。

图5 pCB301-CABYV 侵染甜瓜后各组间的差异表达基因数Fig.5 Numbers of DEGs in melon inoculated with pCB301-CABYV between groups
2.3 20 dpi 时差异表达基因富集分析
在GO 功能注释和KEGG 通路中,均以padj≤0.05 表示显著富集。对0 dpi 与20 dpi 处理组的差异表达基因进行富集分析发现,GO 功能主要富集在翻译、肽代谢过程、肽生物合成过程、酰胺生物合成过程、细胞酰胺代谢过程、胺代谢过程、二糖代谢过程、核糖体、核糖核蛋白复合体、无膜结合的细胞器、胞内无膜结合的细胞器、胞质部分、细胞质、核糖体的结构成分、结构分子活性、淀粉酶活性等通路(图6A);KEGG功能显著富集在植物-病原互作、核糖体、苯丙烷生物合成、苯丙氨酸代谢、乙醛酸盐和二羧酸盐代谢等通路(图6B)。

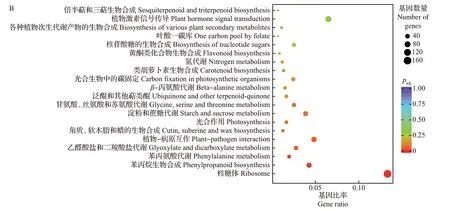
图6 0 dpi与20 dpi处理组差异表达基因GO功能注释(A)和KEGG富集分析(B)Fig.6 GO function annotation (A) and KEGG enrichment analysis (B) of DEGs between 0 dip and 20 dpi treatment groups
2.4 接种后不同时间点共有差异表达基因分析
由维恩图可知,5 dpi vs 0 dpi、10 dpi vs 0 dpi、15 dpi vs 0 dpi、20 dpi vs 0 dpi 4组间共有显著差异表达基因1 654个(图7A),其中上调基因677个,下调基因977个。对4组共有差异表达基因进行富集分析,GO 功能注释显示这些基因多富集于胺代谢过程、激素水平调节、激素代谢过程、类囊体、类囊体部分、类囊体膜、光合膜、膜的外在成分、钙离子结合、辅酶结合等通路(图7B);KEGG富集分析显示这些基因主要集中在植物-病原互作、淀粉和蔗糖代谢、光合作用、类胡萝卜素生物合成和光合作用-天线蛋白等通路(图7C)。这些差异表达基因通路与植物受到病原体侵染及植物免疫机制有着密切联系,推测甜瓜接种pCB301-CABYV 后激活了植物-病原互作通路,从而影响钙离子调节。除此之外,所涉及的光合作用和类胡萝卜素生物合成通路可能与甜瓜被CABYV侵染后的叶片黄化症状有关。
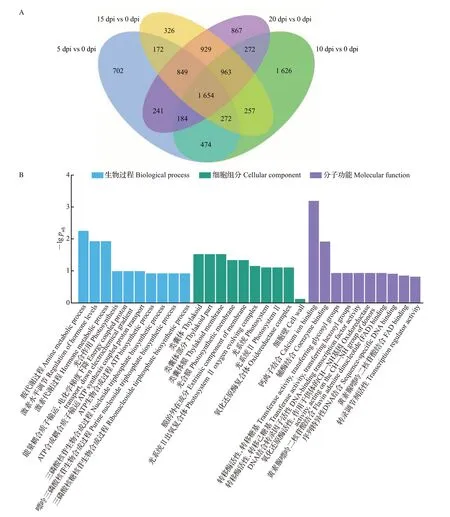
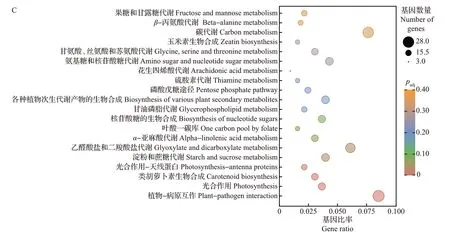
图7 不同处理组间共有显著差异表达基因分析Fig.7 Analysis of significantly shared DEGs between groups
利用Cytoscape 软件对组间共有显著差异表达基因进行蛋白质互作(PPI)网络可视化分析,建立互作网络并进行k均值聚类算法分析,发现富集在植物-病原互作通路中的蛋白有13 个(图8)。其中,KCS2和KSC11 均为酮酰辅酶A 合成酶2(keto-acyl CoA synthase 2, KCS)家族成员,参与超长链脂肪酸(very long chain fatty acids, VLCFA)的生物合成,与逆境胁迫和抗病有关[10]。CAM7、CML41、AT1G18210、CML42、ATCP1、CNGC18 与AT1G24620 可调节各种钙离子通道活性及酶调节活性,主要参与对病原的防御反应,另外CNBT1参与脱落酸与茉莉酸的反应。RIN4是与植物免疫受体蛋白RPM1(resistance toPsudomonas syringaepv.maculicola 1)相互作用的关键基因,已有研究显示该基因编码的蛋白复合体可能为来自病原体Ⅲ型效应子(毒力因子)的毒力靶点,RIN4的过表达抑制了与效应蛋白AvrRpt2功能相关的多种表型,也抑制了病原体相关分子模式(pathogen-associated molecular pattern, PAMP)诱导的防御信号[11]。CPK2、CPK6 与脱落酸激活信号通路有关,且负责气孔开放的调控[12]。

图8 共有显著差异表达基因植物-病原互作网络Fig.8 Plant-pathogen interaction network of significantly shared DEGs
本研究发现,在pCB301-CABYV侵染过程中,KCS家族基因表达下调,参与各种钙离子通道与病原防御反应的关键基因在整个过程中表达量呈下调趋势,推测‘西州蜜’受到CABYV 侵染后使KCS家族基因的表达整体下调。此外,RIN4作为病原防御反应的关键基因,编码毒力靶点蛋白复合体,可激活免疫反应使植物抗病,其可能与甜瓜响应pCB301-CABYV侵染有关。
2.5 RIN4 的RT-qPCR 分析结果
根据PPI网络推测MELO3C021057(RIN4)是植物-病原互作通路中的重要基因,因此对样本接种后在5 个时间节点(0 dpi、5 dpi、10 dpi、15 dpi、20 dpi)进行取样,检测MELO3C021057(RIN4)在叶片中的表达情况。
RT-qPCR 结果显示,接种前(0 dpi)MELO3C021057表达量最高,随着侵染时间的推移,MELO3C021057相对表达量显著降低(图9)。结合差异表达基因富集在植物-病原互作通路上的结论与该基因的RT-qPCR 分析结果,推测MELO3C021057(RIN4)可能是参与响应pCB301-CABYV 侵染的基因,且负调控CABYV 侵染的响应。
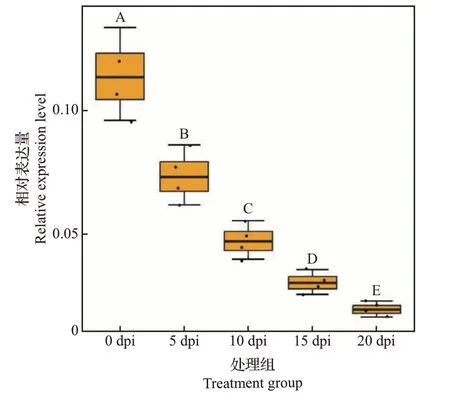
图9 CABYV侵染后甜瓜MELO3C021057基因在5个时间点的相对表达量Fig.9 Relative expression levels of MELO3C021057 in melon inoculated by CABYV at five time points
3 讨论与结论
甜瓜抗病毒病机制涉及通路较多,尤其是虫传病毒病的免疫响应受多方面调控。利用侵染性克隆载体pCB301-CABYV 接种甜瓜以模拟CABYV侵入甜瓜幼苗,可排除昆虫取食的潜在干扰,更加准确地解析甜瓜对CABYV侵染的响应机制。本研究对接种pCB301-CABYV 后5 个时间点(0 dpi、5 dpi、10 dpi、15 dpi、20 dpi)的甜瓜植株进行转录组分析,鉴定出1 654个共有显著差异表达基因,其中上调基因677个,下调基因977个。
为抵抗病原微生物的侵害,植物在长期的进化中形成了一系列复杂而有效的保护机制。本研究对甜瓜接种pCB301-CABYV后的叶片进行差异表达基因富集分析,发现在GO 分析中差异表达基因多富集于钙离子结合与胺代谢过程通路。植物在感知病原入侵后,启动并协调免疫反应,而细胞质钙离子浓度升高是植物免疫中早期反应之一,同时也是触发下游免疫信号传导的关键因子[13]。有研究表明,钙离子信号可激活植物免疫通路,同时钙离子受体也可作为免疫抑制的核心[14]。胺代谢过程通路中,金属结合分子烟草胺在锌离子运输过程中起关键作用,烟草胺对于根到叶的金属离子的转运至关重要[15]。有研究表明,锌元素可以参与植物的免疫反应,通过调节植物内源性抗生物素或激素的水平,以此来提高植物对病原微生物的抵抗力[16]。在钙离子通路与胺代谢通路中,可能存在与甜瓜抗CABYV 性状密切相关的基因,未来还需要进一步验证。
植物天然免疫是模式识别受体对保守的病原体相关分子模式的识别,以及抗病蛋白对效应蛋白的识别。植物与病原体互作时普遍存在多种信号通路,其中信号分子起着关键的调节作用,并决定着植物与病原体之间的竞争[17]。目前已鉴定出大量植物-病原互作信号分子,其功能也在被进一步揭示[18]。本研究的KEGG分析中,甜瓜响应CABYV侵染的共有显著差异表达基因主要富集于植物-病原互作通路,在该通路中,KCS 家族基因及参与钙离子通道与病原防御反应的相关基因在整个侵染过程中表达量呈下调趋势,同时,编码毒力靶点(RPM1 互作蛋白)的RIN4基因表达量显著下调。有研究表明RPM1 被毒力因子AvrRpm2 核糖化后可激活RPM1 介导的植物抗性[11],植物内源的去乙酰化酶通过去乙酰化RIN4干扰或抑制植物的先天免疫[19],因此推测MELO3C021057(RIN4)是响应CABYV侵染的关键基因。
本研究鉴定到多个响应pCB301-CABYV 侵染的重要差异表达基因,并分析了这些基因的主要富集通路(如植物-病原互作),其中在植物-病原互作通路中发现与植物抗病、免疫相关的基因表达量呈下调趋势,这可能与甜瓜对CABYV的感病有关,后续工作中可进一步进行关键基因验证,探究相关基因调控甜瓜响应CABYV 的分子机制,也可利用基因编辑技术靶向病毒侵染或复制所需的植物内源基因,以创制新的抗病毒种质资源[20]。
