中国小麦花叶病毒富含半胱氨酸蛋白多克隆抗体的制备与应用
2023-11-14戴远兴郭留明何婧沈峥嵘耿艳飞吕明芳袁正杰李静张恒木
戴远兴,郭留明,何婧,沈峥嵘,耿艳飞,吕明芳,袁正杰,李静,张恒木*
(1.浙江师范大学生命科学学院,浙江 金华 321004;2.浙江省农业科学院病毒学与生物技术研究所,浙江 杭州 310021)
中国小麦花叶病毒(Chinese wheat mosaic virus,CWMV)是浙江省农业科学院与复旦大学等单位于20 世纪90 年代末在我国冬小麦区发现并命名的一种土传病毒[1-2]。根据其传播特性、病毒粒子形态、基因组序列等特征,国际病毒分类委员会已将其划归为帚状病毒科(Virgaviridae)真菌传杆状病毒属(Furovirus)。CWMV 是我国土传小麦花叶病的重要病原体之一,在自然条件下常与小麦花叶病的另一种病原体——小麦黄花叶病毒(wheat yellow mosaic virus, WYMV)复合侵染,产生协同效应,加重小麦花叶病症状,发病严重的植株发育迟缓,甚至枯萎死亡[3]。在田间,CWMV 与其他麦类土传病毒相似,均由根部专性寄生的禾谷多黏菌(Polymyxa graminis)传播[4-5],并可在介体休眠孢子中存活多年,因此,植株一旦发病,往往难以根除。CWMV通常可导致小麦减产10%~30%,严重时可达到70%以上[1,6]。因此,加强CWMV特性的研究将有助于对该类病害的科学防控。
CWMV 基因组由2 条单链正义RNA 分子组成,根据其大小分别命名为RNA1 和RNA2,其中,RNA1 编码病毒复制酶相关蛋白和病毒运动蛋白(movement protein, MP)[2,7-8],RNA2则编码3个外壳相关蛋白和1 个具有RNA 沉默抑制子活性的富含半胱氨酸蛋白(cysteine-rich protein, CRP)[2,9-10]。近年来,随着CWMV 反向遗传学平台的建立[11-12],CWMV 侵染及其与寄主的互作研究取得了一系列进展[7,13],并发现CRP 是一个磷酸化蛋白,以磷酸化形式在CWMV 侵染过程中发挥功能[14]。许多植物病毒也编码具有RNA 沉默抑制子活性的CRP类病毒蛋白,其中对大麦条纹花叶病毒(barley stripe mosaic virus, BSMV)γb 蛋白的功能研究尤为深入,它除了充当基因沉默抑制子,还通过磷酸化、棕榈酰化、泛素化修饰等方式参与病毒与寄主的相互作用[15-17]。这些研究结果表明,CWMV CRP在病毒侵染过程中也可能具有更多的功能特性,然而,其高质量抗体的缺乏在一定程度上限制了对CWMV CRP自身特性及其多功能特性的研究。因此,本研究克隆了CWMV CRP 基因,并利用原核表达体系表达重组CRP以用于制备特异性抗体,为后续CRP水平检测和亚细胞定位等研究提供依据。
1 材料与方法
1.1 实验材料
CWMV侵染的小麦叶片样品采自山东田间冬小麦,大麦黄矮病毒(barley yellow dwarf virus, BYDV)、番茄花叶病毒(tomato mosaic virus, ToMV)、芜菁花叶病毒(turnip mosaic virus, TuMV)等病株材料均由本实验室保存。双元表达载体pCV-35S::3×Flag、烟草脆裂病毒(tobacco rattle virus, TRV)表达载体TRV::3×Flag、马铃薯X病毒(potato virus X, PVX)表达载体PVX::3×Flag 皆由本实验室前期构建并保存。
1.2 引物设计
根据美国国家生物技术信息中心(National Center for Biotechnology Information, NCBI)中CWMV RNA2 序列(GenBank 登录号:AJ271839)设计引物(表1),并由浙江有康生物科技有限公司合成。

表1 用于聚合酶链反应扩增的引物Table 1 Primers used for polymerase chain reaction amplification
1.3 原核表达载体的构建
采用TRIzol试剂盒(美国Thermo Fisher Scientific公司)提取CWMV侵染的小麦叶片总RNA,并应用随机引物在反转录酶(南京诺唯赞生物科技股份有限公司)作用下合成cDNA,然后通过高保真酶KOD FX(日本TOYOBO公司)进行反转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)扩增。扩增体系(50 μL):KOD FX 2×PCR缓冲液25 μL、dNTPs(2 mmol/L)10 μL、引物对pET-CRP-F/pET-CRP-R(均为10 pmol/μL)各1.5 μL、cDNA 模板1 μL、KOD FX(1.0 U/μL)1 μL、ddH2O 10 μL。扩增条件:94 ℃预变性3 min;98 ℃变性10 s,54 ℃退火30 s,68 ℃延伸30 s,32 个循环。利用限制性内切酶BamHⅠ和SacⅠ(美国NEB公司)对原核表达载体pET-32a(美国Novagen公司)进行双酶切线性化处理,然后将扩增并纯化的目的片段通过In-Fusion克隆技术连接到线性化载体上,并转化大肠埃希菌DH5α感受态细胞(北京博迈德基因技术有限公司),挑取12个菌落,使用载体引物T7/T7-ter(表1)进行PCR 鉴定后,选取其中3 个PCR 阳性克隆进行质粒提取和酶切鉴定,最后将获得的候选阳性克隆质粒pET-CRP 送至浙江有康生物科技有限公司进行测序验证。
1.4 重组蛋白表达与纯化
将鉴定正确的重组质粒pET-CRP 转入大肠埃希菌BL21(DE3)感受态细胞(北京博迈德基因技术有限公司),取部分菌液涂布于含氨苄抗生素的LB(Luria-Bertani)固体培养基上,次日挑取生长良好的单克隆到含氨苄抗生素的LB 液体培养基中,在37 ℃、200 r/min条件下振荡培养至D(600 nm)≈0.6后,加入1 mmol/L 异丙基硫代-β-D-半乳糖苷(isopropylthio-β-D-galactoside, IPTG)(北京索莱宝科技有限公司),继续培养1~3 h 后,在室温下以5 000 r/min离心10 min,回收菌液,用磷酸盐缓冲液(phosphate buffered saline, PBS)重悬菌体,并于冰浴下采用超声波进行破碎,以4 ℃、12 000 r/min 离心后,分别收集沉淀和上清液,按照镍柱亲和层析试剂盒说明书(北京启研生物科技有限公司)纯化CRP重组蛋白。
1.5 应用蛋白质印迹法(Western blot)检测CRP
参照宗伟等[18]的方法:将0.10 g 植物样品研磨后,加入200 μL细胞裂解液[生工生物工程(上海)股份有限公司]并混匀,30 min 后以4 ℃、12 000 r/min离心10 min;取上清液,加入5×十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis, SDS-PAGE)上样缓冲液(江苏康为世纪生物科技股份有限公司)并沸水浴10 min,取出后冰浴5 min;将获得的蛋白质样品进行SDS-PAGE,电泳后的蛋白胶直接进行考马斯亮蓝染色或通过半干移印系统(美国BIO-RAD公司)转移到硝酸纤维素膜(美国GE公司)上;将膜放到含5%脱脂奶粉(北京索莱宝科技有限公司)的PBS 封闭液中,室温封闭1 h 后,移去封闭液,用PBST[含0.05%吐温-20(Tween-20)的PBS,pH 7.4]清洗3次,然后加入CRP 抗体稀释液(含5%脱脂奶粉的PBS),室温反应1 h后,再用PBST清洗3次,接着加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG(北京全式金生物技术股份有限公司)二抗稀释液(含5%脱脂奶粉的PBS),室温反应1 h后,再次用PBST清洗3次,最后将膜置于超敏ECL 发光液[亚科因(武汉)生物技术有限公司]中,并应用Amersham Imager 600 成像系统(美国GE公司)获取图像信号。
1.6 多克隆抗体的制备与纯化
选择生长和健康状况良好的新西兰白兔,以原核表达纯化的CRP作为抗原进行4次免疫注射。首次免疫注射的抗原质量浓度为1.000 mg/mL,第2—4次免疫注射的抗原质量浓度依次减半,即分别为0.500、0.250、0.125 mg/mL。每次免疫以0.5 mL抗原和0.5 mL弗氏佐剂混合注射,其中,第1次免疫采用完全弗氏佐剂,第2—4次免疫采用不完全弗氏佐剂。每次免疫均对新西兰白兔进行多点皮下注射,每点注射0.2 mL,并在首次免疫间隔14 d 后进行第2 次免疫,然后间隔7 d 进行第3 次免疫,再间隔7 d 后进行血清学检测,合格后进行第4 次免疫,再次间隔7 d 后采集全血以收集血清,最后利用蛋白A亲和层析柱(南京金斯瑞生物科技股份有限公司)从兔抗血清中纯化多克隆抗体。上述实验均遵循国家有关法律和法规中规定的动物福利和伦理原则。
1.7 应用间接酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)法测定抗体效价
参照间接ELISA法[19],用包被缓冲液(0.05 mol/L PBS,pH 9.6)将原核表达纯化的CRP 按0.10 μg/mL加入96 孔酶标板(100 μL/孔),4 ℃包被过夜,次日移去包被缓冲液,每孔加入150 μL封闭液[含2%牛血清白蛋白(bovine serum albumin, BSA)的包被缓冲液],室温孵育2 h后,用PBST清洗3次;用抗体稀释液(含1% BSA 的PBS,pH 7.4)将抗体从1∶1 000(体积比,下同)开始进行倍比稀释,按100 μL/孔分别加入稀释后的抗体,37 ℃孵育1 h 后,再用PBST清洗3 次;按100 μL/孔加入HRP 标记的羊抗兔IgG(北京全式金生物技术股份有限公司)二抗稀释液(用抗体稀释液按1∶10 000 稀释),37 ℃孵育1 h后,再次用PBST 清洗3 次;按100 μL/孔加入单组分3,3´,5,5´-四甲基联苯胺(TMB,北京索莱宝科技有限公司)底物,室温孵育5~20 min 后,每孔加入100 μL终止液(1 mol/L H2SO4),最后在酶标仪上测定在450 nm 波长处的吸光度值。以P/N>3.0 时的抗体稀释比例来判定抗体效价,其中,P为待测样品在450 nm波长处的吸光度值,N为阴性对照样品(免疫前血清)在450 nm波长处的吸光度值。
1.8 应用斑点ELISA 法测定CRP 抗体灵敏度
参照文献[20]的方法:将2 μL蛋白质样品点样至硝酸纤维素膜(美国GE公司)上,每个样品3次重复,点样结束后将膜于室温下干燥,然后置于含5%脱脂奶粉的PBS 封闭液中,室温封闭1 h;移去封闭液,用PBST 清洗3 次,然后置于CRP 抗体稀释液(含5%脱脂奶粉的PBS)中,室温反应1 h 后,再用PBST 清洗3 次;接着加入碱性磷酸酶(alkaline phosphatase, AP)标记的羊抗兔IgG 二抗稀释液(含5%脱脂奶粉的PBS),室温反应1 h后,再次用PBST清洗3 次,最后采用BCIP/NBT 碱性磷酸酶显色试剂盒(江苏康为世纪生物科技股份有限公司)进行显色反应。
1.9 植物表达载体的构建与农杆菌浸润
采用高保真酶KOD FX 并以重组质粒pETCRP 为模板进行PCR 扩增,构建瞬时表达载体pCV-35S::CRP-3×Flag、TRV::CRP-3×Flag 和PVX::CRP-3×Flag。PCR 扩增体系和扩增条件参照原核表达载体的构建方法(1.3 节)。利用限制性内切酶BamHⅠ/SacⅠ、PstⅠ/SacⅠ和ClaⅠ/SacⅠ(美国NEB公司)分别对双元表达载体pCV-35::3×Flag、病毒表达载体TRV::3×Flag 和PVX::3×Flag 进行双酶切线性化处理,然后将纯化的PCR 产物通过In-Fusion克隆技术连接到线性化载体上,经测序比对正确后电击转化农杆菌GV3101感受态细胞。挑取转化后的单克隆到含有卡那霉素和利福平的酵母膏蛋白胨(yeast-extract peptone, YEP)液体培养基中,以28 ℃、200 r/min振荡培养过夜,次日吸取100 μL菌液至10 mL新鲜的YEP液体培养基(含相应抗生素)中,继续振荡培养至D(600 nm)≈1,然后将菌液在室温下以5 000 r/min离心3 min,弃上清液,加入适量的烟草浸润液[含200 μmol/L乙酰丁香酮(acetosyringone,AS)、10 mmol/L MgCl2和1 mmol/L 2-吗啉乙磺酸(2-morpholinoethanesulfonic acid, MES)],重悬,调节至D(600 nm)=0.6,并室温避光静置2 h。挑取生长状态良好的本氏烟(Nicotiana benthamiana)植株,通过农杆菌浸润法[21],用1.0 mL 注射器将含双元表达载体pCV-35::CRP-3×Flag 和病毒表达载体PVX::CRP-3×Flag的农杆菌分别注射至本氏烟的背面,而含病毒表达载体TRV::CRP-3×Flag 的农杆菌需与含TRV1 的农杆菌共注射本氏烟,使其在本氏烟叶片中瞬时表达。接种结束后,将本氏烟置于22~25 ℃、16 h光照/8 h黑暗条件下继续培养,备用。
2 结果与分析
2.1 CWMV CRP 的表达纯化
将重组质粒pET-CRP 转入大肠埃希菌BL21(DE3)感受态细胞,挑取生长良好的单克隆,加入IPTG 诱导1~3 h 后进行SDS-PAGE。考马斯亮蓝染色结果显示:经IPTG 诱导1~3 h 后均出现一条与预期蛋白大小一致的特异性条带(约34 kDa)(图1A,泳道3~5),且诱导2 h 后大肠埃希菌菌体中融合蛋白表达效果已比较理想,而在经IPTG 诱导的含空载体pET-32a 的大肠埃希菌菌体及未经IPTG诱导的含重组质粒pET-CRP的大肠埃希菌菌体中均未见对应的条带(图1A,泳道1~2);同时,通过镍柱亲和层析纯化后可见单一的CRP 融合蛋白条带(图1A,泳道6),表明已成功获得纯化的CRP重组蛋白。

图1 应用SDS-PAGE和蛋白质印迹法分析CRP重组蛋白的表达(A)和CRP抗体的特异性(B、C)Fig.1 SDS-PAGE analysis of recombinant CRP (A) and specificity analysis of the antibody against CRP by Western blot (B, C)
2.2 CRP 抗体特异性分析
利用纯化的CRP作为抗原免疫新西兰白兔,收集抗血清并纯化。为了分析该多克隆抗体的特异性,首先利用纯化的抗体对重组蛋白进行蛋白质印迹法分析。在经IPTG 诱导表达的大肠埃希菌菌体中,仅在含重组质粒pET-CRP菌株样品中检测到单一的条带(约34 kDa)(图1B,泳道2),与预期的CRP 重组蛋白大小相符,而在含空载体pET-32a 的大肠埃希菌菌体中未检测到任何明显的条带,表明所制备的抗体能特异性识别CRP 重组蛋白。为了进一步分析该抗体的特异性,又将其用于多种植物病毒侵染样品的检测分析,结果仅在CWMV 侵染的小麦叶片样品中检测到单一的条带(约19 kDa)(图1C,泳道2),而在健康小麦叶片、BYDV 侵染的小麦叶片、ToMV 和TuMV 侵染的本氏烟叶片中均未检测到任何条带(图1C,泳道1,3~5)。以上对CRP重组蛋白及病株体内蛋白的检测结果均表明,本研究所制备的多克隆抗体不仅能特异性识别原核表达的CRP重组蛋白,而且能特异性识别CWMV侵染的小麦叶片中的CRP。
2.3 CRP 抗体效价测定
为了分析CRP 抗体的效价,以0.10 μg/mL CRP重组蛋白作为靶标,以免疫前血清为对照,利用梯度稀释的抗体,通过间接ELISA法比较分析纯化与未纯化抗体的效价,结果如图2 所示。未纯化的CRP 抗体效价为1∶1 024 000(图2A);而纯化的CRP抗体效价高达1∶4 096 000,是未纯化抗体效价的4倍(图2B)。在效价测定的基础上,进一步利用梯度稀释的抗体对CWMV 病株叶片总蛋白样品进行蛋白质印迹法分析,结果(图3)显示,当抗体被稀释至1∶120 000 后仍能在CWMV 病株叶片总蛋白样品中检测到清晰的杂交信号,表明本研究所制备的抗体不仅具有高度的特异性,而且具有较高的效价。

图2 应用间接ELISA法分析未纯化与纯化CRP抗体的效价Fig.2 Analysis of titers of unpurified and purified CRP antibodies by indirect ELISA
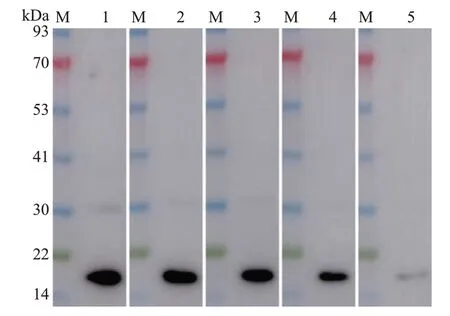
图3 利用梯度稀释抗体的蛋白质印迹法分析CWMV病株叶片总蛋白样品Fig.3 Western blot assay of total protein samples extracted from CWMV-infected plant leaves using the gradient dilution antibodies
2.4 CRP 抗体灵敏度检测
为了检测纯化的CRP抗体的灵敏度,将质量浓度为256 ng/μL的CRP重组蛋白依次进行倍比稀释,并分别取2 μL 点样至硝酸纤维素膜上进行斑点杂交,结果如图4 所示。纯化的CRP 抗体不能识别BSA(对照),即使在未被稀释的BSA中也检测不到杂交信号;但纯化的CRP 抗体能特异性识别CRP重组蛋白,即使CRP 重组蛋白被稀释到0.5 ng/μL时仍能够检测到清晰的杂交信号;当其被稀释至0.25 ng/μL 时可检测到微弱的杂交信号。这表明CRP 抗体的灵敏度至少可达到0.5 ng。进一步以1∶80 000 稀释的CRP 抗体为一抗对纯化的CRP 重组蛋白进行蛋白质印迹法分析,结果显示,当CRP重组蛋白上样量仅为0.5 ng时仍然能检测到单一且清晰的预期条带(图5A),说明该抗体具有较高的灵敏度。以相同稀释比例(1∶80 000)的抗体检测梯度稀释的CWMV 病株叶片总蛋白样品,结果显示,CWMV病株叶片总蛋白被稀释12倍后仍然能够检测到单一的CRP条带(图5B),表明本研究所制备的抗体能识别天然的CRP,且具有较高的灵敏度。

图4 应用斑点ELISA法分析CRP抗体的灵敏度Fig.4 Sensitivity analysis of CRP antibodies by dot ELISA
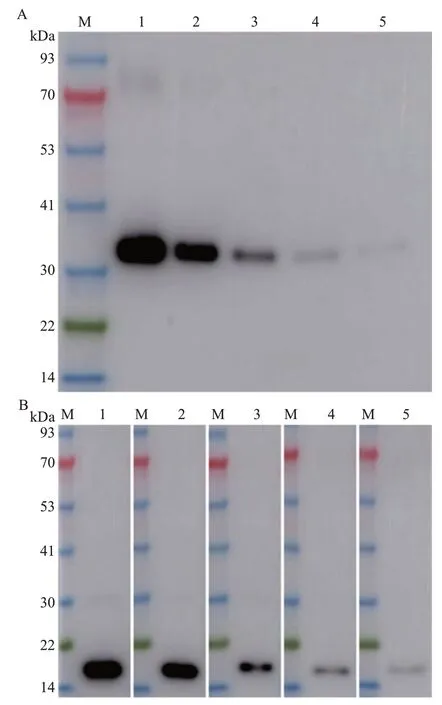
图5 应用蛋白质印迹法分析CRP抗体的灵敏度Fig.5 Sensitivity analysis of CRP antibodies by Western blot
2.5 基于CRP 抗体的田间样品检测与诊断
在田间,CWMV侵染的小麦病株症状常受小麦品种、病毒株系和气候条件等的影响,且导致小麦花叶病的因素复杂多样,单纯地依靠症状来直接判断是否存在CWMV 侵染较为困难。作为侵染过程中重要的病毒蛋白之一,CWMV CRP与外壳蛋白(coat protein, CP)一样能在实验寄主(模式植物本氏烟)和田间寄主植物中高水平表达,这为把CRP特异性抗体应用于CWMV 检测及对该病害的早期预警提供了理论依据。为了调查CRP抗体在CWMV检测中的应用效果,本研究分别对田间采集的小麦叶片样品进行蛋白质印迹法和RT-PCR检测,结果如图6所示。在应用蛋白质印迹法检测的9个田间小麦叶片样品中,有7个样品(泳道1~3,5~8)检测到特异性杂交信号,为CWMV阳性病株,有2个样品(泳道4,9)未检测到杂交信号(图6A),为CWMV 阴性植株,与RT-PCR 检测结果(图6B)一致。以上结果表明,CRP抗体能够特异性地检测CWMV侵染的小麦病株,并具有与RT-PCR检测相当的准确度。

图6 应用蛋白质印迹法(A)和RT-PCR(B)检测田间小麦病株Fig.6 Detection of the diseased wheat plants from fields by Western blot (A) and RT-PCR (B)
2.6 基于CRP 抗体的CRP 瞬时表达检测
在蛋白质功能研究实验中,常常利用双元表达载体或病毒表达载体在植物体内瞬时表达靶标蛋白。为了进一步分析本研究所制备的抗体能否应用于CRP的瞬时表达研究,参照YUAN等[21]的方法构建3 种表达载体,分别为pCV-35S::CRP-3×Flag、TRV::CRP-3×Flag、PVX::CRP-3×Flag,并通过农杆菌浸润法注射本氏烟,使其在本氏烟叶片中瞬时表达,然后提取叶片总蛋白进行蛋白质印迹法分析。如图7A所示,在3种表达载体浸润的样品中均能够灵敏且特异性地检测到一条与预期大小一致的条带,而在对照样品中未检测到杂交信号,表明所构建的双元表达载体和病毒表达载体均能介导CRP的表达(图7A),同时,该抗体还可用于分子实验过程中植物体内瞬时表达CRP的检测与分析,并且检测效果与商业化的Flag标签抗体相当(图7B)。
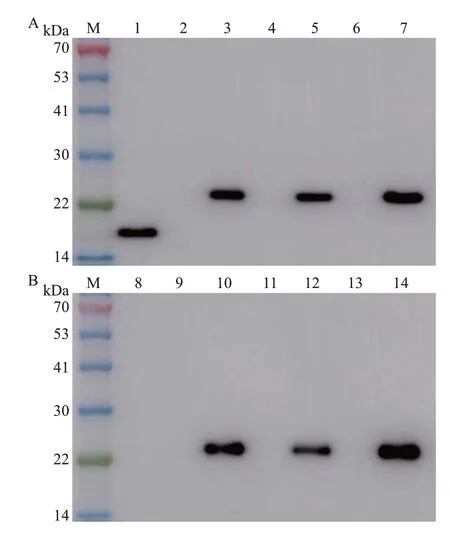
图7 应用蛋白质印迹法检测在本氏烟叶片中瞬时表达的CRPFig.7 Detection of CRP by transient expression in N.benthamiana leaves using Western blot
3 讨论
CWMV 编码的CRP 是一种重要的病毒蛋白。自CWMV被首次鉴定出后,CRP抗体制备工作就受到了重视[22-23],但可能由于条件等因素限制,前期所制备的单克隆抗体和多克隆抗血清的效价都较低。由于CRP是CWMV编码的一个非结构蛋白,不能通过提纯病毒粒子的方式获得有效抗原,因此,为了制备更高质量的抗体,本研究主要从以下几方面进行了改进:1)选用高水平原核表达载体(pET-32a)系统,其表达的目的CRP 量可达到菌株总蛋白量的10%以上,为获得足量的抗原提供了条件;2)采用镍柱亲和层析方法纯化CRP 重组蛋白,其在SDSPAGE中的电泳条带和蛋白质印迹法中的印迹条带信号均强且单一,保障了抗原的纯度;3)在保证抗原浓度与纯度的基础上,采用了先后间隔14、7、7 d的方式对新西兰白兔进行4 次多点皮下注射免疫,保证了免疫的强度和次数;4)收集的抗血清通过蛋白A 亲和层析柱进一步纯化,提高了抗体的纯度。本实验结果表明,这些改进措施不同程度地提高了抗体的质量,所制备的抗体效价提高了2~3个数量级,且具有高度特异性,即使在稀释100 000倍以上的情况下应用蛋白质印迹法仍可高效地识别天然的CRP,这也是目前针对CWMV CRP 效价很高的抗体。另外,高质量抗体的获得可能也与CWMV CRP自身良好的抗原性相关,计算机预测显示,CRP等电点较高(约为9.2),且存在丰富的抗原决定簇(数据待发表)。
CWMV 作为我国土传小麦花叶病的重要病原体之一,外壳蛋白(CP)在病株体内含量丰富且参与病毒粒子组装[12],因此,当前血清学检测CWMV 的方法多以CP为靶标而发展建立[22,24-27]。从本研究结果来看,CRP 是一种良好的抗原,在CWMV 病株中CRP 明显比运动蛋白、病毒复制酶蛋白、N-CP/CP通读蛋白易于检测[12,28-29],是CWMV 病株中含量较为丰富的一种病毒蛋白;同时,由于多克隆抗体自身在抗原检测上存在一定的优势[30],因此,本研究所制备的高质量抗体可为CWMV 侵染小麦的血清学检测与诊断提供一种新的选择。在瞬时表达CRP的实验中,CRP 在植物体内显示出良好的稳定性,在蛋白质印迹法图谱中未发现信号降解,且不论是在病毒表达载体上,还是在花椰菜花叶病毒(cauliflower mosaic virus, CaMV)35S组成型启动子控制条件下,CRP 都表现出较为丰富的积累量,这可能与其基因沉默抑制子活性有关[10]。总之,本研究所制备的高质量CRP 抗体既可特异性识别病株体内的天然CRP,也可识别植物体内瞬时表达的CRP,这为后续利用该抗体开展CRP免疫胶体金标记、免疫荧光染色等亚细胞定位实验来分析CRP功能和CWMV侵染机制提供了依据。
