植物雷帕霉素靶蛋白激酶研究进展
2023-11-14陈文臻刘佳琦都浩
陈文臻,刘佳琦,都浩*
(1.浙江大学农业与生物技术学院现代种业研究所,浙江 杭州 310058;2.浙江大学海南研究院,海南 三亚 572025)
1964年,来自加拿大的药物勘探者在拉帕努伊(Rapa Nui),又称复活节岛,采集了一些土壤样本;随后,Wyeth-Ayerst 研究所的研究人员从该土壤样本的吸湿性链霉菌中分离出一种抗真菌物质,根据其发现地命名为雷帕霉素(rapamycin)[1]。进一步的研究发现,雷帕霉素的分子结构与一种被称作FK506的免疫抑制药物相似,并且具有类似的功效,都能够阻止T 细胞的激活和增殖,但两者的作用机制不相同[2]。HEITMAN等通过在酵母中实验发现,雷帕霉素与FK506 存在竞争关系,两者都可以与FK506 结合蛋白(FK506 binding protein, FKBP)结合,并且缺失编码FKBP蛋白基因FPR1的酵母对雷帕霉素表现出显著的抗性;进一步通过遗传突变筛选实验,鉴定出了雷帕霉素的作用底物,并将其命名为雷帕霉素靶蛋白(target of rapamycin, TOR)[3]。随后,有4个研究团队相继在哺乳动物细胞中也鉴定出了雷帕霉素的靶点,分别将其命名为雷帕霉素和FKBP12 靶蛋白1(rapamycin and FKBP12 target 1,RAFT1)、FKBP-雷帕霉素相关蛋白(FKBP-rapamycin associated protein, FRAP)、雷帕霉素靶蛋白1(rapamycin target 1, RAPT1)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR),并最终将在哺乳动物中发现的RAFT1/FRAP/RAPT1/mTOR统一命名为mTOR。从发现mTOR至今已有30 多年,对mTOR 的深入研究,逐步揭示了TOR 功能和信号网络的生物学机制[4]。
TOR 属于磷脂酰肌醇-3-激酶相关激酶(phosphatidylinositol-3-kinase related kinase, PIKK)家族的成员,是一种非典型的丝氨酸/苏氨酸蛋白激酶,在几乎所有的真核生物中具有高度保守的结构和功能。TOR 能够感知并整合多种改变细胞状态的信号,包括营养、能量和其他外界信号。通过响应输入信号,TOR 磷酸化使下游底物被激活或失活,从而影响诸多细胞营养感知、蛋白质合成、新陈代谢和自噬等,进而调节真核生物的生长和发育[5]。由于植物无法自主移动,它们在面临各种环境胁迫(包括营养物质的匮乏及植物激素、光强度、病原体、水、温度应激等)时生存会更加艰难,因此,对植物而言,TOR作为一种参与信号和代谢网络的中枢调节因子,通过感知不同的外部或内部信号来调整植物新陈代谢、生长和自噬等反应,从而使植物在这些恶劣的条件下得以生存[6-7]。
在酵母和哺乳动物中对TOR的研究较深入,并发现其在调控生长发育中有重要作用,但在植物中对TOR的研究相对较少,并且主要集中在拟南芥等模式植物中[8-10]。本文主要总结了TOR 信号通路(包括新发现的部分上游效应因子和下游调控路径)研究进展,TOR 在植物生长发育过程中的重要作用,以及TOR 响应环境胁迫的生物学机制,旨在为TOR 在未来的研究方向及其在农业生产中的应用提供参考。
1 TOR 在动植物中的保守性分析
1.1 TOR 在动物中的保守性
1.1.1 哺乳动物中的TOR复合体
虽然大多数哺乳动物的基因组只编码一个TOR基因,但mTOR可以形成2个不同的复合体,分别为mTOR 复合体1(mTOR complex 1, mTORC1)和mTOR 复合体2(mTOR complex 2, mTORC2)。mTORC1的核心组分包括mTOR、mTOR调控相关蛋白(regulatory associated protein of mTOR, Raptor)和哺乳动物致命因子SEC13 蛋白8(mammalian lethal with SEC13 protein 8, mLST8),mTORC2 的核心组分包括mTOR、mLST8 和雷帕霉素不敏感的mTOR伴侣蛋白(rapamycin-insensitive companion of mTOR,Rictor)[11]。mTOR 的结构从N 端到C 端依次是亨廷顿蛋白-延伸因子3-蛋白磷酸酶2A的A亚基-TOR1[Huntington, elongation factor 3, subunit A of protein phosphatase 2A (PP2A) and TOR1, HEAT]重复、FAT(FRAP-ATM-TTRAP)、FKBP-雷帕霉素结合位点(FKBP-rapamycin-binding, FRB)、激酶和FAT-C端(FAT-C terminal, FATC)结构域[12](图1)。
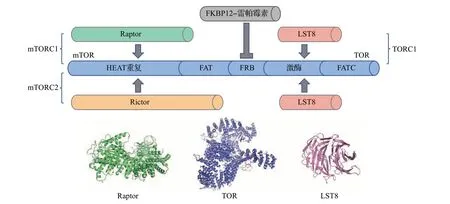
图1 动植物TOR激酶及其复合体亚基结构Fig.1 Animal and plant TOR kinases and their complex subunit structures
2016年,YANG等通过冷冻电镜揭示了mTORC1的结构(一个空心的菱形二聚体结构),其催化中心在菱形凹陷处并位于整个复合体靠中间的位置,Raptor 和mLST8 分别位于菱形的长对角轴和短对角轴上[12]。mTOR的C端区域形成一个紧凑的核心结构域,N 端由16 个HEAT 重复(N-HEAT)形成一系列的螺旋重复,中间区域采用延伸的HEAT 重复(M-HEAT)桥接N-HEAT 和mTOR 的核心结构域。复合物中mTOR 的二聚化是由一个mTOR 的N-HEAT 区域和另一个mTOR 的M-HEAT 区域的分子间相互作用介导的,Raptor 的HEAT 重复与mTOR的M-HEAT的脊区结合,mLST8与mTOR核心结构域相互作用[12]。对mTORC1 蛋白复合体结构的解析为进一步研究真核生物TOR 的生物学功能提供了重要的参考,有助于揭示TOR 在细胞代谢、信号传递、基因表达调控等方面的作用机制。
1.1.2 mTORC1的活性调控
作为哺乳动物细胞生长的主要调节因子,mTOR响应细胞内和细胞外的信号,包括生长因子、核苷酸、氨基酸及能量等。
结节性硬化复合物(tuberous sclerosis complex,TSC)在调控mTORC1 响应生长因子的传递过程中起着重要作用。TSC是由TSC1、TSC2和TBC1结构域家族成员7[Tre2-Bub2-Cdc16 (TBC) 1 domain family member 7, TBC1D7]组成的复合物,可以作为富含于脑中的Ras 同源蛋白(Ras homolog enriched in brain, Rheb)的GTP 酶激活蛋白和mTORC1 的负调节因子[13]。多种信号途径汇聚在TSC 上来调节mTORC1响应生长因子。
细胞内核苷酸的耗竭会通过短期和长期2种不同的感应方式抑制mTORC1的活性。尽管这2种方式都对降低的嘌呤核苷酸水平作出反应,但它们在感知和传导的分子机制方面有所不同。腺苷酸水平的降低能够在短时间内抑制mTORC1的活性,这种传感机制依赖于TSC蛋白复合物及其对mTORC1上游Rheb 的调节;鸟苷酸的长期缺失是通过诱导Rheb 的降解来抑制mTORC1 活性的[14]。具体的分子生物学机制还需要更深入的研究。
在能量胁迫条件下,腺苷一磷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)使mTORC1失活。当腺苷一磷酸(adenosine monophosphate, AMP)水平升高时,AMPK 被激活,并通过激活TSC 和抑制Raptor 来抑制mTORC1 的活性[15]。葡萄糖作为一种基本的能量底物,对于维持能量稳态至关重要。葡萄糖饥饿可以诱发能量胁迫,但葡萄糖感应可能是通过Rag GTP酶介导的[16]。缺氧条件也会抑制mTORC1的活性,低氧条件通过激活AMPK 及发育和DNA 损伤反应调节因子1(regulated in development and DNA damage response 1,REDD1)来抑制mTORC1 的活性,后者被认为是通过激活TSC来抑制mTORC1活性的[17]。
氨基酸通过Rag GTP酶调节mTORC1的活性。Rag GTP酶通过与Raptor相互作用将mTORC1转移到溶酶体,进而被其中的激活剂Rheb所激活。在动物细胞中,存在多种氨基酸传感器,例如,亮氨酸传感器Sestrin2、精氨酸传感器CASTOR、S-腺苷甲硫氨酸传感器SAMTOR等,每种氨基酸传感器结合一种氨基酸或氨基酸衍生分子,并通过Rag GTP 酶将该信号传递到mTORC1 上,促进其在溶酶体上定位[18]。但mTORC1 是否转移到溶酶体表面取决于Rag 核苷酸的装载状态,该状态受到多种机制的严格调节,包括Rag 异二聚体本身的相互作用。为了精确控制mTORC1 的激活,RagA、RagB、RagC 或RagD 通过亚基间相互作用进行通信,从而产生一系列的稳定状态和瞬时状态[19]。因此,这一调节过程对于实现mTORC1 激活的高效性和准确性起到了重要作用。
1.2 TOR 在植物中的保守性
1.2.1 植物中的TOR复合体
与哺乳动物相似,植物TOR的结构从N 端到C端由多个串联的HEAT 重复、FAT、FRB、激酶和FATC结构域组成,形成一个完整的蛋白结构[6]。虽然TOR在植物和哺乳动物中都高度保守,但至今只有TOR复合体1(TOR complex 1, TORC1)在植物中得到了验证,它由进化上保守的TOR、LST8 和Raptor 组成[20](图1)。关于植物中是否存在其他形式的TOR复合体,仍需进一步研究。
研究表明,拟南芥的基因组编码1 个TOR、2 个Raptor(Raptor1A/1B)、2 个LST8(LST8-1/2)。其中,Raptor1B 和LST8-1 在拟南芥中的表达量相对较高[6]。在TOR氨基端的HEAT重复结构域可以通过与Raptor 互作而起到募集TOR 底物的作用,例如,Raptor1B在渗透胁迫中调节核糖体蛋白S6激酶(ribosomal protein S6 kinase, S6K)的活性[21]。拟南芥LST8 可以与TOR 的激酶结构域结合,介导蛋白质之间的相互作用,从而在调控TOR活性过程中发挥重要作用[22]。
研究发现,在正常生长条件下,拟南芥TOR基因的突变会导致胚胎死亡[23],而Raptor基因突变则表现为有条件的致死[24-25],LST8基因突变则可以使拟南芥存活[22]。这些结果表明,植物TOR可能具有不依赖于Raptor 或LST8 来调节植物生长发育的功能。OSHIRO 等研究表明,雷帕霉素作为mTOR 激酶的特异性抑制剂与FKBP12 结合形成复合物,该复合物能够特异性地结合到mTOR 的FRB 结构域上,通过解离Raptor 来抑制mTOR 的活性[26]。但包括拟南芥在内的大多数植物自身的FKBP12不能与FRB 结构域结合,所以雷帕霉素不能抑制拟南芥TOR激酶的活性[21]。植物对雷帕霉素的敏感性较低以及tor突变体胚胎致死的这些特点加大了植物TOR 研究的难度。研究人员通过创制乙醇和雌二醇诱导的TORRNA 干扰(RNA interference, RNAi)转基因植物株系,并结合适用于植物TOR激酶的化学抑制剂,比如AZD8055、Torin1、Torin2 等[27-28],来调控植物内源性TOR的活性,从而更便捷地在植物中对TOR的功能开展深入研究。
1.2.2 植物TORC1的活性调控
植物能够对环境条件和营养物质的变化作出反应,以调整自身的生长和发育。TOR可以在营养丰富的条件下被激活,葡萄糖、蔗糖、激素、氨基酸、无机营养元素及光等都可以作为TOR的上游信号,促使TOR磷酸化下游底物,从而刺激植物的生长和细胞增殖。当植物面临饥饿或胁迫时,TOR信号激活合成代谢过程,如核苷酸、蛋白质的生成,同时也会触发分解代谢和自噬过程[29]。
通过光合作用产生的葡萄糖和蔗糖能够有效激活植物的TOR信号。已经证明,葡萄糖可以通过糖酵解-线粒体-电子传递链(electron transport chain,ETC)-能量依赖的途径激活TOR 激酶,并且生长素、油菜素甾醇(brassinosteroid, BR)、细胞分裂素(cytokinin, CTK)和赤霉素(gibberellin, GA)等植物激素不能替代葡萄糖来重新激活TOR激酶和使细胞增殖,乙烯也无法抑制葡萄糖激活TOR激酶和使根分生组织中的细胞增殖[28,30-32]。此外,植物中的能量感受器SNF1 相关蛋白激酶1(SNF1-related protein kinase 1, SnRK1)与哺乳动物中AMPK同源,在缺乏能量的情况下,拟南芥SnRK1 被激活,并通过直接磷酸化Raptor 与TOR 解离,从而抑制TORC1 的活性[33]。相较而言,哺乳动物中由葡萄糖激活的AMPK不仅能够直接磷酸化TORC1,而且能够通过TSC-Rheb GTP 途径抑制TORC1 的活性[15]。一项新的研究表明,植物特异性类FCS锌指蛋白8(FCSlike zinc finger 8, FLZ8)也参与SnRK1-TOR信号的调节,在糖含量充足的情况下,TOR 通过依赖性和非依赖性组蛋白修饰上调FLZ8 的表达。然而,在不利条件下,FLZ8 通过促进SnRK1α1 亚基与Raptor1B 的相互作用来负调控TOR 信号转导[34]。上述结果表明,在植物中存在新的SnRK1-TOR 进化机制。值得注意的是,在哺乳动物中葡萄糖感应是通过Rag GTP 酶介导的[16],但在植物中尚未发现该酶。因此,植物TOR复合体对葡萄糖响应的具体机制仍需要深入研究。
不同于动物,光也可以作为植物直接的生长信号。光敏色素A/B(phytochrome A/B, phyA/B)和隐花色素(cryptochrome 1/2, cry1/2)能够感知光照,并通过抑制组成型光形态建成蛋白1(constitutive photomorphogenesis 1, COP1)来促进生长素信号转导,从而激活Rho 类小GTP 酶2(Rho-like small GTPase 2, ROP2),进而激活TOR激酶,并诱导下游转录基因表达,以促进茎尖细胞分裂[35]。
在植物中,氮信号也是TOR激活的主要信号之一,氨基酸、硝酸盐和铵盐均可激活ROP2,进而激活TOR。值得注意的是,这种激活过程与氮同化和硝酸盐转运蛋白1.1(nitrate transporter 1.1, NRT1.1)作用无关[36]。研究表明,拟南芥中亮氨酸和缬氨酸等支链氨基酸浓度的增加有助于上游TOR信号网络的激活[37]。外源施加15种氨基酸(amino acids, AAs)均能促进拟南芥TOR活性水平的提高,特别是来自氮同化的谷氨酰胺、乙醇酸途径的甘氨酸和硫同化的半胱氨酸对拟南芥TOR 的激活显示出最高的效应[36]。在哺乳动物中,氨基酸通过结合氨基酸传感器这一途径来介导Rag GTP 酶激活mTORC1[18],但是到目前为止,在植物中尚未发现氨基酸传感器和Rag GTP 酶。因此,寻找植物中相应的氨基酸传感机制是研究TOR激酶信号网络亟待解决的问题。
对于植物中是否存在其他响应氨基酸的途径,一项关于TOR 新发现的上游调控因子研究给予了新的解释。研究显示,RALF1-FERONIA 复合体能够在低氮(N)条件下与TOR 激酶相互作用,从而调节TOR 下游信号通路[38]。FERONIA(FER)是一种类受体激酶,与抗丁香假单胞菌斑点致病变种1 的R 蛋白(R protein resistance toPseudomonas syringaepv.maculicola1, RPM1)诱导的受体相互作用蛋白激酶(receptor-interacting protein kinase, RIPK)形成复合物,通过与其配体快速碱化因子(rapid alkalinization factor, RALF)相互作用而在细胞生长中发挥功能。关于FERONIA 如何激活TOR 激酶的研究显示,FER-RIPK 与Raptor1B 相互作用并使其磷酸化,从而激活TOR 通路,并且发现特定的氨基酸(例如谷氨酰胺、天冬氨酸和甘氨酸)通过FER-TOR 途径在缺氮条件下促进真叶的生长[39]。此外,FER-RIPK 也可能通过介导ROP2 途径达到激活TOR的目的[40]。
植物中的其他无机营养元素如硫(S)、磷(P)等对TOR的活性也有重要作用[41-42]。目前尚未有硫信号调节TOR 活性的明确解释。半胱氨酸是植物通过光合作用吸收硫酸盐合成的第一种含有还原硫的有机化合物。它是植物生长发育所必需的大量含硫代谢物的前体分子,这些含硫代谢物还包括甲硫氨酸等其他含硫氨基酸、维生素、辅助因子(如S-腺苷甲硫氨酸等)[43],其中不乏TOR 的活性诱导因子。因此,硫信号可能通过影响含硫代谢物的合成来调控TOR激酶活性。有研究发现,无机硫酸盐表现出高效激活TOR 和细胞增殖能力,并且TOR 的这种硫酸盐激活效应与硫酸盐同化过程无关[41],说明植物体内存在独立的硫信号激活TOR的途径。
关于磷和TOR 之间的联系,在绿藻中研究发现:在磷缺乏的情况下,LST8 水平降低,导致TOR活性下降,核糖体蛋白亚基S6(ribosome protein subunit S6, RPS6)的磷酸化水平降低;当磷代谢相关转录因子PSR1 突变后,在磷充足的情况下,psr1突变体中LST8 水平降低,但在磷饥饿的情况下,LST8水平和TORC1活性却不能被下调。在磷饥饿的psr1突变体中,LST8 水平和TORC1 活性的错误调节证明了TORC1活性是磷饥饿过程中PSR1的下游效应因子,从而建立了一条磷与TORC1的特定联系途径[42]。此外,还有研究发现,拟南芥根特定蛋白激酶(Arabidopsis-root-specific kinase 1, ARSK1)活性在缺磷情况下被抑制,它可以通过磷酸化Raptor1B来激活TOR信号通路,并且是以磷依赖性的方式影响Raptor1B 的稳定性和TOR 的活性[44]。总之,硫和磷信号对TOR 的激活有重要的作用,然而,有关这些信号的感知和联系机制的研究还存在许多空白,相较于动物中的研究,这也是一个具有挑战性的新领域。
在植物中,植物激素也参与对TOR 活性的调控。例如,由油菜素甾醇(BR)介导的植物完整生长需要TOR 的激活,油菜素甾醇不敏感激酶(brassinosteroid insensitive 2, BIN2)是BR 信号的负调节因子。在BR存在的情况下,增强的BR信号可以通过阻止BIN2对Raptor1B和BES1转录因子的磷酸化来增强TOR 活性,进而降低自噬水平。在没有BR 的情况下,BIN2 通过磷酸化Raptor1B 来抑制TOR 活性,导致自噬被激活[45]。另外,脱落酸(abscisic acid,ABA)可以通过与PYL(pyrabactin resistance 1-like)、蛋白磷酸酶2C(protein phosphatase 2C, PP2C)形成三元复合物,释放激活的SnRK2 和SnRK1,使其能够磷酸化Raptor,从而抑制TOR信号转导[46-47]。
病毒效应蛋白也能够作为一种上游信号激活TOR。例如,花椰菜花叶病毒(cauliflowermosaic virus, CaMV)的反式激活蛋白(trans-activator protein,TAV)与TOR 结合,促进植物中TOR 和S6K1 的磷酸化[48]。
2 TOR 参与植物生长发育调控
TOR 参与植物不同阶段的生长和发育,包括胚胎发育、种子萌发、子叶展开、根和地上部分生组织激活、根伸长、叶片发育、开花和衰老等过程[6,29](图2)。早期研究发现,植物tor突变导致胚胎死亡,即使不同结构域的突变可能略有差异,但普遍表现为核糖体RNA(ribosomal RNA, rRNA)含量显著减少和细胞周期停滞,表明TOR在植物的胚胎发育过程中起着关键作用[23,49]。与敲除小鼠Raptor基因导致的胚胎死亡相比,拟南芥Raptor基因突变表现为条件致死[25,50],表明植物TOR 在胚胎发育中的功能可能不完全依赖于Raptor,有待揭示植物中新的TOR复合体和信号途径。
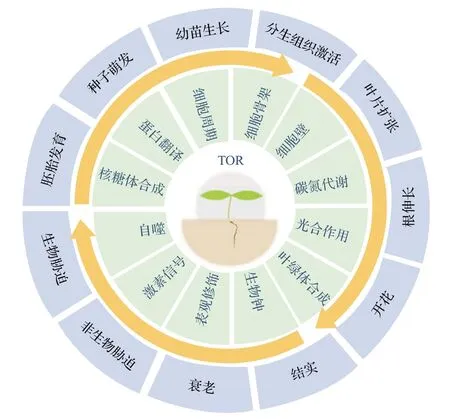
图2 TOR在植物发育中的核心调控作用Fig.2 Central regulatory roles of TOR in plant development
在种子萌发过程中,TOR信号也发挥着关键作用。raptor1b突变体中TOR 信号的下调导致脱落酸、生长素和茉莉酸(jasmonic acid, JA)水平增加,并显著延迟了种子的萌发过程。在raptor1b种子中观察到的延迟发芽和幼苗生长可以通过赤霉素(GA)的外源供应部分恢复,表明TOR 在调控种子代谢、成熟和发芽过程中扮演着关键角色[51]。另一项研究也证明了小麦种子的萌发受TOR 信号的调控:在种子萌发的早期,GA 激活类MYB 转录因子GAMYB 促进了糊粉层和胚胎中α-淀粉酶的从头合成,而丰富的α-淀粉酶在决定种子萌发和幼苗生长的淀粉代谢过程中起着核心作用;但雷帕霉素或Torin1对α-淀粉酶的合成基因GAMYB的表达有很强的抑制作用,从而干扰了GA 在种子萌发过程中的作用,这暗示TOR 信号可能正调控GAMYB的表达[10]。此外,植物TOR通过直接磷酸化酵母和动物TAP42/α4 的同源物TAP46(type 2A phosphataseassociated protein of 46 kDa)来调节蛋白质翻译和其他过程。TAP46 是PP2A 的调节亚基,也是TOR 的正效应因子。TAP46过表达的植株种子不仅更长更重,而且更能抵抗降低种子活力的环境胁迫,因此,由TOR 介导的TAP46 激活在提高种子活力和随后的萌发过程中扮演着重要角色[52]。另外,乙烯和油菜素甾醇分别是抑制和促进黄化幼苗下胚轴伸长的关键激素。长期抑制TOR可能通过TAP46-ACS2/6(ACC synthase 2/6)链来触发乙烯生物合成,进而抑制下胚轴伸长和种子萌发[53]。
TOR 在促进子叶展开和去黄化过程中发挥着重要作用,并且通过不同途径实现调控。以往的研究表明,RPS6 的磷酸化主要依赖于TOR-S6K 信号通路[54]。在拟南芥子叶去黄化的过程中,光感受器通过感知远红光和蓝光来灭活负调控因子COP1,从而激活生长素途径,实现依赖TOR 的RPS6 磷酸化,进而促进蛋白质翻译和子叶展开[55]。另外,TOR还通过降低特异性下游效应器TRIN1/ABI4(TORinhibitor insensitive 1/ABA insensitive 4)的稳定性来拮抗ABA 信号,从而促进叶绿素代谢、叶绿体生物发生和下胚轴伸长[46,56]。此外,TOR-S6K2信号可以通过负调控BIN2 来调节叶绿素的生物合成和叶绿体的形成,从而促进子叶变绿[57]。然而,在TOR 抑制条件下,水稻叶绿体中类囊体基粒的形成会受到干扰,导致光合作用能力降低,从而延迟子叶变绿过程[58]。这些途径的发现支持植物TOR 在控制关键发育过程中的作用,包括叶绿体形成和形态建成,从而促进植物向光自养生长阶段过渡。
有证据表明,TOR信号在调节植物分生组织和根系的形成方面有关键作用。由葡萄糖驱动的TOR 信号可以通过诱导根和地上部顶端分生组织中的E2 启动子结合因子a/b(E2 promoter binding factor a/b, E2Fa/b)和WUSCHEL转录因子来激活分生组织,其中E2Fa/b转录因子是TOR信号的下游靶点,它们诱导S 期基因的表达和促进细胞周期进程[28]。另外,由葡萄糖激活的TOR激酶还通过磷酸化乙烯信号的关键成分乙烯不敏感蛋白2(ethyleneinsensitive protein 2, EIN2)来阻止其核定位和抑制其负调控细胞的增殖和生长过程,而ein2突变体则表现为初级根分生组织中细胞增殖和S期基因表达量增加,表明TOR-EIN2 信号在调控分生组织中具有重要作用[32]。此外,无机氮(NO-3与NH+4)和有机氮(谷氨酰胺等氨基酸)等营养物质均可以激活ROP2-TOR 通路,调控植物茎尖的生长和发育[36]。在拟南芥中还报道了一个新的TOR 信号通路,YAK1(yet another kinase 1)作为直接底物被TOR抑制,促进根分生组织活性增强:拟南芥TOR 通过抑制YAK1,解除其对细胞周期蛋白依赖性激酶(cyclin-dependent kinase, CDK)和细胞周期蛋白(cyclin, CyC)的抑制以促进生长,维持细胞增殖;而在缺乏TOR 活性的情况下,YAK1 能够诱导SMR(SIAMESE RELATED)基因的表达,进而抑制CDK,促进分化[59]。此外,DNA甲基化是一种不可或缺的表观遗传修饰,在细胞生长发育过程中动态调节基因表达和基因组的稳定性。有研究证明,抑制拟南芥TOR基因会降低全基因组的甲基化水平,特别是在碳代谢和氨基酸生物合成途径中,差异甲基化基因数量最多,表明TOR通过调节基因的甲基化水平来控制细胞的生长和增殖[9]。生物钟也可能通过介导TOR激酶协调植物的生长。研究表明,TOR激酶对于葡萄糖和维生素B3介导的拟南芥昼夜节律期的控制至关重要,维生素B3会影响细胞内ATP的浓度,并阻断葡萄糖-TOR 能量信号对生物钟周期长度的调节、根尖分生组织的激活和根系生长的影响[60]。
植物根系的形成由主根衍生的侧根(lateral root, LR)和不定根(adventitious root, AR)决定。侧根的形成与生长素响应因子7(auxin response factor 7, ARF7)、ARF19 和侧生器官边界域因子16(lateral organ boundary-domain 16, LBD16)的调控密切相关,而不定根的形成依赖于生长素和WOX11(WUSCHEL-related homeobox 11)对LBD16的激活。TOR 激酶以糖依赖的方式在侧根区域中被激活,TOR 抑制减弱了ARF7、ARF19 和LBD16的翻译,从而阻断了LR的形成。另外,TOR抑制通过诱导WOX11转录促进了AR的形成。因此,作为根分枝的中心关键调节器,TOR将局部的生长素依赖途径与系统代谢信号整合在一起,调节生长素诱导基因的翻译[61]。此外,TOR 通过磷酸化使生长素外流载体PIN2蛋白稳定,以调节细胞伸长所必需的生长素梯度分布,并通过感知糖信号来促进根毛的生长和发育[62]。PLT2(PLETHORA 2)蛋白也是植物根系发育的剂量依赖性主调节因子。ZHANG 等[63]研究发现,TOR 激酶可以维持PLT2 在根尖的梯度分布,免疫共沉淀实验表明TOR 和PLT2 在体内相互作用,进一步通过质谱和体外磷酸化实验表明PLT2 的Ser2 位点被TOR 特异性磷酸化并保持稳定。这些结果表明,TOR通过直接磷酸化和使PLT2稳定来维持根尖稳态。最近研究发现,细胞表面的类受体激酶FERONIA可以通过与TORC1相互作用来促进低温、低氮条件下拟南芥的根毛生长,而fer突变体和由雌二醇诱导的tor突变体的根毛生长均受到抑制[40]。
叶片是植物生长和发育阶段能量产生和养分同化的主要光合作用器官,TOR作为植物生长和发育的主要调节器,在调节叶片和植株发育方面也发挥着作用。早期对TOR RNAi和lst8突变体的分析发现,TOR 复合体与细胞壁的形成紧密相关,而细胞壁的生长与叶片的扩张有密切联系[22,28]。例如,TOR 和TAP46 过表达植物会产生更大的叶片和更长的叶柄,而TOR RNAi和TAP46 RNAi突变体会导致整体翻译缺陷,表现出相反的表型。AtTOR基因表达水平降低或增强分别导致器官和细胞减小或增大[52,64]。此外,植物的叶片发育受到营养分配的限制,成熟“源”叶中的碳水化合物重新分配到发育中的“库”叶,以促进幼叶和根系的发育,这一过程依赖于胞间连丝(plasmodesmata, PD)介导的细胞间的物质运输来协调。植物中细胞间物质运输也受到TOR复合物的调节。例如,TOR激酶抑制剂处理会显著增加PD 的运输量。在幼叶中,糖代谢受到限制,TOR又相对不活跃,从而增加了PD对糖的转运量以及从韧皮部的导入量;而成熟叶片中较高的糖含量及TOR 活性,减少了PD 的运输量并促进了糖的导出。TOR活性的变化通过PD运输刺激了糖从成熟叶片向发育中叶片的转运,从而协调叶片和植物的生长[65]。
在以往的研究中,TOR信号与植物开花过程的联系并不清楚。然而,在最近的一项新研究中,确定了TOR-FIE-PRC2信号在调控植物生长发育中,特别是开花过程中的重要作用[66]。研究发现,由葡萄糖激活的TOR 激酶能够直接磷酸化多梳蛋白抑制复合体2(polycomb repressive complex 2, PRC2)的亚基FIE 蛋白,从而影响全基因组H3K27me3 的水平,如拟南芥fie突变体的H3K27me3水平大幅下降。对fie突变体中3 969个基因的表达水平进行分析发现:调控生长发育的基因大部分出现了表达上调的情况,拟南芥生长发育也出现了异常,如叶片畸形、果荚干瘪和茎尖分生组织变大等。此外,研究还发现,葡萄糖驱动TOR-FIE-PRC2信号参与调控植物的春化作用,通过抑制FLC基因(抑制植物开花的一类基因)的表达来促进植物的开花过程[66]。这揭示了葡萄糖-TOR信号诱导植物开花的新途径。
TOR 在果实成熟过程中也有很重要的作用。研究表明,随着果实的成熟,番茄SlTOR的转录本数量逐渐减少。外源添加TOR 抑制剂AZD8055 来抑制SlTOR 的活性或通过可诱导的RNA 干扰抑制TOR的活性,能够加速果实的成熟,并对果实成熟过程产生影响,包括果实颜色和新陈代谢的变化、果实软化及成熟相关基因的表达等[67]。此外,研究还发现,抑制TOR的活性提高了乙烯生物合成基因的表达,并进一步促进了乙烯的产生。相反,使用乙烯抑制剂1-MCP 可有效地延迟果实的成熟,即使在SlTOR 活性被抑制之后也是如此[67]。这些结果表明,SlTOR 活性被抑制所引起的果实加速成熟依赖于乙烯,而且SlTOR可能在乙烯代谢中起调节作用。
在哺乳动物中的遗传药理学研究已经表明,mTOR 是衰老的主要驱动因子,因此,抑制mTOR的活性可以延长多种生物的寿命[68]。TOR 在调节植物衰老过程中的作用也已被发现。一些TOR 高表达的植物可以通过磷酸化RPS6在叶片和角果中促进蛋白质翻译而显著加速衰老[69]。相反,在raptor和lst8突变体中观察到植物的早衰现象,并且开花时间被推迟[22,25],表明TOR 在调节衰老方面具有复杂的功能。在之前的研究中,一种NAC(NAM-ATAF-CUC)转录因子ORE1(ORESARA 1)能够正向调节拟南芥叶片中因衰老诱导的细胞死亡,而TOR 的下游底物EIN2 能够上调ORE1 的表达,从而促进叶片的老化过程[70]。对拟南芥中SnRK基因的研究进一步揭示了蛋白质磷酸化在介导胁迫诱导的叶片衰老调节中的重要性。ABA 通过与PYL-PP2C 形成三元复合物,从而释放激活的SnRK2 来磷酸化ABA 反应元件结合因子(ABAresponsive element binding factor, ABF)和RAV1(related to ABA insensitive 3/VP1),随后激活包括ORE1 在内的衰老相关基因(senescence-associated genes,SAGs)和叶绿素分解代谢基因(chlorophyll catabolic genes,CCGs)的表达,进而引发叶片衰老和叶绿素降解过程[71]。另外,SnRK1 则可以通过磷酸化破坏乙烯信号转导中关键转录因子EIN3 的稳定性,从而下调其靶基因的启动子活性,延迟叶片衰老过程[72]。相反,TOR 能够磷酸化ABA 受体PYL,使ABA 结合位点失活而负调控SnRKs[46-47],进而可能通过此途径调控叶片的衰老进程。
在动物中已经证明自噬与衰老之间存在联系,通过热量限制和运动可以抑制TORC1 的活性并激活自噬,以降解功能失调和受损的细胞蛋白质和细胞器,维持细胞的稳态,从而延迟衰老过程[73]。自噬相关蛋白1/13(autophagy-related protein 1/13, ATG1/13)复合物磷酸化的机制已在酵母和哺乳动物中阐明,但至今仍没有在植物中得到明确的解释。有研究发现,植物TOR的失活能够触发ATG13的去磷酸化,促进自噬体的形成。此外,ATG13a通过TOS基序与Raptor相互作用来调节自噬系统,表明ATG13可能是TOR激酶的直接磷酸化靶点[74]。
综上所述,TOR激酶能够通过下游信号通路调控核糖体合成、蛋白质翻译、碳/氮代谢、叶绿体合成、光合作用、自噬及激素信号和细胞周期等,影响植物不同阶段的生长发育。
3 TOR 参与植物环境适应性调控
植物固着生长在自然环境中,受到各种非生物和生物逆境的影响,因此,植物需要快速作出应答以适应变化的环境。TOR 信号通路在这一过程中发挥着重要作用,它通过调节核糖体的生物发生和蛋白质的合成来确保持续的营养和能量供应。同时,TOR也参与调节植物的自噬过程,使蛋白质、细胞器和大分子被降解和循环,以维持植物生长和发育,并应对营养和能量缺乏以及许多生物和非生物胁迫[7,75]。目前,已发现植物通过多种反应机制来适应不同的外界环境条件。
3.1 TOR 调控植物响应非生物胁迫
TOR可以通过改变植物形态、自噬和激素等途径调节植物对营养和能量胁迫的反应。氮是合成核酸、蛋白质、脂类和激素的必需元素。在缺乏氮的情况下,植物叶绿素的合成受损,光合作用速率下降,从而导致生物量降低[76]。当植物经历氮饥饿时,TOR活性受到抑制,植物启动自噬过程,分解不必要的或受损的细胞器和蛋白质,将释放的含氮物质重新循环利用,促进氮的吸收和同化,以提高氮的利用效率[77]。另外,有研究表明,适当地抑制TOR活性可以激活茉莉酸和水杨酸(salicylic acid, SA)信号转导,而茉莉酸和水杨酸是调节植物生长发育的重要防御激素,使植物能够应对低氮胁迫[77-78],然而,其涉及的分子机制仍有待进一步研究。研究也发现,缺硫诱导植物茎中细胞自噬与根冠比的增加。在缺硫条件下,TOR 在植株地上部的活性降低,但在根中变化不明显,其中,缺硫促使野生型植株地上部的自噬作用增强,根冠比增加,而raptor和lst8突变体在缺硫条件下的根冠比并没有增加,并且野生型植株在缺硫条件下的根冠比增加效应会随着外源TOR抑制剂AZD8055的添加而丧失[79],说明TOR 可以通过调控植物根冠比来提高营养利用效率。与此类似,缺少必需的矿质磷也会抑制根的生长。拟南芥根特定蛋白激酶ARSK1 可以通过调节TOR 信号通路达到减弱磷限制下的初始根生长抑制,促进根的生长,从而提高植物的磷利用效率[44]。此外,SnRK1 和TOR 作为2 个核心营养感知蛋白激酶,在很大程度上存在拮抗作用,以平衡生长和防御之间的关系。在能量充沛的情况下,TOR处于活跃状态,而SnRK1 被抑制,从而促进合成代谢并抑制分解代谢。相反,在糖和能量匮乏的情况下,SnRK1 被激活,并直接磷酸化Raptor 以抑制TOR,从而引发应激反应,提高植物对非生物胁迫的响应能力[33,80]。另外,为了快速响应外界环境变化,植物细胞具有比动物细胞更加动态的微丝骨架。研究人员通过遗传学手段筛选出的拟南芥raptor1b突变体对微丝解聚药物表现出耐受性,经TOR 特异性抑制剂处理的细胞中微丝形态未发生显著变化,但其动态性下降,表现为微丝延伸速率和切割频率下降、微丝的寿命显著延长。进一步的研究发现,Raptor1B在细胞质及线粒体上特异性定位,表明TORC1可能通过调控细胞ATP水平影响胞内微丝的动态稳定,因此,降低微丝动态是植物细胞应对能量短缺的有效策略之一[81]。
盐分、水分等胁迫在植物上普遍发生,引起植物体内一系列生化生理方面的变化,从而导致代谢异常并抑制生长。TOR 激酶也通过不同机制应对盐分和干旱等胁迫。ABA 是响应环境胁迫特别是干旱胁迫的重要激素。在非应激状态下,TOR磷酸化ABA 受体PYL,使PYL-PP2C-ABA 复合物解离,促使PP2C 与SnRK1、SnRK2 结合,阻断ABA 激活SnRK 的通路,从而促进植物正常生长。在胁迫条件下,ABA通过SnRK1、SnRK2使Raptor磷酸化,导致其与TORC1解离,抑制TOR的信号转导,进而提高植物抗逆能力[46-47]。据报道,TOR 激酶还可能参与ABA 的合成或分布,TOR 的超量表达能够提高植物的干旱耐受性[82],因此,TOR 与ABA 的调控关系在有效应对干旱等非生物胁迫时是必需的。另外,TOR 调节蛋白Raptor1B 在植物体内与TOR的HEAT重复序列相互作用,可调节TOR底物S6K1的活性,以响应渗透胁迫[21]。对超量表达TOR的拟南芥植株进行研究发现,在甘露醇、氯化钠、山梨醇和聚乙二醇胁迫处理中,侧根直径、根长度和鲜质量均有所增加,进而提高了拟南芥植株对盐胁迫和渗透胁迫的耐受性[83]。
TOR在响应植物缺氧胁迫中也有一定作用。在缺氧环境中,植物能够通过激活一系列的缺氧响应基因(hypoxia response genes,HRGs)来作出响应,该过程主要的调控因子是一小类属于乙烯响应因子家族的亚群8(group Ⅶ of the ethylene response factor,ERF-Ⅶ)转录因子。最近的研究表明:ERF-Ⅶ主要转录因子RAP2.12蛋白C端的2个丝氨酸残基的磷酸化取决于TOR 激酶,并且RAP2.12 必须依赖于TOR的活性来激活;该类转录因子在有氧条件下不稳定,但在缺氧条件下,由于碳水化合物代谢产生的ATP含量不足,低水平的ATP会导致TOR活性降低,从而减弱TOR 对ERF-Ⅶ介导的HRGs 转录的诱导效率,降低碳水化合物的消耗速率,从而确保植物持续产生能量,保证植物在淹水条件下的生存[84]。另外,研究发现,拟南芥中的SnRK1 通过磷酸化翻译起始因子eIFiso4G,以调节在淹水条件下的蛋白质翻译动态,提高植物对淹水缺氧的适应能力[85]。
TOR 信号下游通路还通过不同机制应对高温胁迫。研究发现,一个保守的翻译调节因子镧相关蛋白1(La related protein 1, LARP1)可能是TOR 的底物[86]。热胁迫(heat stress, HS)介导的mRNA衰变由核酸外切酶(exoribonuclease 4, XRN4)催化,而拟南芥LARP1A 是XRN4 参与热依赖性mRNA 衰变过程的辅助因子[87],因此,TOR信号可能通过这种机制参与植物在高温胁迫环境下的耐热性。此外,TOR-E2Fa 通路通过调控拟南芥中类Hikeshi 同源蛋白1(Hikeshi-like protein 1, HLP1)来调节耐热性和热记忆。功能性HLP1的丧失导致HS超敏反应,而HLP1过表达表现出更高的耐热性,在热胁迫后,ProHLP1::GUS 在顶端分生组织中的表达与TORE2Fa 的表达一致,证实TOR-E2Fa-HLP1 在调节耐热性方面发挥了作用[88]。研究显示,除了HLP1,由TOR 激酶激活的E2Fa 还可以结合到ATX1(Arabidopsistrithorax 1)的启动子上来调控表达,最终形成植物的热记忆,有助于植物抵抗反复的高温胁迫[89]。另外,TOR 还可能直接调节长链非编码RNAs 对非生物逆境特别是高温胁迫环境的响应,从而在陆地棉的逆境反应中发挥作用[90]。
总体而言,植物中的TOR 在感知和响应营养、能量和环境胁迫方面起着关键作用,包括但不限于促进蛋白质合成、调节激素信号转导、抑制自噬过程、调节根冠比、激活抗逆相关基因的表达以及影响细胞内微丝骨架的动态性。然而,植物中TOR信号通路的调控机制仍然非常复杂,在许多方面仍需进一步的研究来揭示。随着对TOR 信号通路研究的不断深入,我们可以更全面地理解植物在复杂环境中生长和适应的调节网络。
3.2 TOR 调控植物响应生物胁迫
植物生活在复杂的环境中,除了受到非生物胁迫,还不断受到微生物病原体和食草性昆虫的攻击。然而,生态和生理研究表明,激活防御反应通常会损害作物生长和产量[91]。在植物免疫反应和抗病过程中,TOR 发挥着重要的作用。研究发现,在植物应对病原体攻击的过程中,TOR的一个磷酸化底物Maf1起到了关键作用[92]。Maf1作为RNA聚合酶Ⅲ抑制剂,调节tRNA 和5S rRNA 的合成。在柑橘中,CsMaf1与来自柑橘溃疡病病原体黄单胞菌的转录激活效应器PthA4相互作用,以此来抑制tRNA的合成,从而限制柑橘溃疡病的发展[93]。然而,在抑制Maf1条件下,拟南芥并不易受到广泛存在的植物病原体灰葡萄孢菌的感染,这可能是因为Maf1对不同的病原体存在特异性[94]。此外,研究显示,沉默AtTOR可以激活部分与防御相关的基因,提高对丁香假单胞菌的抗性[95]。抑制TOR活性也能提高对包括水稻黄单胞菌在内的各种病原体的抗性[8],并且TOR 沉默或TOR 抑制被证明对西瓜花叶病毒(watermelon mosaic virus, WMV)和芜菁花叶病毒(turnip mosaic virus, TuMV)具有部分抗性[96]。利用TOR 沉默的突变体或用TOR 抑制剂处理的方式下调TOR表达水平,可以增强对小麦赤霉病的抗性[97]。还有前文所提到的CaMV,其反式激活蛋白(TAV)激活TOR-S6K1,保持RISP、eIF3 和其他参与病毒RNA转录再启动蛋白质的最高催化活性,从而抑制抗病毒防御机制之一的无义突变介导的mRNA 降解(nonsense-mediated mRNA decay, NMD)[48,98]。上述研究结果表明,植物可能存在类似TOR-Maf1 途径来调节病原体RNA在宿主内的合成或转录,以此提高或降低免疫能力。
微生物会合成糖和激素等信号分子,这些分子可能会干扰宿主中SnRK1-TOR 的联系,抑制SnRK1活性或促进TOR信号转导,从而调节微生物的生长和防御,促进感染的发生。研究表明,一些病原微生物,如丁香假单胞菌和根癌农杆菌等可以直接合成生长素,或者操纵植物中生长素的合成和信号转导,从而抑制植物的防御过程[91]。近年来,茉莉酸(JA)和水杨酸(SA)在植物抗病及抗虫中的机制得到了广泛的研究[91],并发现TOR 与JA 和SA 存在拮抗关系。在TOR RNAi和Raptor RNAi突变体植物叶片中,JA 和SA 响应基因的表达量增加,而TOR 过表达导致JA 和SA 响应基因的表达水平下调,这支持了TOR 通过直接或间接途径拮抗激素SA和JA来平衡植物防御反应的结论[8]。然而,TOR如何拮抗SA和JA途径的确切机制仍然需要进一步的研究来揭示。
关于TOR 信号是否通过其他机制调节植物的防御反应,最近几项研究发现了可能存在的免疫机制。其中一项研究表明,在磷饥饿条件下,TOR 上游的类受体激酶FERONIA可以被低磷应答转录因子PHR1激活,而这一激活效应可能通过抑制病原体相关分子模式(pathogen-associated molecular pattern,PAMP)触发的免疫(PAMP-triggered immunity, PTI)受体复合物的形成来抑制植物免疫,从而招募特定的微生物,缓解磷饥饿[99]。因此,在植物中,TOR 可能也在类受体激酶FERONIA相关免疫机制中发挥作用。此外,钙依赖性蛋白激酶(Ca2+-dependent protein kinase, CDPK)能够感知由病原体效应子触发的免疫(effector triggered immunity, ETI)而涌入的Ca2+,并以此调节植物的防御机制。在拟南芥中,钙依赖性蛋白激酶AtCPK4/5/6/11 通过磷酸化转录因子WRKY8/28/48来调节下游生物胁迫响应基因的表达[100]。另外,由CDPK 介导的Ca2+信号可能通过参与碳/氮代谢和激素信号通路,与SnRK1-TOR 共同作用来改善植物的适应性[101]。未来随着气候条件的剧烈变化,农业生产将面临极端环境带来的挑战。如何保障作物在高温、干旱、洪涝及病虫害等自然灾害情况下的产量和品质,保障人类的粮食安全,是我们将面临的重要问题。在极端气候条件下,是否能够通过对TOR活性的研究来优化碳氮资源的分配和提高作物对环境的适应能力,从而进一步提升在极端环境下的产量稳定性,并减少对化肥的依赖,将是一个值得深入研究的方向。这一研究有望为我们深入了解作物在极端环境下的生长和抵御自然灾害的能力提供新的视角和潜力。
植物中TOR调控网络示意图如图3所示。
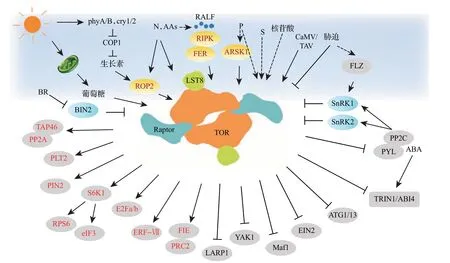
图3 植物中TOR调控网络示意图Fig.3 Schematic diagram of TOR regulatory network in plants
4 展望
TOR 激酶在调节植物细胞生长和代谢中扮演着重要的角色,可以感知营养、能量、激素、代谢和环境应激的输入,从而调控植物生长发育和对环境的适应性。这种全面的调控作用使TOR 信号不仅影响植物生活的各个阶段,而且在响应环境胁迫时发挥关键作用。在现代农业生产中,作物产量的提高依赖大量的化肥和农药的使用,这不但增加了生产成本,还带来了环境污染等问题,因此,通过各种技术方法提高作物产量是农业可持续发展的重要途径。例如,通过化学或遗传方法改变SlTOR 活性,极大地影响了番茄果实成熟过程[67]。通过供应诱导剂和营养物质来调节TOR/SnRKs的活性比,可以决定植物在每个阶段的生长速率和最终的生物产量[102]。在干旱条件下过表达拟南芥TOR提高了水稻光合效率、生物量和水分利用效率[103]。然而,尽管我们对TOR在植物中的作用有了一些了解,但是营养物质和胁迫信号与植物TOR 激酶之间的上游分子连接物仍然存在许多未知,尤其需要进一步探究植物是否存在类似哺乳动物的氨基酸传感器,以及介导葡萄糖和氨基酸感应的Rag GTP 酶。因此,深入了解植物TOR信号调控机制对于理解其调控植物生长的复杂网络具有重要意义。
TOR 和SnRK1 信号通路存在于所有光合真核生物中。普遍认为,TOR和SnRK1相互作用使植物的生长与防御保持平衡。关于两者信号通路的大多数底物和调节网络研究仍是一个重要的方向。有多项研究发现,FERONIA类受体激酶在很大程度上参与SnRK1-TOR 信号网络的调控。RALF1-FER 复合物与TOR 相互作用并激活TOR 信号转导以响应氮饥饿[39];FER 也被证明直接与ROP2 相互作用并激活ROP2 介导的信号转导[104],而ROP2 已被证明与TOR 直接相互作用并激活TOR 以响应生长素和光[35];另外,还有研究证明FER 能通过TOR 对自噬进行负调节[105]。基于这些发现,我们推测FER 与ROP2 和TOR 在同一途径中起作用,从而激活TOR激酶。研究还表明,活化的ROP11 优先结合FERROPGEFs,随后,FER-ROPGEFs 与ABI2 相互作用并激活其磷酸酶活性,导致SnRK2失活和对ABA不敏感,从而抑制ABA 反应,影响植物细胞生长[106]。FERONIA 类受体激酶在处理外部信号中也起着重要作用。研究表明,RALF1-FERONIA 信号通过招募不同的功能蛋白,在能量代谢和免疫中起着双重作用[107]。因此,对FERONIA的研究扩展了SnRK1-TOR 信号网络在免疫应答方面的生物学功能。未来对TOR 与多种蛋白激酶协同参与多种信号调控的研究,将有助于深入了解植物生长发育及碳氮高效利用等生物学问题。同时,也可以利用基因编辑、合成生物学技术等对TOR活性及其信号转导路径进行调控,为提高作物产量、品质及其养分利用效率提供新的策略,为农业可持续发展提供新思路。
