黄芪甲苷调节Apelin/APJ轴抑制喉癌Hep-2细胞的机制
2023-11-14张建波张亚奇吴启英
张建波,张亚奇,吴启英
联勤保障部队第九二八医院五官科,海口 571101
喉癌是常见的头颈部鳞状细胞癌,具有高度侵袭和转移能力,目前对喉癌的发病机制尚不清楚[1]。多项研究表明,黄芪甲苷具有抗肿瘤作用,黄芪甲苷可抑制非小细胞肺癌A549细胞的活性,促进凋亡蛋白表达[2]。此外,黄芪甲苷可抑制黑色素瘤B16细胞增殖,促进凋亡蛋白表达[3]。Apelin是G蛋白偶联受体APJ的内源性配体,Apelin/APJ信号通路通过调节血管生成相关因子促进肺癌细胞迁移和侵袭[4]。APJ高表达的卵巢癌细胞具有更强的迁移和侵袭能力[5]。本研究用不同浓度黄芪甲苷处理Hep-2细胞,探讨黄芪甲苷对Hep-2细胞增殖、迁移和侵袭的影响。
1 仪器与材料
1.1 仪器
高速冷冻离心机(美国Bio-Rad公司);Attune NxT型流式细胞仪(美国赛默飞世尔公司);PCR扩增仪(美国BD公司)。
1.2 试药
黄芪甲苷(质量分数>98%,批号84687-43-4,西安天广源生物科技有限公司);胎牛血清(批号C0234)、DMEM培养基(批号11330032)均购自美国Gibco公司;Transwell小室(批号3450,北京明阳科华生物科技有限公司);基质胶(批号CC3210,江苏百克赛斯生物科技有限公司);SDS-PAGE凝胶快速配制试剂盒(批号WBK508-01,上海咏科生物科技有限公司);TaqMan miRNA反转录试剂盒(批号D1802,上海雅吉生物科技有限公司);二辛可酸(BCA)蛋白定量试剂盒(批号zy61003RE,上海泽叶生物科技有限公司);甘油醛-3-磷酸脱氢酶(GAPDH,批号ab8245)、内源性配体(Apelin)(批号ab125213)和G蛋白偶联受体(APJ)(批号ab6721)抗体均购自美国Abcam公司。
1.3 细胞系
人喉癌Hep-2细胞购自美国ATCC公司,培养于完全培养基中,每天更换1次培养基,每2 d进行1次胰蛋白酶消化传代。
2 方法
2.1 细胞增殖活性的测定
将Hep-2细胞接种于96孔板中,继续培养24 h后,用不同浓度(0、20、 40、80 μmol ·L-1)黄芪甲苷溶液处理细胞24 h,取出培养板,每孔加入20 μL MTT溶液培养4 h,弃掉培养液,预冷磷酸盐缓冲液清洗细胞2次,每孔加入150 μL 二甲基亚砜(DMSO)振荡混匀10 min,测定吸光度(A)值。
2.2 细胞凋亡率的测定
用不同浓度(0、20、40、80 μmol·L-1)黄芪甲苷溶液处理细胞24 h后,弃掉培养液,离心,收集细胞,加入500 μL 结合缓冲液吹打混匀,取100 μL细胞悬液加入异硫氰酸荧光素标记的膜联蛋白V 孵育10 min,加入碘化丙啶孵育15 min。用流式细胞仪和Flowjo软件分析细胞凋亡率。
2.3 迁移和侵袭细胞数量的测定
侵袭细胞数量的检测:将用不同浓度黄芪甲苷溶液处理后的Hep-2细胞制成密度为5×105个·mL-1的细胞悬液,取200 μL添加至铺满基质胶的Transwell上室中,下室中加入完全培养基600 μL,培养24 h后,去除培养基,固定,用湿棉签去除多余未穿膜的细胞,染色,于显微镜下观察并计数侵袭细胞数量。
迁移细胞数量的检测:除Transwell小室上室中不铺基质胶外,其余操作步骤同上。
2.4 Apelin和APJ蛋白相对表达量的测定
收集经不同浓度黄芪甲苷溶液处理后的Hep-2细胞,裂解,取上清液,测定蛋白质量浓度,煮沸。每个上样孔中加入蛋白样品20 μg,聚丙烯酰胺凝胶电泳分离蛋白质,用湿转法将蛋白湿转至PVDF膜上,洗膜,室温封闭1 h,抗体孵育过夜,二抗室温孵育,显色,Image J分析条带灰度值。
2.5 统计学方法
3 结果
3.1 黄芪甲苷对细胞存活率的影响
细胞存活率随黄芪甲苷浓度的增加逐渐降低,且具有浓度依赖性(P<0.05)。见表1。
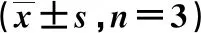
表1 各组细胞存活率的比较
3.2 黄芪甲苷对细胞凋亡率的影响
细胞凋亡率随黄芪甲苷浓度的增加逐渐升高,且具有浓度依赖性(P<0.05)。见表2。
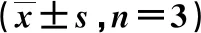
表2 各组细胞凋亡率的比较
3.3 黄芪甲苷对细胞迁移能力的影响
迁移细胞数量随黄芪甲苷浓度的增加逐渐减少,且具有浓度依赖性(P<0.05)。见表3、图1。
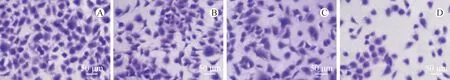
注:A.黄芪甲苷0 μmol·L-1组;B.黄芪甲苷20 μmol·L-1组;C.黄芪甲苷40 μmol·L-1组;D.黄芪甲苷80 μmol·L-1组。
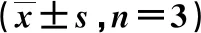
表3 各组迁移细胞数量的比较
3.4 黄芪甲苷对细胞侵袭能力的影响
侵袭细胞数量随黄芪甲苷浓度的增加逐渐减少,且具有浓度依赖性(P<0.05)。见图2、表4。
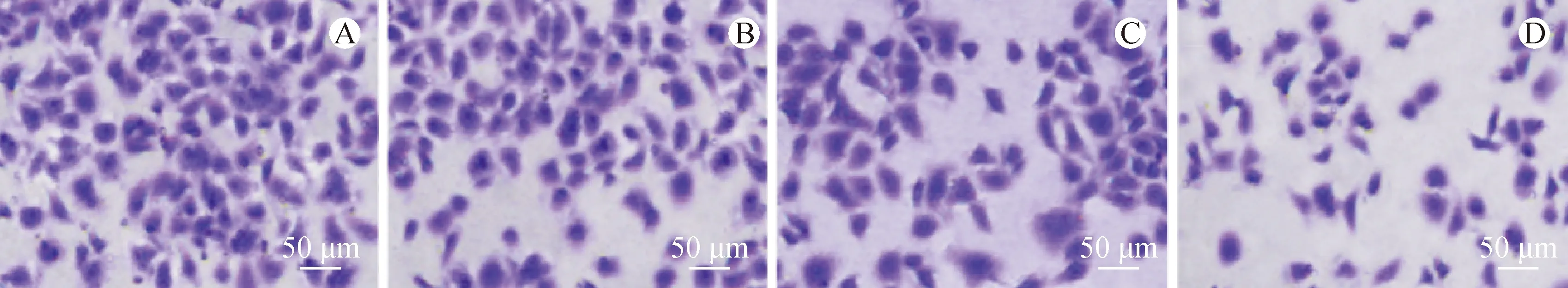
注:A.黄芪甲苷0 μmol·L-1组;B.黄芪甲苷20 μmol·L-1组;C.黄芪甲苷40 μmol·L-1组;D.黄芪甲苷80 μmol·L-1组。
表4 各组侵袭细胞数量的比较
3.5 黄芪甲苷对Apelin/APJ信号通路的影响
Apelin和APJ的蛋白相对表达量随黄芪甲苷浓度的增加逐渐降低,且具有浓度依赖性(P<0.05)。见表5、图3。

注:A.黄芪甲苷0 μmol·L-1组;B.黄芪甲苷20 μmol·L-1组;C.黄芪甲苷40 μmol·L-1组;D.黄芪甲苷80 μmol·L-1组。
表5 各组细胞中Apelin和APJ蛋白相对表达量的比较
4 讨论
喉癌的发病具有隐匿性,多数患者就诊时已处于中晚期,常采用手术切除和放、化疗等进行治疗,但是由于耐药性的出现常使患者治疗效果不佳,且术后5年生存率较低,复发和转移发生率较高,严重威胁患者的生命健康,给社会和医疗带来沉重负担[6-7]。
中药因其来源广、不良反应小等优点而被越来越多的学者关注。黄芪是我国传统中药材,具有增强机体免疫力、降血糖以及强心降压等作用[8],其含有黄芪多糖和黄芪甲苷等活性成分,黄芪多糖可通过调节线粒体自噬抑制肝癌细胞增殖,同时诱导癌细胞凋亡[9]。黄芪甲苷具有抗氧化、抗炎以及调节免疫等多种药理活性[10-12]。黄芪甲苷对具有阿霉素多药耐药性的人乳腺癌MDA-MB-231细胞具有良好的逆转作用,能够增强耐药细胞对化疗药物的敏感性[13]。黄芪甲苷通过调节Wnt/β-catenin信号通路抑制肝癌HepG2细胞生长,促进细胞凋亡,降低癌细胞迁移和侵袭能力[14]。
本研究用不同浓度黄芪甲苷处理Hep-2细胞后,用流式细胞仪检测细胞的凋亡情况,结果发现,与0 μmol·L-1组比较,20 μmol·L-1组、40 μmol·L-1组、80 μmol·L-1组的细胞凋亡率逐渐升高,且具有浓度依赖性,表明黄芪甲苷可诱导Hep-2细胞凋亡,且黄芪甲苷浓度越大,细胞凋亡率越高。MTT法检测细胞存活率,结果显示,与0 μmol·L-1组比较,20 μmol·L-1组、40 μmol·L-1组、80 μmol·L-1组细胞的存活率逐渐降低,且具有浓度依赖性,表明黄芪甲苷可抑制Hep-2细胞的增殖,且黄芪甲苷浓度越大,细胞增殖越缓慢。Transwell实验检测细胞迁移和侵袭能力,结果显示,与0 μmol·L-1组比较,20 μmol·L-1组、40 μmol·L-1组和80 μmol·L-1组迁移和侵袭的细胞数量逐渐减少,且具有浓度依赖性,表明黄芪甲苷可降低Hep-2细胞迁移和侵袭能力。以上结果表明,黄芪甲苷可抑制喉癌Hep-2细胞增殖,诱导癌细胞凋亡,降低癌细胞迁移和侵袭能力。
Apelin/APJ系统是调节血管生成的重要信号因子,在促进恶性肿瘤血管再生过程中具有重要作用,因此Apelin/APJ系统与恶性肿瘤的发生、发展密切相关[15-18]。研究发现,在肺腺癌中Apelin/APJ信号通路通过激活自噬诱导癌细胞迁移和侵袭[19]。CHEN T等[20]研究表明,Apelin13和APJ在结直肠癌中高表达,抑制Apelin13表达可阻碍结肠癌细胞的增殖,诱导癌细胞凋亡。本研究通过蛋白印迹法检测发现,与0 μmol·L-1组比较,20 μmol·L-1组、40 μmol·L-1组、80 μmol·L-1组Apelin和APJ蛋白的相对表达量降低,且具有浓度依赖性,表明黄芪甲苷可抑制Apelin/APJ信号轴的激活。
综上所述,黄芪甲苷可抑制喉癌Hep-2细胞增殖,诱导癌细胞凋亡,降低癌细胞的迁移和侵袭能力,其可能是通过抑制Apelin/APJ信号通路发挥作用,但是本研究仍存在不足,一方面对于Apelin/APJ信号通路发挥作用的具体机制需要深入研究;另一方面,本研究仅在体外探讨黄芪甲苷对喉癌细胞的影响,下一步需要建立喉癌移植瘤小鼠模型,探讨黄芪甲苷在体内的作用。
