柴胡疏肝散对功能性消化不良大鼠AMPK/SIRT3信号通路的影响
2023-11-14王煜姣王香香杨珂鸣叶丽亚叶尔太凌江红
王煜姣,王香香,杨珂鸣,叶丽亚·叶尔太,凌江红
上海中医药大学附属曙光医院消化内科(上海 201203)
功能性消化不良(functional dyspepsia,FD)是临床常见的功能性胃肠病,症状持续、反复,严重影响患者的生活质量,我国FD 的患病率为3.1%~15.6%[1-2]。胃动力障碍是本病的主要发病机制之一,Cajal 间质细胞(ICCs)决定着胃肠道平滑肌收缩的节律[3-4]。柴胡疏肝散出自《景岳全书》,是疏肝理气的经典名方。课题组前期研究[5]发现,柴胡疏肝散可降低FD 模型大鼠胃组织线粒体活性氧(ROS)含量,从而减轻胃组织线粒体氧化应激,进而抑制ICCs线粒体自噬,促进胃动力。腺苷一磷酸(AMP)活化蛋白激酶(AMPK)/沉默信息调节因子3(SIRT3)是氧化应激相关通路之一。为进一步探讨柴胡疏肝散治疗FD 的作用机制,我们观察了该方对FD 模型大鼠氧化应激相关指标及AMPK/SIRT3信号通路的影响,以期为FD的临床诊疗提供参考。
1 材料与方法
1.1 材料
1.1.1 动物 雄性SD 大鼠32 只,体质量180 g 左右,由上海斯莱克实验动物有限责任公司提供。动物生产许可证号:SCXK(沪)2017-0005。动物使用合格证号:20170005059985。所有大鼠饲养于上海中医药大学实验动物中心,室温22~25 ℃,相对湿度(55±10)%,光照、黑暗时间各12 h 交替。本实验方案经上海中医药大学实验动物伦理委员会审核批准(伦理批准号:PZSHUTCM210926008)。
1.1.2 药物与试剂 多潘立酮片,西安杨森制药有限公司(批号:KDJ3YSP),研磨后用蒸馏水配制成浓度为0.45 g/L 的混悬液。柴胡(批号:210526)、白芍(批号:210128)、川芎(批号:210206)、枳实(批号:210630)、陈皮(批号:210711)、香附(批号:210617)、炙甘草(批号:210417),均购自上海中医药大学附属曙光医院中药房。按原方药物配伍比例称取药物并加入没过中药2~3 cm 的蒸馏水浸泡30 min,武火煮沸后转文火继续煎煮15~20 min,留取药液;复煮1次,将两次药液合并后按照课题组前期确定的柴胡疏肝散的最佳给药剂量[6],配制成生药浓度为0.48 g/mL的水煎液。
苏木精-伊红(HE)染色试剂盒、ROS 检测试剂盒、丙二醛(MDA)检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒、过氧化氢酶(CAT)检测试剂盒、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒、放射免疫沉淀法(RIPA)裂解液、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)配制试剂盒,上海威奥生物有限公司(批号分别为C0105S、ER9407M、ER9405M、ER9406M、ER9404M、ER9402M、WB0101、WB0130);SIRT3 兔多克隆抗体,美国Abcam 公司(批号:ab246522);AMPK 抗体、微管相关蛋白轻链3(LC3)抗体、锰超氧化物歧化酶(MnSOD)抗体、泛素结合蛋白P62 抗体,武汉三鹰生物技术有限公司(批号分别为18167-1-ap、18725-1-ap、24127-1-ap、18420-1-ap);辣根过氧化物酶(HRP)标记抗兔二抗、β-肌动蛋白(β-actin)抗体,上海威奥生物有限公司(批号分别为WB0177、WB0196);氯仿、异丙醇、无水乙醇,国药集团化学试剂有限公司(批号分别为20181221、T20090115、20210512);总RNA 提取试剂盒,日本TaKaRa株式会社(批号:AI91731A)。
1.1.3 主要仪器 组织匀浆器,北京鼎昊源公司(型号:TL-2010S);离心机,美国Thermo Fisher Scientific 公司(型号:Fresco21);全波长酶标仪,美国Thermo Fisher Scientific 公司(型号:MutiskanTMGO);伯乐电泳仪,美国Bio-Rad 公司(型号:BIO RAD POWER PAC 3000);荧光定量PCR 仪,瑞士Roche 公司(型号:Roche480Ⅱ);透射电子显微镜,捷克FEI 有限公司(型号:Tecnai G2 spirt);倒置显微镜,德国Leica 公司(型号:DMI3000B);超薄切片机,德国Leica 公司(型号:705902)。
1.2 分组与造模 32 只大鼠适应性喂养7 d 后,随机分为正常组、模型组、柴胡疏肝散组、多潘立酮组,每组8只。除正常组以外,其余各组大鼠均采用改良夹尾刺激法[7]造模。用纱布包裹长持物钳的前端,钳夹大鼠尾巴后1/3 处,大鼠挣扎或尖叫时再予松开;每次30 min,2 次/d,持续4 周。造模4 周后,大鼠胃排空率明显降低,且胃窦组织未发生糜烂、溃疡等器质性病理改变,则为造模成功[8]。
1.3 干预方法 正常组、模型组予质量分数为0.9%的氯化钠溶液灌胃,柴胡疏肝散组和多潘立酮组分别予柴胡疏肝散水煎液(0.48 g/mL)及多潘立酮混悬液(0.45 g/L)灌胃[9]。上述均为10 mL/kg,2次/d(夹尾刺激完成后操作),连续干预4周。
1.4 检测指标与方法
1.4.1 胃排空率 末次给药后,参照文献[10]中的方法配制300 mL(约300 g)营养性半固体糊,按3 mL/只的剂量灌胃。30 min 后用2 %戊巴比妥钠(2.25 mL/kg)麻醉大鼠,暴露全胃后将大鼠贲门及幽门部结扎,取胃组织,称取全胃质量。沿胃大弯将胃组织剪开,用质量分数为0.9%的氯化钠溶液冲洗胃内容物,滤纸拭干,称取空胃质量。胃排空率(%)=[1-(全胃质量-空胃质量)/半固体糊质量]×100%。
1.4.2 胃组织病理 取适量胃窦组织,切片脱蜡后予苏木精染色2 min,伊红染色90 s,60 ℃烘箱处理30 min,光学显微镜下观察胃组织病理变化。
1.4.3 ICCs 线粒体超微结构 取适量胃窦组织,2.5%戊二醛固定2 h,1%锇酸固定液固定2 h,乙醇梯度脱水,环氧丙烷置换,纯环氧树脂(Epon)812包埋,半薄切片定位到肌层ICCs,切片后予枸橼酸铅电子染色,透射电子显微镜观察ICCs线粒体超微结构。
1.4.4 酶联免疫吸附试验(ELISA)法检测大鼠血清氧化应激指标水平 抽取大鼠腹主动脉血5 mL,3 000 r/mim离心10 min,提取血清后冻存于-80 ℃冰箱。取适量血清,按照试剂盒说明书依次加入待测样本,检测各组大鼠血清ROS、MDA、SOD、CAT、GSH-Px水平。
1.4.5 实时荧光定量逆转录聚合酶链式反应(RT-qPCR)法检测大鼠胃组织AMPK、SIRT3、MnSODmRNA 表达水平 取适量大鼠胃组织,用TRIzol 法提取胃组织总RNA,测定浓度及纯度后逆转录为cDNA,体系为20 μL、42 ℃、60 min。以β-actin为内参进行荧光定量PCR 扩增以检测各组大鼠胃组织中AMPK、SIRT3、MnSODmRNA 的表达水平。反应条件:95 ℃、2 min,95 ℃、5 s,60 ℃、10 s;45个循环。用2-ΔΔCt法计算目的基因的mRNA相对表达量。引物序列见表1。

表1 引物序列
1.4.6 Western blot 法检测大鼠胃组织p-AMPK、AMPK、SIRT3、MnSOD、LC3、P62 蛋白表达水平 取适量胃组织打碎离心,加入RIPA 细胞裂解液,冰上裂解30 min 后离心收集上清,提取细胞蛋白。二喹啉甲酸(BCA)法测定细胞总蛋白浓度。各孔取10 mg 的蛋白上样,于10%SDS-PAGE电泳进行蛋白分离(浓缩胶5%,电压80 V,30 min;分离胶10%,电压120 V,60 min)。将分离后的蛋白电转移(300 mA 电流,60 min)至聚偏二氟乙烯(PVDF)膜。加入5%脱脂牛奶封闭液于摇床上室温封闭1 h。用等渗缓冲盐溶液(TBST)洗膜3 次,每次10 min,分别加入p-AMPK、AMPK、SIRT3、MnSOD、LC3、P62 抗体(体积稀释比例均为1∶1 000),β-actin(1∶5 000),4 ℃反应过夜。次日先以TBST洗膜3次,每次10 min。加入HRP 标记的山羊抗兔IgG(1∶2 000),室温反应1 h。再用TBST 洗膜3 次,每次10 min。按化学发光底物(ECL)试剂盒说明进行显影。采用ImageJ图像分析管理系统对蛋白条带灰度值进行分析。
1.5 统计学方法 实验数据采用SPSS 27.0 软件进行处理与分析。计量资料以表示,组间比较用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 对大鼠胃排空率的影响 与正常组比较,模型组大鼠胃排空率降低(P<0.05);与模型组比较,柴胡疏肝散组、多潘立酮组大鼠胃排空率升高(P<0.05);与多潘立酮组比较,柴胡疏肝散组大鼠胃排空率差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠胃排空率比较(n=8,±s,%)

表2 各组大鼠胃排空率比较(n=8,±s,%)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。
组别正常组模型组多潘立酮组柴胡疏肝散组胃排空率62.50±8.31 43.33±7.56*55.42±6.41#56.25±6.53#
2.2 对大鼠胃组织病理的影响 各组大鼠胃窦组织黏膜红润,结构清晰,上皮柱状细胞排列整齐,腺体完整;模型组、柴胡疏肝散组、多潘立酮组大鼠黏膜见少量中性粒细胞,未见糜烂、溃疡等病理改变。见图1。

图1 各组大鼠胃组织病理形态(苏木精-伊红染色,光学显微镜,×100)
2.3 对大鼠胃组织ICCs 线粒体超微结构的影响 正常组大鼠ICCs结构清晰,细胞器结构完整,胞质内有较多线粒体,线粒体呈椭圆形;模型组大鼠ICCs内线粒体肿胀、形态欠规则,分支较多,呈空泡化改变,见自噬小体;柴胡疏肝散组、多潘立酮组大鼠ICCs内线粒体核膜基本完整,结构尚清楚。见图2。
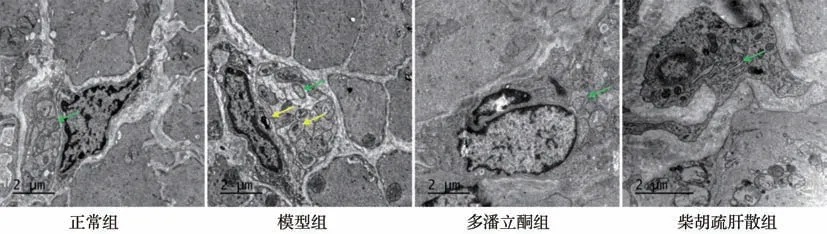
图2 各组大鼠胃组织Cajal间质细胞线粒体结构(枸橼酸铅电子染色,透射电镜,×6 000)
2.4 对大鼠血清氧化应激指标的影响 与正常组比较,模型组大鼠血清ROS、MDA 水平升高(P<0.05),SOD、CAT、GSH-Px 水平降低(P<0.05);与模型组比较,柴胡疏肝散组、多潘立酮组大鼠血清ROS、MDA水平降低(P<0.05),SOD、CAT、GSH-Px 水平升高(P<0.05);与多潘立酮组比较,柴胡疏肝散组大鼠血清ROS、MDA、SOD、CAT、GSH-Px 水平差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠血清ROS、MDA、SOD、CAT、GSH-Px水平比较(n=8,±s)

表3 各组大鼠血清ROS、MDA、SOD、CAT、GSH-Px水平比较(n=8,±s)
注:ROS为活性氧,MDA为丙二醛,SOD为超氧化物歧化酶,CAT为过氧化氢酶,GSH-Px为谷胱甘肽过氧化物酶。与正常组比较,*P<0.05;与模型组比较,#P<0.05。
GSH-Px/(μg·L-1)3.47±0.86 1.42±0.37*3.19±0.44#3.08±0.93#组别正常组模型组多潘立酮组柴胡疏肝散组ROS/(mol·L-1)2.37±1.14 5.60±1.48*2.61±1.01#2.72±1.27#MDA/(μmol·L-1)2.64±1.29 6.06±1.53*3.01±0.94#3.24±1.12#SOD/(U·L-1)8 539.98±2 152.26 4 098.30±1 161.57*7 618.62±1 020.55#7 507.79±1 005.43#CAT/(μg·L-1)6.95±0.72 3.26±1.43*6.51±1.33#6.18±1.29#
2.5 对大鼠胃组织AMPK、SIRT3、MnSODmRNA 水平的影响 与正常组比较,模型组大鼠胃组织AMPK、SIRT3、MnSODmRNA 表达水平降低(P<0.05);与模型组比较,柴胡疏肝散组、多潘立酮组大鼠胃组织AMPK、SIRT3、MnSODmRNA 表达水平升高(P<0.05);与多潘立酮组比较,柴胡疏肝散组大鼠胃组织AMPK、SIRT3、MnSODmRNA 表达差异无统计学意义(P>0.05)。见图3。

图3 各组大鼠胃组织AMPK、SIRT3、MnSOD mRNA表达情况
2.6 对大鼠胃组织p-AMPK、AMPK、SIRT3、MnSOD、LC3、P62 蛋白水平的影响 与正常组比较,模型组大鼠胃组织LC3Ⅱ蛋白表达水平升高(P<0.05),SIRT3、MnSOD、P62 蛋白表达水平及p-AMPK/AMPK 值降低(P<0.05);与模型组比较,柴胡疏肝散组、多潘立酮组大鼠胃组织LC3Ⅱ蛋白表达水平降低(P<0.05),SIRT3、MnSOD、P62 蛋白表达水平及p-AMPK/AMPK 值升高(P<0.05);与多潘立酮组比较,柴胡疏肝散组大鼠胃组织LC3Ⅱ、SIRT3、MnSOD、P62 蛋白表达水平及p-AMPK/AMPK 值差异无统计学意义(P>0.05)。见图4、图5。

图4 各组大鼠胃组织p-AMPK、AMPK、SIRT3、MnSOD、LC3、P62蛋白电泳图

图5 各组大鼠胃组织SIRT3、MnSOD蛋白水平及p-AMPK/AMPK值比较
3 讨论
根据临床表现,FD 可归属于中医学“痞满”“胃脘痛”“纳呆”“呃逆”等范畴。《血证论·脏腑病机论》载:“木之性主乎疏泄。食气入胃,全赖肝木之气以疏泄之,则水谷乃化。”肝郁不舒,横逆克脾犯胃,中焦气机逆乱,则致FD,当以疏肝理气为治。柴胡疏肝散是临床治疗FD 的经典方剂,能有效改善FD 患者消化不良症状及焦虑、抑郁情绪,疗效确切[11-12]。
氧化应激是FD 发生发展中的关键环节,其与ICCs形态及功能密切相关,ICCs 又参与调节胃肠道平滑肌收缩节律[13-14]。线粒体是细胞内产生ROS 的主要场所和氧化应激损伤的靶细胞器。氧化应激发生时,线粒体内ROS、MDA 水平急剧升高,膜通透性增加,三磷酸腺苷(ATP)和钙离子减少,导致线粒体功能异常,机体氧化系统与抗氧化系统失衡[15-18]。
AMPK/SIRT3 通路与线粒体氧化应激关系密切,AMPK 是AMP 活化的蛋白激酶,可调节自噬相关蛋白磷酸化,进而在自噬不同阶段中发挥调节作用[19-20]。SIRT3 是主要的线粒体去乙酰化酶,参与氧化应激、线粒体代谢、细胞死亡等多种生理过程[21]。发生氧化应激时,SIRT3可通过对线粒体及氨基酸代谢中相关蛋白去乙酰化修饰、增强氧化呼吸电子传递链上相关酶的活性等途径,增加线粒体功能稳定性,还可以提高MnSOD、CAT 等抗氧化酶的活性,进而增加ROS 清除率[22-24]。MnSOD 是线粒体的主要抗氧剂,可直接降低细胞内ROS 水平,AMPK 可通过激活SIRT3 增加MnSOD 表达量,进而提高机体的抗氧化应激能力[25-26]。此外,CAT、GSH-Px 可以清除氧化应激产生的过氧化氢,进而阻止高毒性羟基自由基的产生,减轻脂质过氧化的毒性[27-28]。LC3 是自噬体膜的标记蛋白,形成LC3Ⅱ后参与自噬体膜的延伸[29]。P62 是自噬特异性的底物,发生自噬时可被降解[30]。因此,LC3Ⅱ、P62 可作为自噬的观察指标。
本研究结果显示,与正常组比较,模型组大鼠胃排空率降低(P<0.05),且胃窦组织没有出现糜烂溃疡等病理改变,提示FD 模型复制成功;透射电镜观察结果显示,模型组ICCs线粒体肿胀明显,同时有自噬小体形成,提示FD 大鼠胃组织发生ICCs 自噬。与正常组比较,模型组大鼠血清ROS、MDA 水平升高(P<0.05),SOD、CAT、GSH-Px 水平降低(P<0.05),柴胡疏肝散组、多潘立酮组大鼠血清上述氧化应激指标较模型组明显改善(P<0.05)。与正常组比较,模型组大鼠胃组织AMPK、SIRT3、MnSODmRNA 表达水平降低(P<0.05),LC3Ⅱ蛋白表达水平升高(P<0.05),SIRT3、MnSOD、P62蛋白表达水平及p-AMPK/AMPK 值降低(P<0.05);与模型组比较,柴胡疏肝散组、多潘立酮组大鼠胃组织上述指标差异有统计学意义(P<0.05)。
综上,柴胡疏肝散可有效促进功能性消化不良大鼠胃动力,其作用机制可能与激活AMPK/SIRT3通路、减轻线粒体氧化应激、抑制ICCs自噬有关。
