腹部消化系统手术患者术中低体温风险预测模型的构建与验证
2023-11-14方敏高兴莲柯稳王曾妍梁元元
方敏,高兴莲,柯稳,王曾妍,梁元元
(1.华中科技大学同济医学院附属协和医院 手术室,湖北 武汉 430022;2.华中科技大学同济医学院 护理学院,湖北 武汉 430030)
机体核心体温在正常昼夜节律中维持 (36.5±37.5)℃,体温波动不超过1℃[1]。但在手术诊疗、低温治疗等特殊环境下, 核心体温受多种因素影响低于正常范围,患者术中核心体温<36℃可定义为术中低体温[2],是常见的围手术期并发症。 术中低体温发生会给患者带来诸多影响,包括凝血障碍、手术部位感染、麻醉苏醒延迟、心脏功能失常等不良事件,造成患者住院时间延长、医疗费用增加[3-5]。 文献显示,腹部消化系统患者术中非计划性低体温发生率高达70%及以上[6-7],与术前肠道准备、腹部广泛的皮肤消毒、手术时腹腔脏器显露、胃肠手术野冲洗、长时间麻醉等因素息息相关, 接受消化系统手术的患者很难维持核心体温在正常水平。目前,消化系统低体温国内外研究聚焦于保温设备和预防低体温综合措施的应用,术中低体温风险评估或预测研究较少。本研究旨在为接受腹部消化系统手术的患者建立术中低体温风险预测模型,有效预测低体温发生的高危人群,为术中低体温不同风险等级手术患者采用精准干预措施提供理论依据,确保手术期间患者护理质量。
1 对象与方法
1.1 研究对象 基于便利抽样法, 对2021 年12月—2022 年7 月于我院接受消化系统腹部手术的患者进行调查。 纳入标准:(1)行消化系统腹部手术患者;(2)年龄≥18 岁。 排除标准:(1)局麻和(或)全麻非侵入性手术(如消化内镜手术);(2)存在脑血管疾病或外伤导致的中枢高热或体温调节异常;(3)手术患者外耳道疾病, 无法进行鼓膜核心体温监测;(4)术前发生低体温或手术需低温治疗;(5)多次手术或手术数据丢失。 研究已经医院伦理委员会审查([2022]伦审字0283 号)。
1.2 研究方法
1.2.1 研究工具 在国内外低体温研究文献基础上[8-10],通过文献分析与2 轮专家函询筛选术中低体温风险因素,设计形成低体温风险因素调查表。包括:(1)患者一般资料:年龄、性别、BMI、慢性并发症;(2)手术相关资料:手术间环境温度、手术间洁净度、手术分级、手术方式等;(3)手术患者核心体温记录表:术前等待区基线核心体温、手术切皮时体温,手术切皮开始后每30 min 测量1 次体温直到手术结束。
1.2.2 资料收集方法 由统一培训的调查员跟台观察完成患者资料的收集,确保资料收集的真实性。研究以手术患者鼓膜作为核心体温监测部位[11],同一监测时间点的患者鼓膜温度测量3 次, 取平均值作为最终结果并记录。 在患者进入手术室等待手术开始到手术结束, 任意时间点监测到的2 次核心体温<36℃,或核心体温<36℃持续30 min,判定为发生术中低体温[2]。数据经双人录入与核对。最终纳入本研究资料共计395 份,23 份因部分信息不全被排除。
1.3 统计学方法 采用SPSS 26.0 和EmpowerRCH软件进行数据分析和处理。 服从正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t 检验,非正态分布的计量资料以中位数、四分位间距[M(P25,P75)]表示,并使用秩和检验进行组间比较。计数资料以频数和百分比(%)表示,组间比较采用χ2检验或Fisher 精确法。 利用Logistic 回归方程构建预测模型并绘制模型风险列线图,使用500 次Bootstrap 法对模型的预测效能进行验证,评价其区分度、校准度及临床有效性。 所有检验均为双尾检验,P<0.05 被认为差异具有统计学意义。
2 结果
2.1 调查对象的一般资料 研究共纳入395 例患者。年龄为58.00(49.00,67.00)岁,男234 例(59.2%),女161 例 (40.8%), 手术类别为肝胆手术98 例(24.8%),胰腺手术95 例(24.1%),胃肠手术202 例(51.1%)。术中出现低体温患者242 例,发生率为61.3%。
2.2 腹部消化系统手术患者术中低体温的单因素分析 患者被分为低体温组(242 例)和非低体温组(153 例),2 组在年龄、性别、手术间洁净度、手术分级、手术体位、术中失血量、术中冲洗液量、静脉补液总量、血浆或库存血输注、手术准备时间、麻醉时间、手术时间、术前等待区基线核心体温、手术开始时基础体温方面差异具有统计学意义(P<0.05)。 见表1。
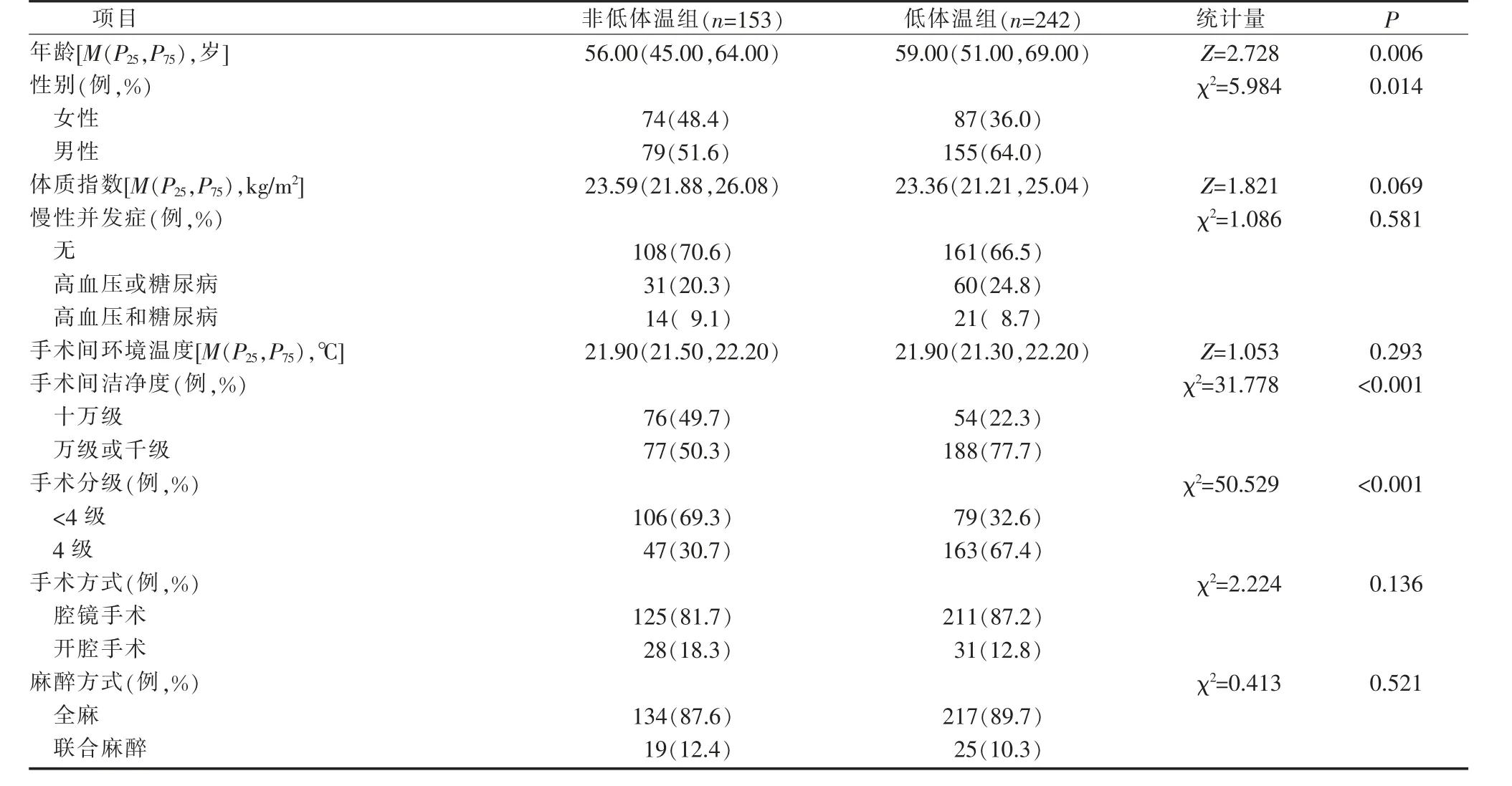
表1 腹部消化系统手术患者术中低体温的单因素分析结果
2.3 腹部消化系统手术患者术中低体温的多因素分析 以是否发生低体温作为因变量, 单因素分析中具有统计学意义的14 个自变量被纳入Logistic多元回归,自变量赋值情况如下:性别(女性=1,男性=2);手术间洁净度(十万级=1,万级或千级=2);手术分级(<4 级=1,4 级=2);手术体位(平卧位=1,大字位=2,截石位=3);术中冲洗液量(<1 000 mL=1,≥1 000 mL=2);术中失血量(<100 mL=1,≥100 mL=2);血浆或库存血输注(无=0,有=1),年龄、静脉补液量等连续变量以原值输入。经共线性诊断,各因子零容忍度均>0.1,方差膨胀因子分别为1.050、1.248、1.283、1.028,表明纳入的危险因素间不存在共线性。结果显示,手术间洁净度、手术分级、麻醉持续时间和手术开始时基础体温是腹部消化系统手术患者术中发生低体温的独立危险因素(P<0.05),见表2。

表2 腹部消化系统手术患者术中低体温的多因素分析结果
2.4 构建列线图模型 根据二分类Logistic 回归分析结果所构造的模型回归方程为:Logit(P)=215.293+1.269×手术间洁净度为万或千级+1.049×手术分级为4 级+0.008×麻醉时间-6.074×手术开始时基础体温。研究采用Nomogram 列线图对最终构建的模型回归方程可视化,每项危险因素以带有刻度的线段进行分数的赋值,通过各个评分相加得到一个总分值,以此判断该结局事件发生的风险概率,见图1。
2.5 模型预测效能评价及临床有效性评价 采用Bootstrap 法内部验证,对所建模型重复抽样500 次。经评价模型的区分度,得到ROC 曲线下面积(AUC)为0.901(95%CI:0.869~0.923),通过最大约登指数(0.623),确定最佳临界值为0.477,灵敏度和特异度分别为0.793 和0.830,详见图2。绘制校准条形图评价模型的校准度, 将每位患者所预测概率按照从小到大排列并分为10 组,判断模型的实际观测值与预测值的差别,结果显示实际值与预测值基本一致,见图3。Hosmer-Lemeshow 拟合优度检验,χ2=3.938,P=0.863,提示模型具有较好的校准度。 绘制DCA 决策曲线分析模型的整体性能, 结果显示, 模型曲线在0~1 的阈值区间内都比极端曲线高, 提示随着阈概率变化, 按照模型预测值进行干预的情况下净获益值高,安全性能好,具有较高的临床有效性,见图4。

图2 腹部消化系统手术患者术中低体温风险预测模型的ROC 曲线

图3 腹部消化系统手术患者术中低体温风险预测模型的校准条形图
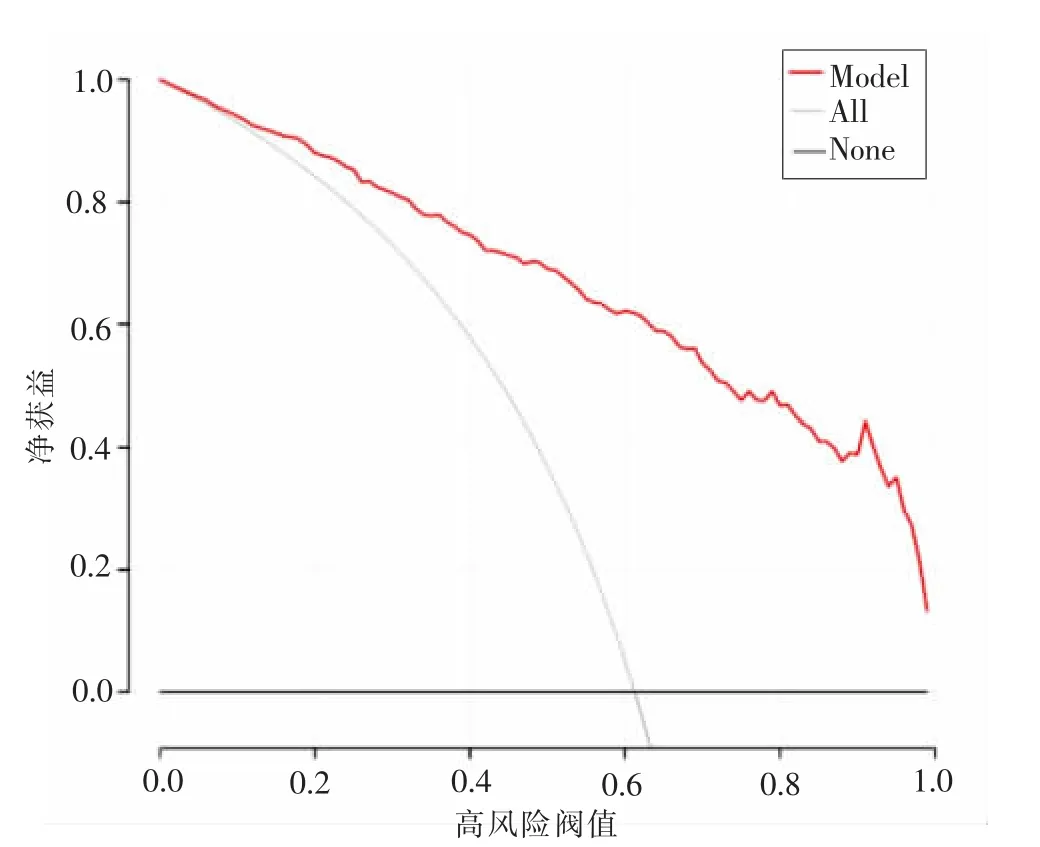
图4 腹部消化系统手术患者术中低体温风险预测模型的DCA 曲线
3 讨论
3.1 腹部消化系统手术患者术中低体温风险因素分析
3.1.1 手术间洁净度高的患者易发生术中低体温手术间空气洁净系统送风使空气产生快速对流、换气,导致患者机体的散热增加,从而增加低体温发生风险[12]。 本研究显示,手术间洁净度对低体温产生的影响居于首位,手术间洁净度要求越高,其空气换气频率、气流强度、换气量越高,患者体表丢失的热量更多[13]。 在洁净度高的手术间,护理人员应当分段调整环境温度, 患者皮肤消毒前将环境温度调高至≥23℃,有条件可降低风速;待术间手术物品和器械等准备完善后,再让患者进入术间,减少术间停留时间,防止机体热量的持续丢失。
3.1.2 手术分级高的患者易发生术中低体温 本研究结果显示,手术分级为4 级的腹部手术患者,其低体温发生率远远高于1~3 级的患者,这与黄培培等[14]的研究结果一致。手术级别越高的手术操作更复杂,手术技术难度高、风险高,手术时间相对较长,术中突发情况频繁,非计划性低体温风险就会更高。临床实践中,医疗人员应严格落实手术分级管理,针对手术级别高的大手术患者,术前、后注意加强覆盖与主动加温,避免患者不必要的体表暴露丢失体温,术中使用加温过的腹腔冲洗液、温热的盐水纱布擦拭血、覆盖肠管,间断式湿润腹腔脏器,减少手术野热量丢失。
3.1.3 麻醉时间长的患者易发生术中低体温 研究显示,全身麻醉后的第1 小时,机体体温迅速下降约1.0~1.5°C,是体温下降最明显阶段,随后体温开始进入缓慢下降期并最终达到一个相对稳定的平台期[15]。但随着麻醉时间的延长,麻醉药物持续高浓度使用,加快热量从核心向外周的再分布速度,导致低体温发生率的明显增加[3,16]。 董涛等[17]研究表明,麻醉持续时间是术中体温过低的独立危险因素, 进一步证实了长时间麻醉对体温带来的不良影响。 手术室医护人员应提高手术物品准备完善率和手术室运营效率,优化手术和麻醉流程,缩短患者手术和麻醉时间,减少热量的再分布。 麻醉诱导前实施至少10 min的预保温[18]被认为是良好的低体温保护措施,封闭式呼吸回路系统用于患者吸入麻醉和控制患者呼吸时,可维持吸入气体的温湿度接近生理状态,减少热量损失,应做好围术期综合保温措施。
3.1.4 手术开始时体温低的患者易发生术中低体温研究中发现,手术开始时体温过低的患者术中体温可降低至34℃,这可能与较低体温的患者其外周与核心组织体温形成的温度梯度差异较大, 麻醉诱导后体温重新分布相对增加, 热获益和热损失平衡更易被打破有关[15]。 本研究结果显示,与术前基线核心体温相比, 手术开始时的核心体温水平对术中低体温的发生更具有预测意义, 手术开始时体温保持稳定且偏高水平, 在对抗术中低体温发生方面发挥着重要作用。在临床实践中,手术室护士应高度关注患者手术开始时的体温, 理想状态下应实时监测患者核心体温,至少平均每15~30 min 记录1 次体温。对手术开始时体温低的患者, 可调节环境温度至手术室团队舒适温度, 并应用充气加温设备等进行综合复温,减少患者寒战发生,提高热舒适度。
3.2 风险预测模型预测效果较理想,具有临床价值本研究构建的腹部消化系统手术患者低体温风险预测模型具有良好校准和区分能力, 临床可及性较强。在临床实践中,护理人员可按照该列线图模型评估并量化该类手术患者发生低体温的风险概率,根据手术间洁净度、手术分级、麻醉时间和手术开始时的体温, 来推断手术过程中体温过低的风险,并相应地实施针对性的干预措施, 如术间温度保持在≥21℃基础上,可分段调控术间室温;术野减少不必要的腹腔脏器暴露;麻醉气体湿化加热;加强低体温监测手段落实, 有条件应进行动态连续性的核心体温监测,纠正手术开始时体温,从而为术中低体温高危人群提供及时、有效、科学地快速反馈,有目的降低术中低体温发生率, 避免腹部手术后出现胃肠感染、吻合口渗漏、腹腔脏器出血,保证患者手术过程中的质量与安全。 此外,本研究发现,所纳入的主动与被动加温2 种干预方式对术中低体温发生无明显影响, 这可能反映了由于临床医护人员缺少风险评估或风险预测的指导,导致干预措施没有差异,进一步说明构建的风险预测模型有着重要临床意义。
4 结论
本研究基于前瞻性研究数据, 建立适合腹部消化系统手术患者术中低体温的风险预测模型, 基于预测概率分级实施精准预防, 对低风险概率患者避免过度干预, 减轻临床医护人员工作量和避免医疗资源浪费;对低体温中高风险患者采用针对性措施,降低低体温发生率。但局限性在单中心研究,选择接受腹部消化系统手术患者的样本量相对有限, 可为未来多中心、大样本研究奠定基础,持续修正优化该预测模型,在临床实践广泛推广使用。
