茄子自噬相关基因ATG8家族鉴定及表达分析
2023-11-14张静娴周晓慧刘松瑜
张静娴,刘 军,周晓慧,刘松瑜,庄 勇,,杨 艳,*
(1 南京农业大学 园艺学院,南京 210095;2 江苏省农业科学院蔬菜研究所,江苏省高效园艺作物遗传改良重点实验室,南京 210014)
自噬(Autophagy)是真核生物中一种保守的细胞内成分降解过程。在这个过程中,受损蛋白和细胞器等大分子可被转运至植物细胞的液泡中,随后被水解酶降解并回收利用[1-2]。植物自噬通常被分为巨自噬(macroautophagy)、微自噬(microautophagy)和超级自噬(mega-autophagy)3类[3]。其中,巨自噬作为更为普遍更主要的形式存在,常被简称为自噬。它的发生主要包括双层膜的自噬小泡(autophagosome)包裹目标物,然后转移至液泡中,与液泡膜融合形成单层膜的自噬小体(autophagic body),后经液泡中水解酶降解。已有大量研究报道表明,自噬在植物生长发育和响应各种胁迫过程中发挥重要的作用[4]。参与自噬过程的基因被统一命名为自噬相关基因(autophagy-related gene,ATG)[5]。自噬全过程由多个ATG共同参与发生,目前已在真核生物中鉴定出40多种ATG基因[6],这些ATG基因在自噬过程中发挥各自的功能。其中,ATG8基因编码泛素类蛋白,可与磷脂乙醇胺结合,参与自噬体的延伸和成熟,在自噬体形成过程中起到重要作用,因此也通常被用作为自噬体的标记蛋白[7]。ATG8蛋白还可作为对接平台,通过与自噬受体的互作来促使自噬小泡进行货物选择,从而使细胞选择性地对一些受损的细胞器和蛋白聚集体等特异性降解[8]。例如,ATG8分别与自噬选择性受体DSK2(dominant suppressor of KAR2)和RPN10(RP nonATPase subunit)互作介导拟南芥油菜素内酯下游转录因子BES1和26s蛋白酶体的选择性自噬降解,从而平衡干旱和缺氮胁迫下植物的生长[9-10],因其在自噬中的重要作用,目前ATG8基因已陆续在拟南芥、水稻、小麦等物种中被鉴定出来[11-13]。
茄子(SolanummelongenaL.)是中国重要的茄果类蔬菜作物。随着茄子基因组的不断完善,从基因组水平对茄子中重要的基因家族进行鉴定和功能分析已成为可能。鉴于ATG8基因对植物生长发育和环境响应的重要性,本研究从基因组水平对茄子的ATG8基因家族进行鉴定,利用生物信息学分析其进化关系和启动子元件等,并对其在不同器官、冷胁迫及激素下的表达量进行分析,为后期深入研究茄子ATG8基因的功能提供基本信息,为进一步探究ATG8家族在茄子逆境响应及生长发育中的作用机制奠定基础,同时为遗传改良提供基因资源。
1 材料和方法
1.1 试材及取样
以‘三月茄’为试验材料,种植于光照16 h,28 ℃,黑暗8 h,24 °C的生长室中。待植株生长至四叶一心期,将一部分植株转移至4 ℃的生长箱中进行冷胁迫处理,同时将另一部分植株的叶片离体浸泡在100 μmol/L ABA、2 mmol/L SA和100 μmol/L MeJA中进行外源激素处理。对冷胁迫和激素处理按照0,3,6,12,24 h取样,以正常条件下培养的茄子作为对照,不同组织器官材料取于同一发育时期的根、茎、叶、花瓣、花萼、花药、柱头、子房、果肉。上述所有取样进行3次重复,取样后立即置于液氮中,-80 ℃冰箱保存备用。
1.2 茄子ATG8基因家族鉴定和理化分析
从茄子基因组数据库(http://eggplant-hq.cn/Eggplant/home/index)获得茄子所有蛋白序列。以已报道的拟南芥和番茄的ATG8蛋白序列为查询序列,通过本地Blast比对获得茄子ATG8家族成员,对由这2个物种BLAST获得的蛋白序列进行整理合并,去除重复序列,得到候选序列。将候选序列在Conserved Domains Database(CDD:https://www.ncbi.nlm.nih.gov/Structure/cdd/cdd.shtml)和SMART(http://smart.embl-heidelberg.de/smart/set_mode.cgi?NORMAL=1)中进一步鉴定,去掉ATG8结构域不完整的蛋白序列,最终获得茄子ATG8家族成员[14]。运用在线软件Protparam(http://us.expasy.org/tools/protparam.html)分析茄子ATG8成员分子量、等电点等理化性质。
1.3 茄子ATG8亚家族成员生物信息学分析
利用在线软件MEME(http://meme-suite.org/tools/meme)搜索茄子ATG8基因编码蛋白的保守基序。根据全基因组的GFF格式的注释文件,提取茄子ATG8基因家族成员序列中的非翻译区、编码序列和内含子的结构信息,通过TBtools软件对ATG8基因结构进行图形可视化。使用MEGA11软件中的MUSCLE方法对茄子、拟南芥和番茄ATG8家族成员进行多序列比对,采用最大似然法生成进化树,设置校验参数Bootstrap的重复次数为1 000。为了进一步研究ATG8基因在物种间的进化关系,利用TBtools对茄子、拟南芥和番茄之间的共线性关系进行分析。从茄子的基因组中获取ATG8翻译起始位点ATG上游分析2 000 bp的序列为启动子区域,在PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)网站进行启动子顺式作用元件分析,并利用TBtools绘制茄子ATG8基因启动子顺式作用元件分布图。
1.4 茄子ATG8基因家族表达分析
采用RNAprepPure多糖多酚植物总RNA提取试剂盒[天根生化科技(北京)有限公司]对不同处理和组织的样本RNA进行提取。参照全式金公司的TransScript All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)进行第一链的合成。根据茄子ATG8基因序列设计荧光定量PCR引物(表1),采用实时荧光定量PCR仪(罗氏,瑞士)进行qRT-PCR检测,利用2-ΔΔCT法分析数据,确定基因的相对表达量。每个反应进行3次重复。

表1 茄子ATG8基因荧光定量PCR引物序列
2 结果与分析
2.1 茄子ATG8基因亚家族成员鉴定
将拟南芥和番茄ATG8蛋白序列分别在茄子蛋白数据库中比对、整理后得到7个茄子ATG8基因,根据与拟南芥和番茄ATG8基因的序列相似度分别对应命名ATG8a~ATG8f和ATG8i。茄子ATG8基因编码的氨基酸数在118~166 aa之间(图1、表2),蛋白分子量介于13.56~19.11 kD之间,等电点为6.29~9.16,整体偏碱性;根据不稳定蛋白判定标准,ATG8e和ATG8f不稳定系数小于40,为稳定蛋白,其余均为不稳定蛋白(表2)。利用DNAMAN软件进行氨基酸序列比对显示,茄子ATG8基因编码的蛋白氨基酸序列一致性达到62.39%(图1)。

图1 茄子ATG8基因家族多序列比对
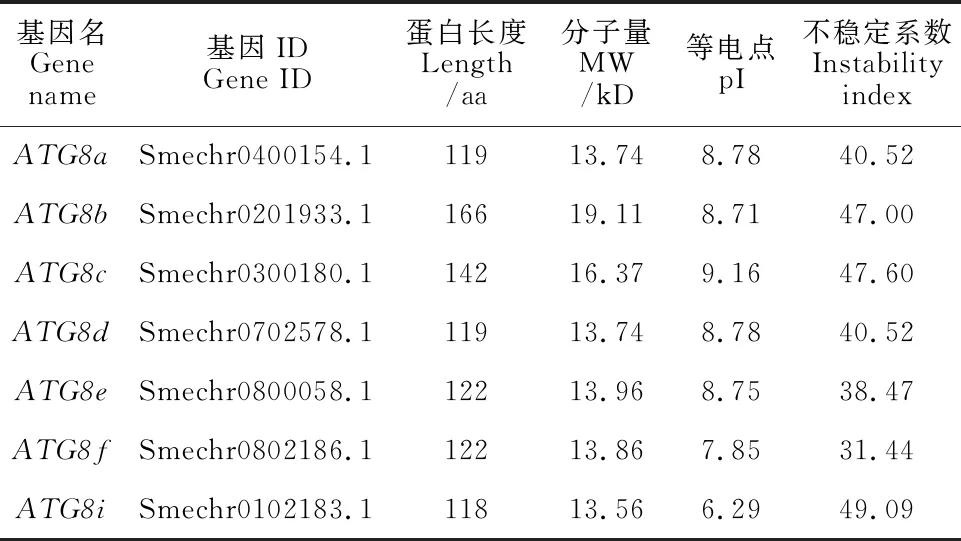
表2 茄子ATG8基因的基本信息
2.2 茄子ATG8 基因结构及蛋白基序分析
ATG8基因家族成员的基因结构分析结果显示,除了ATG8b之外,其余6个ATG8基因均具有包含5个外显子的结构,而ATG8b有6个外显子(图2,A),说明茄子ATG8基因结构较为保守。对ATG8家族蛋白序列进行保守基序分析,共获得3个motif,分别命名为motif 1~motif 3(图2,B)。motif 1和motif 2高度保守,7个茄子ATG成员都含有这2个基序。motif 3也较为保守,只有ATG8i不含有motif 3,可能是ATG8i蛋白在进化中氨基酸改变所致。将motif序列提交至线上网站(http://www.ebi.ac.uk/Tools/pfa/iprscan/)对motif进行注释,发现motif 1和motif 2均为自噬蛋白ATG8类泛素(autophagy protein ATG8 ubiquitin-like),这表明了鉴定结果的准确性。Motif 3是1个未知功能的基序,说明与ATG8i不同,ATG8a~ATG8f蛋白可能存在其他的功能。
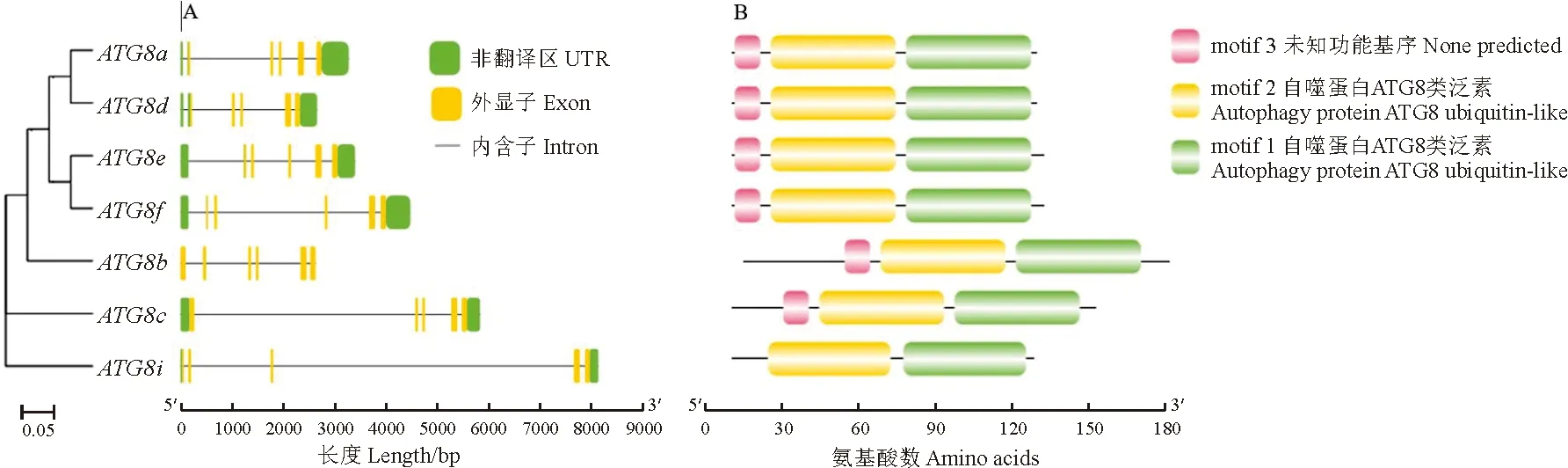
图2 茄子ATG8基因家族的基因结构(A)和保守基序(B)分布
2.3 茄子ATG8基因进化分析及染色体定位
为了探究ATG8基因的进化,将7个茄子ATG8蛋白序列、7个番茄ATG8蛋白序列和9个拟南芥ATG8蛋白序列进行多重序列比对,构建发育树。如图3,A显示,根据进化关系,这23个ATG8基因可被分为Ⅰ类和Ⅱ类。3个物种的ATG8i和ATG8h聚类在一起,属于第Ⅱ类。ATG8a~ATG8g聚类在1个分支,且ATG8a~ATG8d和ATG8e~ATG8f序列相似性分别更高。此外,从图3,A可以看出SmATG8基因与SlATG8基因聚类在一起,说明番茄与茄子基因进化关系更为保守。
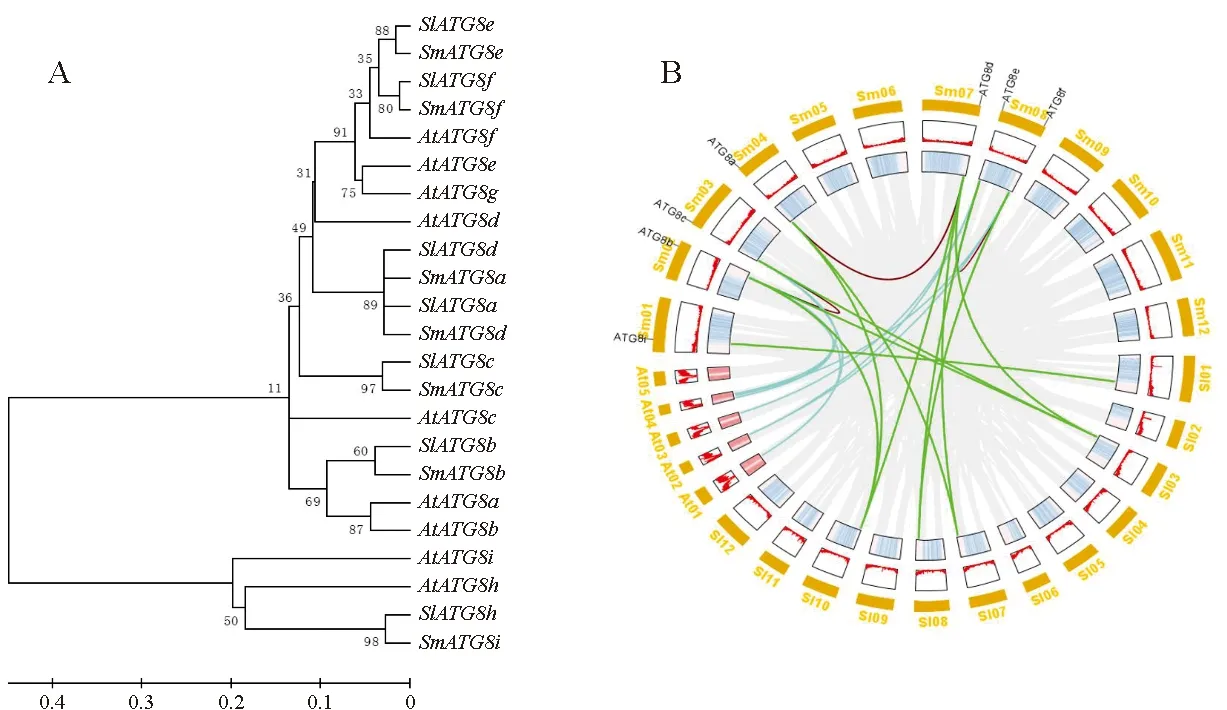
图3 茄子、番茄和拟南芥ATG8家族系统进化树(A)和共线性(B)
为了进一步研究ATG8基因在物种间的进化关系,绘制茄子、番茄和拟南芥ATG8基因的物种间共线性图。茄子中有7个ATG8与番茄的5个ATG8基因存在11对共线性关系。茄子中有4个ATG8与拟南芥6个ATG基因成员间存在10对共线关系,说明茄子与番茄的共线性多于拟南芥。如图3,B所示,茄子的7个ATG8基因分布于6条染色体上,其中ATG8a分布在第4号染色体上,ATG8b分布在第2号染色体上,ATG8c分布在第3号染色体上,ATG8d分布在第7号染色体上,ATG8e和ATG8f同时分布在第8号染色体上,ATG8i则分布在第1号染色体上。因此,ATG8a和ATG8d,ATG8b和ATG8c这2对属于片段复制基因,而ATG8e和ATG8f属于串联复制基因。
2.4 茄子ATG8家族顺式作用元件分析
对茄子ATG8基因启动子区进行顺式作用元件分析,结果(图4)显示,茄子ATG8基因家族成员启动子区域有大量激素响应元件。例如,除ATG8i,其他ATG8基因都含有生长素响应元件(TGA-element或者AuxRR-core)。ATG8a、ATG8b、ATG8e、ATG8f和ATG8i均含有脱落酸响应元件(ABRE),ATG8a、ATG8b、ATG8d、ATG8f和ATG8i均含有乙烯响应元件(ERE),ATG8b、ATG8c、ATG8d、ATG8f和ATG8i均含有MeJA响应元件(CGTCA-motif或者TGACG-motif),ATG8b、ATG8d、ATG8f这3个基因均含有赤霉素响应元件(TATC-box或者P-box),而水杨酸响应元件(TCA-element)只存在于ATG8d。此外,茄子ATG8成员启动子区也存在与逆境胁迫响应相关的元件,如参与干旱诱导的MYB结合位点,厌氧胁迫响应元件(ARE)和低温胁迫元件(LTR)等。每个ATG8成员都至少含有1个激素响应元件和胁迫响应元件,这表明ATG8基因能够在茄子逆境和激素响应中发挥重要作用。
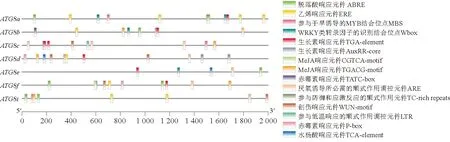
图4 茄子ATG8基因启动子顺式作用元件
2.5 茄子ATG8基因家族的组织表达分析
自噬在植物生长发育过程中发挥了重要作用。本研究利用qRT-PCR技术分析了7个ATG8基因在茄子不同的组织器官中的表达,以探究ATG8是否与茄子生长发育相关。以根中的表达量为对照,如图5所示,ATG8a和ATG8e都是在花瓣、花药、花萼和果肉中存在高表达,ATG8b在花药、花萼、柱头和子房中表达。ATG8c在叶片、花药和果肉中高表达,在子房中低表达。ATG8d只在花瓣和花药中高表达,在其他组织中无差异表达。ATG8f在花瓣、花药、柱头和果肉中高表达,在茎和子房中低表达。ATG8i在茎、花瓣、花药、花萼、柱头和果肉中高表达,可见所有的茄子ATG8能够在不同的花器官中差异表达,表明其可能与茄子花发育有关。
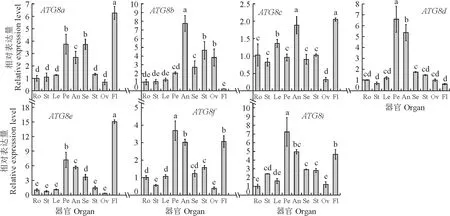
Ro.根;St.茎;Le.叶;Pe.花瓣;An.花药;Se.花萼;St.柱头;Ov.子房;Fl.果肉。柱状图上不同小写字母表示差异显著(P<0.05)。下同。
2.6 茄子ATG8基因家族对冷胁迫和外源激素的响应分析
茄子ATG8基因启动子区富集了多种激素响应相关的顺式作用元件,表明茄子ATG8基因可能参与激素响应。因此,利用qRT-PCR对ATG8基因响应ABA、MeJA和SA进行分析,结果发现7个ATG8家族基因在不同激素处理下表达水平出现了波动(图6)。其中ATG8d的表达受到这3种激素处理的抑制,其他6个ATG8基因的表达均在ABA处理后的12 h达到峰值,其中ATG8f响应最迅速,ABA处理后3 h就受到诱导(图6)。MeJA处理后除了ATG8c和ATG8d的表达受到了抑制,ATG8a和ATG8e的表达都是先降后升,ATG8f和ATG8i都是在处理后12 h有诱导响应,而ATG8b在处理后3 h即被诱导(图6)。SA处理后,ATG8c和ATG8d的表达也受到了抑制,ATG8a、ATG8b、ATG8e、ATG8f和ATG8i的表达均受到诱导,其中ATG8b的响应最为剧烈,相对表达量达到了30倍,ATG8f响应最晚,在处理后24 h才开始被诱导,而ATG8i的表达则是先降后升,在12 h达到峰值(图6)。
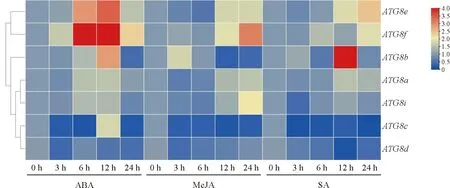
图6 外源ABA、MeJA和SA处理后茄子ATG8基因的表达量热图
茄子是主要的设施栽培蔬菜作物,其生长过程中经常遭遇冷害影响。自噬能够调控植物耐冷性,因此,为了探究ATG8基因是否参与茄子耐冷过程,本研究利用qRT-PCR技术分析ATG8基因对冷胁迫的响应。如图7示,除了ATG8b的表达受到冷胁迫抑制,其他6个ATG8基因的表达在不同的程度上均受到了冷胁迫的诱导,且对冷胁迫的响应迅速,在冷处理后3 h的表达量产生显著变化。其中ATG8a的表达在冷处理3 h即达到峰值,随后下降。ATG8c、ATG8d、ATG8e、ATG8f和ATG8i这5个ATG8基因在冷处理的表达模式为先升后降再升。7个ATG8基因呈现出不同的表达模式,表明茄子ATG8在冷处理的不同阶段表达,对冷处理响应的分工不同。
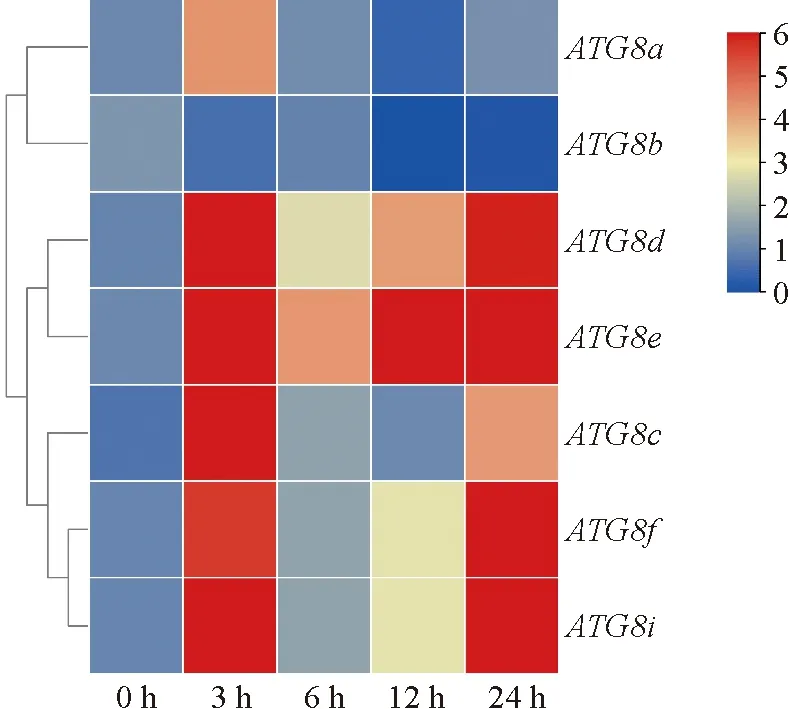
图7 冷处理后茄子ATG8基因的表达量热图
3 讨 论
由于ATG8功能的重要性,植物中已陆续有对ATG8基因鉴定的报道。虽然最早发现自噬存在的酿酒酵母中ATG8成员数量只有1个,但为了适应不利和复杂的环境,ATG8基因家族已通过全基因组复制在植物中经历了大规模的扩张[15]。因此,植物ATG8蛋白家族已从单个成员扩张到多个,例如玉米ATG8家族成员数量为5个[16],水稻ATG8家族成员数量有7个[12],拟南芥ATG8家族成员数量有9个[11],香蕉有10个ATG8家族成员[17],而小麦有比较多的家族成员,数量为13个[13]。本研究从茄子基因组中鉴定出7个ATG8基因,说明茄子为适应不利环境也进行了ATG8基因家族的扩张。由于ATG8蛋白能选择各种目标物,因此茄子ATG8的扩张可能也导致了茄子选择性自噬的多样性。
本研究鉴定到的茄子ATG8基因结构相对简单一致,除ATG8b含有6个外显子,其余6个ATG8基因都只含有5个外显子。茄子7个ATG8基因编码的蛋白含有的保守基序也基本一致。其中注释为自噬蛋白ATG8类泛素的motif 1和motif 2存在于所有ATG8蛋白中,且排列顺序也高度一致。这2个高度保守的motif 是鉴定ATG8家族成员的重要依据。仅ATG8i不含有未知功能的motif 3,因而ATG8i发挥的功能可能没有其他ATG8蛋白的多样化。研究表明,基因复制有助于基因家族的形成和成员数量扩增[18],而根据基因在染色体上的位置可以对旁系同源基因对进行基因复制事件的分类[19]。本研究从7个ATG8基因共鉴定出3对旁系同源基因ATG8a和ATG8d,ATG8b和ATG8c以及ATG8e和ATG8f,其中1对串联复制2对基因片段复制。与这3对复制基因不同的是,存在1个单独的非复制基因ATG8i。茄子ATG8i与拟南芥的ATG8i和ATG8h及番茄的ATG8h进化关系较近,同属于第二类,这个结果与Seo等[20]对18种植物的ATG8和ATG4进化分析结果一致,即植物ATG8i和ATG8h聚类在一起,而ATG8a-ATG8d,ATG8e-ATG8g分别聚在一起。蛋白基序分析结果、进化树和共线性的结果高度一致,这表明茄子ATG8i可能经历了快速的进化。
茄子、番茄和拟南芥3种作物ATG8蛋白的系统进化关系可以初步揭示茄子ATG8蛋白的功能。聚类分析显示,茄子ATG8基因与番茄中相应的家族成员位于同一分支,进化关系很近。一般情况下,同一分支上的家族蛋白具有相似的结构域和功能域,因此功能也趋于保守[21]。番茄BAG8和BAG9沉默植株对冷的敏感性增强,ATG8a表达受到抑制,泛素化蛋白积累增多,说明番茄ATG8a参与调控番茄耐冷性[22]。本研究发现与番茄ATG8a高度同源的茄子ATG8a能对冷胁迫做出及时的响应。ATG8a启动子区虽然不含有低温响应元件,但包含2个WRKY转录因子结合的W-box。Yang等[23]利用病毒诱导的基因沉默证实WRKY26正调控茄子耐冷性。因此,茄子ATG8a极有可能受到WRKY转录因子调控参与茄子耐冷。此外,番茄中已报道ATG8a、ATG8b、ATG8c、ATG8e和ATG8f能依赖于油菜素内酯BR的含量被冷胁迫显著诱导[24]。同属于茄科作物,茄子ATG8基因在植株遭受冷胁迫后确实都能有显著表达,说明茄子ATG8可能在茄子响应冷胁迫中存在生物学功能。茄子属于喜温作物[25],因此研究ATG8对冷胁迫的响应,可为茄子耐冷遗传改良提供基因资源。基因的组织表达特征与其在植物生长发育中的功能紧密相关。本研究发现茄子所有的ATG8基因在花药中都特异性高表达。Takamitsu等[26]研究发现,自噬是水稻花药代谢调节和营养供应所必需的。因此,ATG8基因也可能参与了茄子花药发育过程。7个ATG8基因分别在不同的花器官中都存在较高水平的表达,说明茄子ATG8在不同部位的花器官发育中具有生物学功能。
