四磨汤口服液改善功能性消化不良模型大鼠的作用机制Δ
2023-11-14符佳周赛男湖南中医药大学第一附属医院脾胃病科长沙410007
符佳,周赛男 (湖南中医药大学第一附属医院脾胃病科,长沙 410007)
功能性消化不良(functional dyspepsia,FD)是最常见的功能性胃肠疾病之一,以餐后饱胀、上腹部疼痛和上腹部烧灼感为典型症状[1]。目前,胃动力障碍被认为是FD的病理生理学特征之一,并与消化不良症状密切相关[2]。虽然促动力药、抗酸剂和抗抑郁药可用于治疗FD,但其存在副作用和耐药性,因此开发新的FD治疗药物成为必要[3]。
四磨汤口服液是根据明代《痘疹金镜录》中四磨汤所研制的一种中药制剂,由槟榔、乌药、枳壳、木香组成[4],主要用于治疗消化系统疾病,其作用可能是通过调节消化系统的胃肠激素和促进平滑肌收缩来促进胃肠动力[5]。卡哈尔间质细胞(interstitial cells of Cajal,ICC)是胃肠慢波活动的“起搏器”,通过传递兴奋性和抑制性信号影响胃肠运动,在肠运动中发挥重要作用[6]。相关研究发现,抑制ICC线粒体自噬能够改善FD模型大鼠线粒体损伤并促进其胃动力[7]。PTEN诱导假定激酶1(PTEN-induced putative kinase 1,Pink1)/E3泛素连接酶(E3ubiquitin ligase,Parkin)轴是最经典的自噬途径,Pink1和Parkin之间的相互作用对线粒体自噬的启动和调节至关重要[8]。四磨汤口服液是否可通过影响Pink1/Parkin轴改善FD尚不明确。基于此,本研究建立FD模型大鼠,并基于线粒体自噬和Pink1/Parkin轴探讨四磨汤口服液对FD模型大鼠的改善作用机制,以期为临床治疗FD提供参考。
1 材料
1.1 主要仪器
Thermo型热电FC酶标仪购自上海联迈生物工程有限公司;VHX-7000N型透射电子显微镜购自日本Keyence公司;STELLARIS 5型激光共聚焦显微镜购自德国Leica公司;iBright FL1500型凝胶成像系统购自美国Thermo Fisher Scientific公司。
1.2 主要药品与试剂
四磨汤口服液(国药准字Z20025044,批号221026,每1 mL相当于饮片0.15 g)购自湖南汉森制药股份有限公司;多潘立酮片(批号220809,规格10 mg)购自西安杨森制药有限公司;胃动素(motilin,MTL)、胃泌素(gastrin,GAS)、胆囊收缩素(cholecystokinin,CCK)酶联免疫吸附测定(ELISA)检测试剂盒(批号分别为R38269、R38270、R37102)均购自上海酶研生物科技有限公司;兔源微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)、p62单克隆抗体和甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体及鼠源细胞色素C氧化酶Ⅳ(cytochrome C oxidase Ⅳ,COX Ⅳ)、Pink1、Parkin单克隆抗体(批号分别为ab128025、ab207305、ab9485、ab33985、ab186303、ab77924)均购自英国Abcam公司;BCA蛋白定量试剂盒(批号12L026)购自和元李记(上海)生物技术有限公司;过氧化物酶标记的山羊抗兔免疫球蛋白G(IgG)二抗和过氧化物酶标记的山羊抗大鼠IgG二抗(批号分别为33116、33101)均购自翌圣生物科技(上海)股份有限公司;异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的山羊抗大鼠IgG二抗(批号1041)购自武汉伊莱瑞特生物科技股份有限公司。
1.3 动物
本研究所用动物为SPF级SD雄性大鼠,共90只,6周龄,体重160~180 g,购自湖南斯莱克景达实验动物有限公司,动物生产许可证号为SCXK(湘)2019-0004。所有大鼠均饲养在湖南中医药大学第一附属医院中医内科学实验室中,动物使用许可证号为SYXK(湘)2019-0009。饲养环境的温度为24~26 ℃,相对湿度为50%~60%。本研究经湖南中医药大学第一附属医院实验动物伦理委员会批准后实施,批准号为ZYFY20210915。
2 方法
2.1 FD大鼠模型的制备
将大鼠适应性饲养1周后,随机选取20只大鼠作为空白组,正常饲养。其余大鼠均采用不可预知的慢性应激法制备FD大鼠模型[9],每日随机选取下述9种刺激之一,且相邻2 d不重复:(1)食物剥夺(24 h);(2)饮水剥夺合并空瓶刺激(12 h);(3)倒悬(30 min);(4)束缚(30 min);(5)夹尾(1 h);(6)明暗颠倒(24 h);(7)湿笼饲养(24 h);(8)超声刺激(2 h);(9)强迫游泳(45 ℃,5 min)。连续刺激21 d。当大鼠表现出易怒、行动缓慢、体重增长以及排稀便等症状,表明FD模型建立成功[10]。
2.2 动物分组及给药处理
将造模成功的60只大鼠随机分为模型组、阳性对照组、四磨汤组,每组20只。阳性对照组大鼠灌胃3.5 mg/kg多潘立酮片溶液[11],四磨汤组大鼠灌胃5.4 mL/kg四磨汤口服液(为临床等效剂量),空白组和模型组大鼠均灌胃等体积生理盐水,每天1次,持续14 d。
2.3 样本采集
末次给药结束后,用1%戊巴比妥钠(40 mg/kg)麻醉大鼠,然后腹主动脉采血3 mL于离心管中,放置2 h后在4 ℃下以3 000 r/min离心15 min,收集上清液保存于-20 ℃冰箱中备用。每组随机选取15只大鼠,断颈处死后对大鼠进行剃毛消毒,无菌条件下解剖并分离胃窦组织,然后每组随机挑取5个组织立即置于2.5%戊二醛中固定2 h,另每组取5个组织置于4%多聚甲醛中固定,剩余组织均冻存于-80 ℃冰箱中。
2.4 大鼠血清中胃肠激素的含量检测
取出“2.3”项下保存的血清,置于冰上溶解,然后按试剂盒说明书方法操作,检测大鼠血清中胃肠激素MTL、GAS和CCK的含量。
2.5 大鼠胃排空率检测
采用酚红含量法进行检测。将每组剩余的5只大鼠禁食18 h,然后灌胃含有0.05%酚红的1.5%羧甲基纤维素钠盐溶液0.5 mL,20 min后麻醉并处死大鼠,取出胃组织。以10 mL的0.1 mol/L碳酸氢钠溶液冲洗胃组织,收集胃内容物并以3 500 r/min离心15 min,收集上清液。使用酶标仪在558 nm波长处测定吸光度(A),记为实测酚红A。在另外的容器中加入含有0.05%酚红的1.5%羧甲基纤维素钠盐溶液0.5 mL和0.1 mol/L碳酸氢钠溶液10 mL,搅拌均匀后测定其在558 nm波长处的A,记为标准酚红A。计算各组大鼠的胃排空率:胃排空率(%)=(1-实测酚红A/标准酚红A)×100%。
2.6 大鼠小肠推进率检测
在“2.3”项下取出胃组织后,各组大鼠随机取5只剪下幽门至回盲部的一段肠道组织,将其置于无菌的玻璃板上,不设任何牵引力,测量取下的肠管总长以及酚红溶液自幽门向盲肠推进的距离。计算小肠推进率:小肠推进率(%)=酚红溶液自幽门向盲肠推进距离/肠管总长×100%。
2.7 大鼠胃窦组织中ICC线粒体结构观察
将“2.3”项下固定2 h后的胃窦组织冲洗干净,再以1%锇酸固定2 h;经双蒸水冲洗后,以乙醇脱水10 min,再以环氧丙烷孵育20 min后,以Spurr树脂包埋剂进行包埋。采用透射电子显微镜观察并拍照。
2.8 大鼠胃窦组织中COX Ⅳ、Parkin在线粒体中共定位表达的检测
采用免疫荧光共定位法进行检测。将“2.3”项下固定于4%多聚甲醛中的胃窦组织取出,进行常规石蜡包埋和切片(4 μm);切片经二甲苯和梯度乙醇脱蜡水化后,放入抗原修复液中,于95 ℃下水浴15 min;冷却至室温后,以0.5%牛血清白蛋白封闭1 h,加入COX Ⅳ、Parkin一抗(稀释度为1∶200),4 ℃封闭过夜;加入FITC标记的山羊抗大鼠IgG二抗(稀释度为1∶500),室温避光孵育1 h;以磷酸盐缓冲液清洗后,用含DAPI的抗荧光猝灭封片剂封片;10 min后在激光共聚焦显微镜下观察COX Ⅳ、Parkin的染色情况,并利用Image J软件分析其共定位表达的面积。其中,COX Ⅳ抗体标记线粒体为红色,Parkin抗体标记Parkin为绿色,DAPI标记细胞核为蓝色;若Parkin进入线粒体,则共定位显示为黄色或橙色。
2.9 大鼠胃窦组织中LC3、p62、Pink1、Parkin蛋白表达的检测
采用Western blot法进行检测。将“2.3”项下冻存的胃窦组织取出,加入RIPA裂解缓冲液进行匀浆,并在4 ℃下以10 000 r/min离心15 min,取上清液用BCA试剂盒测定其中总蛋白浓度。将100 μg蛋白样品溶解在溴酚蓝上样缓冲液中进行煮沸变性,然后每孔上样20 μg进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,并湿转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。在室温下用5%脱脂牛奶封闭孵育PVDF膜1 h,加入LC3、p62、Pink1、Parkin、GAPDH一抗(LC3、p62、Pink1稀释度为1∶1 000,Parkin稀释度为1∶2 000,GAPDH稀释度为1∶2 500),4 ℃孵育过夜;洗膜后,加入过氧化物酶标记的山羊抗兔或山羊抗大鼠IgG二抗(稀释度为1∶3 000),室温孵育1 h;以TBST洗涤3次后,在ECL溶液中避光孵育5 min。采用凝胶成像系统成像并拍照,采用Image J软件进行灰度值分析。以目的蛋白与内参蛋白(GAPDH)灰度值的比值表示目的蛋白的表达水平;其中LC3在细胞中以LC3Ⅰ和LC3Ⅱ 2种形式存在,以LC3Ⅱ/LC3Ⅰ的比值表示LC3蛋白的表达水平。
2.10 统计学方法
采用Graphpad prism 8.0软件对数据进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用Tukey检验。检验水准α=0.05。
3 结果
3.1 四磨汤口服液对大鼠血清中MTL、GAS、CCK含量的影响
与空白组比较,模型组大鼠血清中MTL、GAS含量均显著降低(P<0.05),CCK含量显著升高(P<0.05);与模型组比较,阳性对照组和四磨汤组大鼠血清中MTL、GAS含量均显著升高(P<0.05),CCK含量均显著降低(P<0.05);四磨汤组与阳性对照组比较,上述指标差异均无统计学意义(P>0.05)。结果见表1。
表1 各组大鼠血清中MTL、GAS、CCK含量测定结果(±s,n=20,pg/mL)
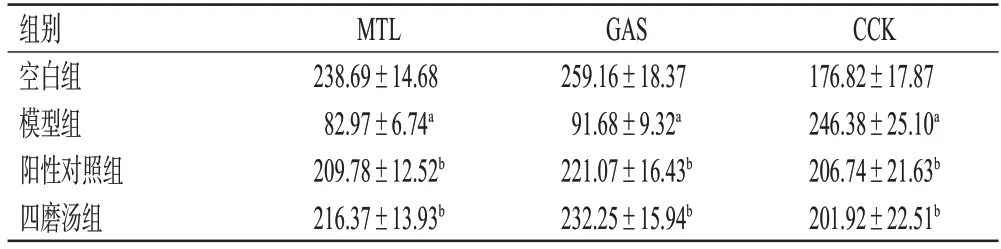
表1 各组大鼠血清中MTL、GAS、CCK含量测定结果(±s,n=20,pg/mL)
a:与空白组比较,P<0.05;b:与模型组比较,P<0.05。
组别空白组模型组阳性对照组四磨汤组CCK 176.82±17.87 246.38±25.10a 206.74±21.63b 201.92±22.51b MTL 238.69±14.68 82.97±6.74a 209.78±12.52b 216.37±13.93b GAS 259.16±18.37 91.68±9.32a 221.07±16.43b 232.25±15.94b
3.2 四磨汤口服液对大鼠胃排空率和小肠推进率的影响
与空白组比较,模型组大鼠的胃排空率和小肠推进率均显著降低(P<0.05);与模型组比较,阳性对照组和四磨汤组大鼠的胃排空率和小肠推进率均显著升高(P<0.05);四磨汤组与阳性对照组比较,上述指标差异均无统计学意义(P>0.05)。结果见表2。
表2 各组大鼠胃排空率和小肠推进率测定结果(±s,n=5,%)

表2 各组大鼠胃排空率和小肠推进率测定结果(±s,n=5,%)
a:与空白组比较,P<0.05;b:与模型组比较,P<0.05。
组别空白组模型组阳性对照组四磨汤组胃排空率58.97±3.61 34.16±2.54a 47.62±3.15b 50.31±3.47b小肠推进率84.56±6.27 51.63±3.71a 69.12±5.69b 72.84±5.73b
3.3 四磨汤口服液对大鼠胃窦组织中ICC线粒体结构的影响
空白组大鼠ICC形态和结构清晰,核膜完整,线粒体嵴密度高。与空白组比较,模型组大鼠ICC线粒体数量减少,线粒体空泡化,线粒体嵴模糊,并在其周围观察到大量自噬溶酶体。与模型组比较,阳性对照组和四磨汤组大鼠ICC线粒体结构逐渐恢复,线粒体嵴清晰,自噬溶酶体减少。结果见图1。
3.4 四磨汤口服液对大鼠胃窦组织中COX Ⅳ、Parkin共定位表达的影响
与空白组[(354.52±31.68) μm2]比较,模型组大鼠胃窦组织中COX Ⅳ、Parkin在线粒体中的共定位表达面积[(1 258.97±72.94) μm2]显著增大(P<0.05);与模型组比较,阳性对照组和四磨汤组大鼠胃窦组织中COX Ⅳ、Parkin在线粒体中的共定位表达面积[分别为(483.54±38.64)、(465.76±35.47) μm2]均显著减小(P<0.05)。四磨汤组与阳性对照组比较,上述指标差异均无统计学意义(P>0.05)。结果见图2。
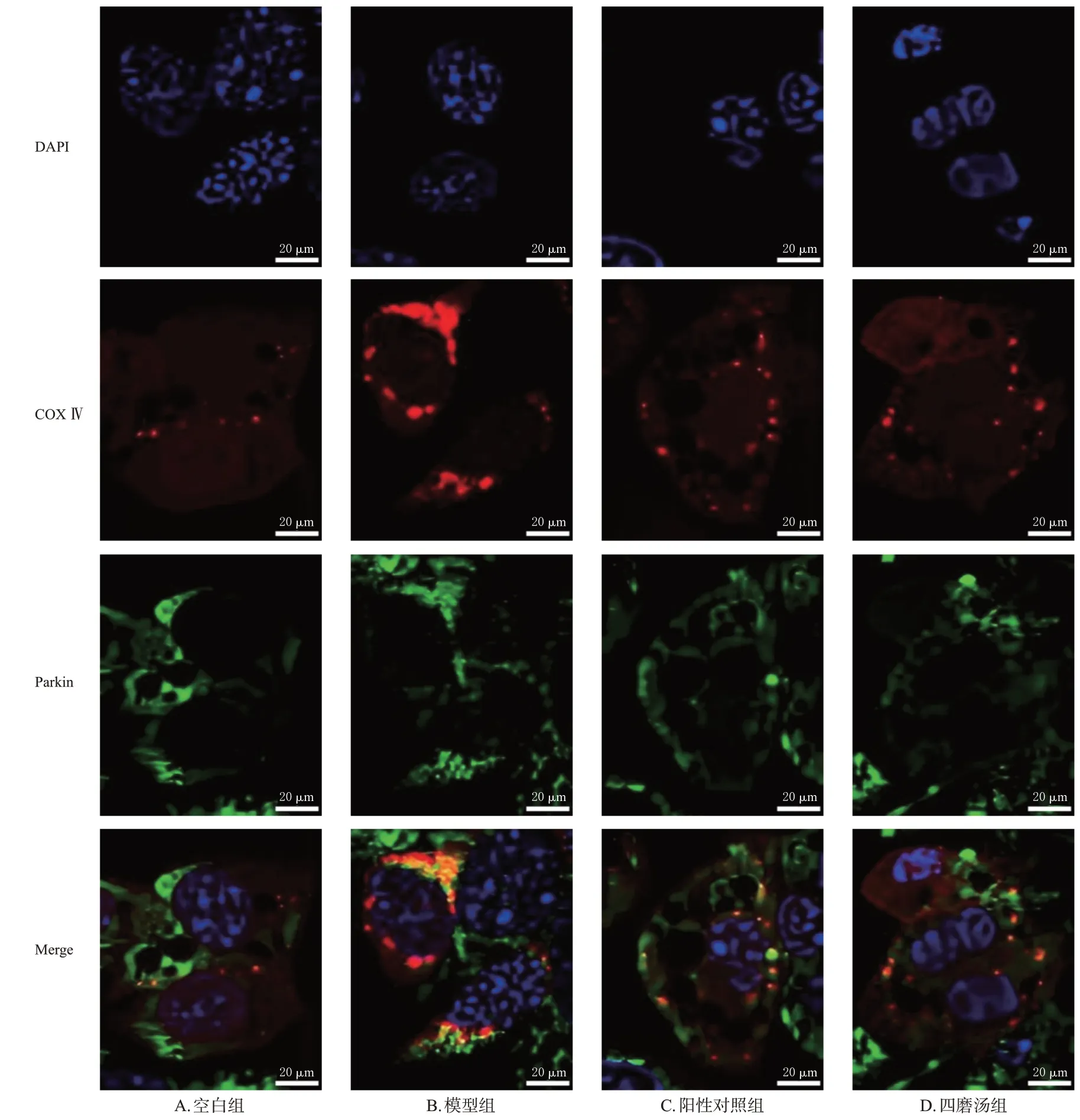
图2 各组大鼠胃窦组织中COX Ⅳ、Parkin共定位表达的观察结果
3.5 四磨汤口服液对大鼠胃窦组织中LC3、p62、Pink1、Parkin蛋白表达的影响
与空白组比较,模型组大鼠胃窦组织中LC3、Pink1、Parkin蛋白表达水平均显著升高(P<0.05),p62蛋白表达水平显著降低(P<0.05);与模型组比较,阳性对照组和四磨汤组大鼠胃窦组织中LC3、Pink1、Parkin蛋白表达水平均显著降低(P<0.05),p62蛋白表达水平均显著升高(P<0.05);四磨汤组与阳性对照组比较,上述指标差异均无统计学意义(P>0.05)。结果见图3、表3。

图3 各组大鼠胃窦组织中LC3、p62、Pink1、Parkin蛋白表达的电泳图
表3 各组大鼠胃窦组织中LC3、p62、Pink1、Parkin蛋白表达水平测定结果(±s,n=5)
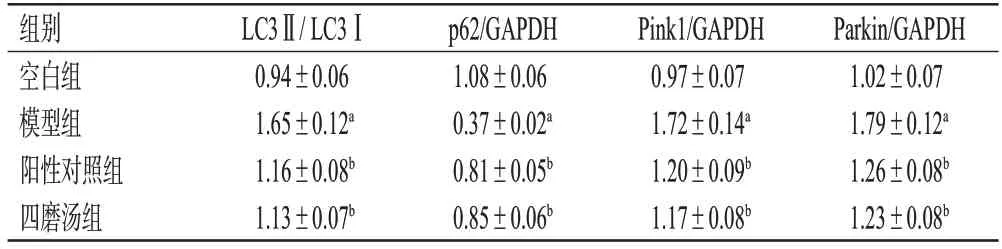
表3 各组大鼠胃窦组织中LC3、p62、Pink1、Parkin蛋白表达水平测定结果(±s,n=5)
a:与空白组比较,P<0.05;b:与模型组比较,P<0.05。
组别空白组模型组阳性对照组四磨汤组LC3Ⅱ/ LC3Ⅰ0.94±0.06 1.65±0.12a 1.16±0.08b 1.13±0.07b p62/GAPDH 1.08±0.06 0.37±0.02a 0.81±0.05b 0.85±0.06b Pink1/GAPDH 0.97±0.07 1.72±0.14a 1.20±0.09b 1.17±0.08b Parkin/GAPDH 1.02±0.07 1.79±0.12a 1.26±0.08b 1.23±0.08b
4 讨论
FD是一种胃肠道运动障碍综合征,其临床症状包括慢性上腹部疼痛和不适。FD的发病机制较为复杂,包括胃和十二指肠的功能性运动障碍、心理压力以及不良饮食习惯等[12]。如果没有及时治疗,FD可能发展为消化性溃疡或胃癌。目前,针对FD症状的治疗方法主要包括饮食调节、药物治疗和心理治疗[13]。长期以来,传统中医理论被广泛用于功能性胃肠疾病的初始治疗[14]。在中医上,根据FD症状特点,可将其归属于“痞满、胃胀”范畴,多从健脾益气、疏肝消痞角度用药,疗效优势明显[15]。本研究通过不可预知的慢性应激法建立FD大鼠模型来探讨四磨汤对FD的作用。结果显示,模型组大鼠的胃排空率和小肠推进率较空白组降低,表明模型大鼠制备成功。四磨汤口服液给药后,大鼠的胃排空率和小肠推进率较模型组升高。这表明四磨汤口服液可改善FD模型大鼠的胃肠动力。
MTL、GAS是广泛分布在胃肠道的胃肠激素。MTL是一种能刺激胃肠平滑肌的活性肽,能促进胃蛋白酶的分泌,提高胃排空率,缩短食物在小肠中的时间;GAS由十二指肠黏膜和胃窦的G细胞分泌,可以调节胃肠蠕动,促进胃排空,并刺激胃酸分泌[16]。CCK是一种脑肠肽,在摄入含有高脂肪或蛋白质的食物时,由小肠上部的I细胞释放。而有研究报道,CCK拮抗剂加速了胃排空率,这可能有益于FD患者的恢复[17]。本研究结果显示,模型组大鼠血清中MTL、GAS含量低于空白组,CCK含量高于空白组;而阳性对照组和四磨汤组大鼠血清中MTL、GAS含量较模型组升高,CCK含量较模型组降低。这表明四磨汤口服液可促进FD模型大鼠血清中胃肠激素MTL、GAS的分泌,抑制脑肠肽CCK的释放,进而加速胃排空,促进胃肠运动。
相关研究发现,ICC中自噬的过度激活以及线粒体形态和结构的异常可导致胃肠节律紊乱[18]。Pink1和Parkin是参与调节自噬的2个关键分子。线粒体的去极化阻断了Pink1的转移,导致Pink1在线粒体膜上积累,然后促进Parkin磷酸化并使其从细胞质基质募集到线粒体外膜上,从而触发线粒体自噬[19]。线粒体呼吸链上的COX主要包含4个酶复合体(Ⅰ、Ⅱ、Ⅲ、Ⅳ),其中COX Ⅳ是COX中的关键亚型,对线粒体呼吸链的装配与功能至关重要,其表达正常与否可以影响整条呼吸链的功能状态以及细胞的能量生成[20]。本研究通过检测COX Ⅳ、Parkin在线粒体中共定位表达发现,模型组大鼠胃窦组织中COX Ⅳ、Parkin在线粒体中的共定位表达升高,表明模型组大鼠Pink1/Parkin轴被激活。p62的功能是连接受损的线粒体和线粒体溶酶体,其中线粒体溶酶体是由线粒体吞噬体和溶酶体融合形成,可介导受损线粒体的降解[21]。LC3蛋白在自噬体的形成中也起着关键作用,其包含Ⅰ型和Ⅱ型,LC3Ⅰ蛋白的含量与自噬活动密切相关[22]。本研究结果发现,模型组大鼠胃窦组织中Pink1、Parkin及LC3蛋白的表达均升高,p62的表达降低;而阳性对照组和四磨汤组大鼠胃窦组织中Pink1、Parkin、LC3蛋白的表达均降低,p62蛋白表达均升高。这表明四磨汤口服液可抑制Pink1/Parkin轴,阻断自噬,进而改善大鼠FD。
综上所述,四磨汤口服液可改善FD模型大鼠的胃肠动力和胃肠激素水平,其作用机制可能与抑制Pink1/Parkin轴、阻断自噬有关。
