基于网络药理学和分子对接探讨浙贝母-夏枯草药对治疗甲状腺结节的作用机制*
2023-11-14王国庆刘伟黄菲
王国庆,刘伟,黄菲
1.南京中医药大学,江苏 南京 210023; 2.南京中医药大学附属苏州市中医医院,江苏 苏州 215000
甲状腺结节是甲状腺内单个或多个组织的离散病变,随着放射学技术的不断进步,结节的诊断在临床实践中越来越普遍[1]。目前,西医治疗甲状腺结节通常为随访观察、左甲状腺素抑制治疗或热消融及手术治疗,有一定疗效,但患者依从性较低,适用范围局限,不良反应较大[2]。基于关联规则和因子分析,一项治疗甲状腺结节中药组方规律的研究显示,浙贝母、夏枯草两味药为治疗瘿病的最常用药对[3]。浙贝母-夏枯草是消肿散结的经典组合,也是中医治疗甲状腺结节临床用药的常用配伍。浙贝母味苦,性寒;夏枯草味辛、苦,性寒。现代药理研究显示,浙贝母、夏枯草在抗炎、调节免疫、抑制肿瘤细胞增殖与转移、诱导肿瘤细胞凋亡方面作用显著,临床应用甚广[4-5]。
网络药理学集多种学科于一身,分析“疾病-靶点-药物”之间的关联,明确中药生物活性成分及作用机制,为疾病的现代中医诊疗提供新思路[6]。本实验利用网络药理学研究浙贝母-夏枯草治疗甲状腺结节的作用机制,为其临床应用提供证据和支持。
1 资料与方法
1.1 浙贝母、夏枯草相关靶点筛选以浙贝母、夏枯草为关键词,在中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP,https://tcmspw.com/tcmsp.php)[7]检索其所有化学成分。然后以口服生物利用度(oral bioavailability,OB) ≥30%、类药性(drug-likeness,DL)≥0.18进行筛选,将筛选后的活性成分保存为mol2类型文件,导入PharmMapper数据库平台(http://www.lilab-ecust.cn/pharmmapper),获得筛选后化学成分的靶点蛋白,再使用Uniprot数据库(https://www.uniprot.org)[8]将活性成分蛋白质靶点名称标准化。
1.2 “药物-活性成分-靶点”网络构建将“浙贝母-夏枯草”药对的有效活性成分及相关靶点上传至Cytoscape 3.7.1(http://www.Cyto-scape.org/)构建“药物-活性成分-靶点”网络。
1.3 甲状腺结节靶点获取基于Genecards数据库(https://www.genecards.org/)[9]、在线人类孟德尔遗传数据库(online mendelian inheritance in man,OMIM,https://omim.org)、治疗靶点数据库(therapeutic target database,TTD,http://bidd.nus.edu.sg/group/cjttd)[10]等,搜索关键词“thyroid nodules”,获得甲状腺结节相关靶点。在Genecards数据库中,Score值的高低预示靶点与疾病的密切程度,根据经验,运用二倍中位数法筛选出疾病的潜在靶点[11]。合并上述数据库筛选得到的靶点后校正去重。
1.4 药物-疾病共有靶点筛选、蛋白互作网络(protein-protein interaction networks,PPI)构建将药物有效成分相关靶点与疾病靶点导入韦恩图网站进行在线分析,获得交集靶点并利用STRING数据库(https://string-db.org)[12]构建PPI模型,将其以TSV文件导出,再导入Cytoscape 3.7.1软件中构建PPI网络,利用CytoHubba插件筛选Degree值较高的靶点,从而预测浙贝母-夏枯草药对治疗甲状腺结节的重要潜在靶点。
1.5 “药物-活性成分-交集靶点-疾病”网络的构建将药物及其活性成分、交集靶点及疾病导入 Cytoscape 3.7.1软件绘制成“药物-活性成分-交集靶点-疾病”网络图,进一步探究浙贝母-夏枯草治疗甲状腺结节的作用机制。
1.6 富集分析利用Metascape数据库[13]对交集靶点进行基因本体(gene ontology,GO)功能富集分析和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)信号通路富集分析,对关键靶点基因进行功能注释并预测基因富集途径,然后通过微生信平台(http://www.bioinformatics.com.cn/)分析结果并绘制气泡图。
1.7 分子对接在RCSB PDB数据库下载核心靶点蛋白结构,采用AutoDock软件进行分子对接验证,去水、加氢、计算电荷。使用Lamarckian 遗传算法进行分子对接计算,获取关键靶点与活性成分的结合能并评估最终对接结构。通过 Pymol 2.4软件制作两者结合模式图对对接结果可视化。
2 结果
2.1 浙贝母、夏枯草活性成分靶点筛选通过TCMSP平台检索,并以OB ≥30%、DL≥0.18为条件筛选后获得浙贝母活性成分7个、夏枯草活性成分11个,其中 β-谷甾醇是两者共有活性成分。将无对应靶点信息的活性成分Ziebeimine和Chaksine剔除,最终得到符合标准的活性成分15个。经数据匹配得到其对应作用靶点402个,合并后去重共得到171个作用靶点,见表1。

表1 浙贝母-夏枯草活性成分信息表
2.2 “药物-活性成分-靶点”网络利用Cytoscape软件将筛选出的15个活性成分与171个相关靶点构建“药物-活性成分-靶点”网络图,该网络包括187个节点及419条边,其中“V形”代表药物,ZBM为浙贝母,XKC为夏枯草,菱形代表活性成分,圆形代表作用靶点,见图1。

图1 “药物-活性成分-靶点”网络
2.3 浙贝母-夏枯草治疗甲状腺结节的靶点预测从Genecards数据库获得甲状腺结节靶点2954个。检索Genecards数据库得到疾病相关靶点Score最大值为118.72,最小值为0.18,中位数为2.16,故设定 Score>2.16的靶点为疾病潜在靶点。综合各数据库靶点信息,去重后最终得到 1 563个疾病相关靶点。经韦恩图网站在线分析后得到可能与浙贝母-夏枯草治疗甲状腺结节相关的靶点108个,见图2。

图2 浙贝母-夏枯草活性成分相关靶点与疾病靶点韦恩图
2.4 PPI网络把交集靶点导入STRING数据库后得到PPI网络模型,导入Cytoscape 3.7.1软件构建PPI网络,该网络有108个节点,411条边,平均节点度值为7.61,见图3。使用CytoHubba插件,提取Degree值前10位的核心靶点,分别为AKT1、肿瘤蛋白P53(tumor protein P53,TP53)、丝裂原活化蛋白激酶1(mitogen-activated protein kinase 1,MAPK1)、重组V-Rel网状内皮增生病毒癌基因同源物A(recombinant V-rel reticuloendothelial proliferation virus oncogene homolog A,RELA)、肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素-6(interleukin-6,IL-6)、雌激素受体 1(estrogen receptor 1,ESR1)、MAPK8、类视黄醇X受体alpha(retinol like X receptor alpha,RXRA)、表皮生长因子受体(epidermal growth factor receptor,EGFR),见图4。

图3 PPI网络图
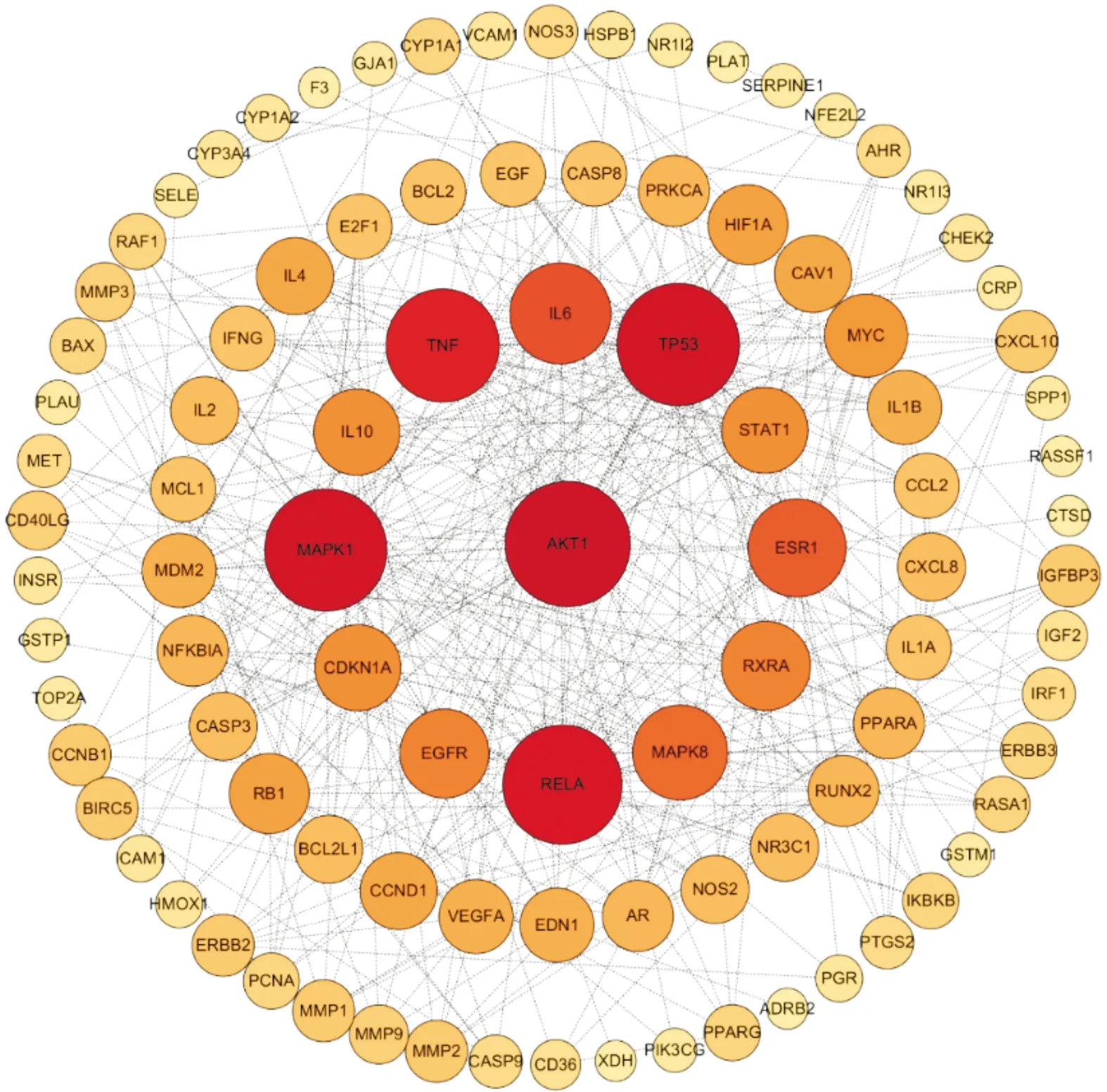
注:颜色越红代表Degree值越大。图4 核心靶点PPI分析图
2.5 “药物-活性成分-交集靶点-疾病”网络把浙贝母与夏枯草的活性成分及2.3项中得到的交集靶点导入Cytoscape 3.7.1软件绘制“药物-活性成分-交集靶点-疾病”网络图,见图5。

图5 “药物-活性成分-交集靶点-疾病”网络图
2.6 GO和KEGG分析结果使用Metascape平台对108个交集靶点进行GO富集分析和KEGG通路富集分析,以P<0.01为筛选条件,GO富集分析显示靶点富集在1 956个条目上,其中生物过程(biological process,BP)1 705条,主要包括对激素的应答(response to hormone)、细胞对有机环状化合物的应答(cellular response to organic cyclic compound)、细胞对脂质的应答(cellular reponse to lipid)等;分子功能(molecular function,MF)136条,主要涉及蛋白质同源二聚体活性(protein homodimerization activity)、转录因子结合(transcription factor binding)、DNA结合转录因子结合(DNA-transcription factor binding)、激酶结合(kinase binding)等;细胞组分(cellular component,CC)115条,主要涉及膜筏(membrane raft)、转录调节复合物(transcription regulator complex)、突触后膜(postsynaptic membrane)、突触膜(synaptic membrane)等。KEGG通路富集分析共获得202个信号通路,主要涉及TNF信号通路、糖尿病并发症中晚期糖基化终末产物-糖基化终末产物受体(advanced glycation end products-glycation end product receptors,AGE-RAGE)信号通路、磷脂酰肌醇-3-激酶-AKT(phosphatidylinositol-3-kinase-AKT,PI3K-AKT)信号通路等,将前20条通路结果绘制成气泡图,见图6。

注:A:GO-BP分析;B:GO-MF分析;C:GO-CC分析;D:KEGG分析。图6 GO富集分析和KEGG通路分析
2.7 分子对接选择Degree值排名前3位的靶蛋白(AKT1、TP53、MAPK1)与“药物-成分-交集靶点-疾病”网络对应的度值前3位的有效成分(槲皮素、β-谷甾醇、山柰酚)进行分子对接,最终得到9组对接结果,见表3。作为评价受体与配体结合能力的标准之一,结合自由能<-5.0 kJ·mol-1时,表示两者对接良好,且结合自由能越低表明两者结合能力越强。结果表明,槲皮素与AKT1有较强结合能力;β-谷甾醇与MAPK1有较强结合能力;山柰酚与AKT1有较强结合能力。可视化结果见图7。

图7 分子对接可视化结果图
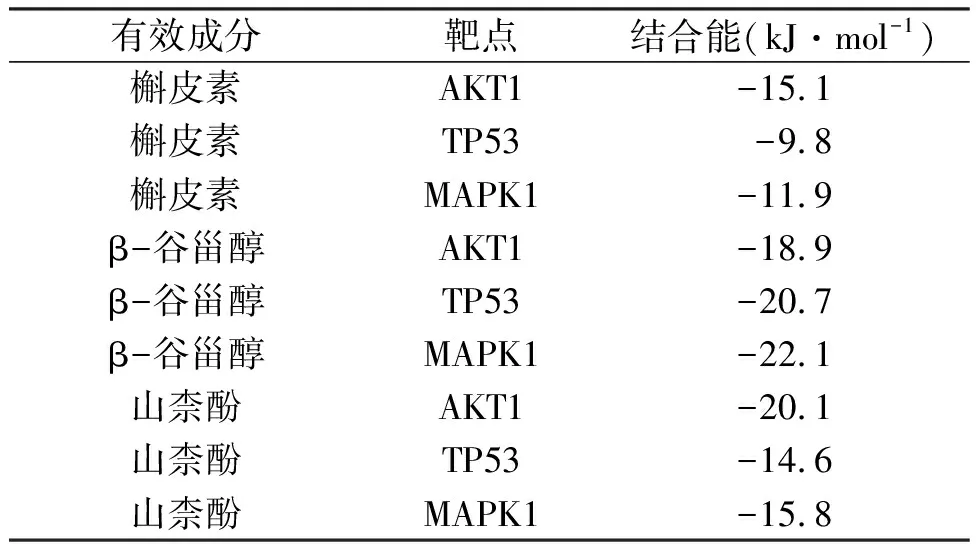
表3 活性成分与核心靶点分子对接结合自由能
3 讨论
甲状腺结节属中医“瘿病”“瘿瘤”等范畴,由气血痰瘀凝结于颈前而成。初起多由正气虚弱,邪气外侵,内外相合;继而邪气壅于三焦,气化不利而生郁热、痰湿、瘀血,日久结聚于颈部经络,迁延难愈。在病机演变过程中,气血郁结于三焦为核心病机,故软坚散结为治疗之要。除活血、化痰、清热之外,需酌加散结之品,以增强散瘿之功[14]。现代医学认为,甲状腺结节是由各种原因引起的局部甲状腺组织异常增长的散在病变[15],由于临床表现常不明显,多被患者忽略,其中大多为囊性或囊实性良性结节,需穿刺明确病理的恶性结节检出率相对较低,约为7%~15%。当前甲状腺结节发病机制多考虑与遗传、电离辐射、心理社会因素、摄碘量、环境污染等因素有关[16]。研究发现,中医药在治疗甲状腺结节方面疗效明确,不但可以显著缓解颈部不适症状,而且在缩小结节大小方面有其独特优势[17]。
本研究从“浙贝母-夏枯草”中挖掘出活性成分15个,活性成分作用靶点171个。通过分析“药物-活性成分-靶点”网络,推测“浙贝母-夏枯草”药对治疗甲状腺结节的主要活性成分可能是以下3个,分别是槲皮素、β-谷甾醇和山柰酚,其中β-谷甾醇是浙贝母和夏枯草的共有活性成分。研究表明,槲皮素是夏枯草的主要有效成分,具有抑制甲状腺特异性基因促甲状腺激素受体(thyrotropin receptor,TSHR)、甲状腺过氧化物酶(thyroid peroxidase,TPO)等表达的抗甲状腺作用,还具有和其他类黄酮相同的治疗特性,如诱导肿瘤细胞凋亡以及抗病毒、抗氧化、抗炎和抗增殖活性等[18-19]。β-谷甾醇对肿瘤细胞具有抑制作用。林明珠等[20]建立了H22荷瘤小鼠模型发现,β-谷甾醇可能通过调控IL-6、干扰素-γ(interferon-γ,IFN-γ)、血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达抑制肿瘤生长。山柰酚是一种膳食类黄酮,对原发性肿瘤生长的抑制作用已被广泛研究,通过抑制活性氧-蛋白精氨酸脱亚胺酶4(reactive oxygen species-protein arginine deiminase 4,ROS-PAD4)通路阻断中性粒细胞胞外陷阱形成并减少肿瘤转移,对于甲状腺恶性结节有较好的抑制作用[21]。由此推测,上述3个药物成分可能是浙贝母-夏枯草治疗甲状腺结节的重要活性成分,其通过抗增殖活性和激活细胞凋亡、抑制细胞存活发挥治疗作用。
PPI网络中筛选出AKT1和TP53为核心靶点。AKT代表一个由三种蛋白质组成的家族,即AKT1、AKT2和AKT3,通过磷脂酰肌醇3-激酶途径被多种生长因子激活,并通过抑制凋亡和介导细胞增殖在肿瘤发生中发挥作用[22]。在正常甲状腺中,三种AKT亚型均表达,但在mRNA和蛋白质水平上,AKT1是主要表达亚型。与正常组织相比,AKT1也是甲状腺癌中AKT主要过度表达和过度激活的一种亚型。有学者认为,这种亚型的激活与滤泡癌和乳头状癌的肿瘤侵袭和转移有关。研究发现,AKT1缺失可延缓PVPV小鼠甲状腺癌的形成,并在体内15个月内减少血管侵袭[23]。TP53作为人类基因组的重要保障,可以抵抗基因毒性应激,在甲状腺癌的发展中发挥重要作用。该基因生物学作用是调控细胞周期,允许修复DNA损伤或发生凋亡。当DNA损伤时,p53蛋白使细胞周期受到抑制,允许DNA修复;当DNA修复失败时,p53则通过激活转录靶点的表达引发细胞凋亡,阻止肿瘤进一步发生发展[24]。
KEGG通路富集分析推测“浙贝母-夏枯草”药对主要通过调控信号通路的激活或抑制来发挥维持细胞稳态、抗炎、免疫调节等多重作用,如TNF信号通路、糖尿病并发症中的AGE-RAGE信号通路、PI3K-AKT信号通路等途径。TNF信号通路:TNF-α 是在慢性炎症和免疫反应过程中释放的一种细胞因子,在促进细胞生长、分化、凋亡和肿瘤进展中发挥重要作用。肿瘤细胞在上皮间质转化过程中获得纤维特征,增强穿过血管基底膜或淋巴管的活性,提升肿瘤细胞的侵袭转移能力,而TNF-α是促进上皮间质转化的炎症介质之一[25]。研究表明,低浓度的 TNF-α 可以在不同的甲状腺乳头状癌细胞中通过Twist1表达诱导上皮间质转化,激活间充质特异性基因,促进甲状腺癌的侵袭转移[26]。糖尿病并发症中的AGE-RAGE信号通路:AGEs与RAGE相互作用可引起持续而强烈的细胞反应,诱导细胞级联炎症反应,导致各种病理状况发生[27]。炎症相关过程可促进蛋白质、DNA和脂质糖基化,从而导致结构变化,改变这些化合物的生物学功能并促进与甲状腺癌发病率相关的基因突变。值得注意的是,RAGE及其配体和参与糖基化的化合物可以作为甲状腺癌治疗的潜在目标靶点进行研究,因为其中一些已被证明会影响甲状腺癌的侵袭性。miR-221和miR-222在甲状腺乳头状癌中过度表达,而抗RAGE抗体在下调miR-221和miR-222表达方面可能有效,在抑制甲状腺乳头状癌方面有一定的作用[28]。PI3K-AKT信号通路:研究报道显示,PI3K-AKT通路参与甲状腺肿瘤发生和进展,在细胞增殖和血管生成中起着关键作用,其主要通过激活哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR) 响应各种下游信号,调节细胞过程[29]。该mTOR通路可通过激活P70S6激酶和抑制4EBP1来调节生物进程发生,进而导致蛋白质合成和核糖体结合发生的增加。一项小鼠模型研究证明,尽管甲状腺癌的发生不受PI3K-AKT-mTOR通路抑制的影响,但癌症的生长速度降低,从而延长了小鼠的寿命。研究发现,甲状腺乳头状癌样本中mTOR表达升高,这表明靶向mTOR活性似乎是治疗甲状腺乳头状癌有效的治疗策略,提示该信号通路在甲状腺肿瘤发生中的作用是值得肯定的[30]。最后,对AKT1、TP53、MAPK1 3个关键靶点与槲皮素、β-谷甾醇和山柰酚3个有效活性成分进行分子对接验证,结果显示均对接良好,有较强结合能,进一步证实了浙贝母-夏枯草治疗甲状腺结节的可能性。
本文基于网络药理学初步探索了浙贝母-夏枯草对甲状腺结节发挥治疗作用的有效化合物、靶点及通路,发现浙贝母-夏枯草的活性成分可能通过调节AKT1、TP53、MAPK1等蛋白,作用于TNF、PI3K-AKT、糖尿病并发症中的AGE-RAGE等信号通路,抑制甲状腺肿瘤细胞增殖及维持细胞稳态。但未考虑中药在煎煮时发生的复杂化学反应以及相应活性成分在体内的代谢吸收,需进一步采用动物或细胞实验进行验证,以提供更有力的科学依据。
