墨兰CsAP1-A 基因克隆及表达分析
2023-11-13刘嘉超杨凤玺
周 荣,刘嘉超,,杨凤玺
(1.佛山科学技术学院,广东 佛山 528000;2.广东省农业科学院环境园艺研究所/广东省园林花卉种质创新综合利用重点实验室,广东 广州 510640)
【研究意义】墨兰(Cymbidiumsinense)是我国国兰的典型代表之一,在福建、广东、台湾广泛分布。墨兰叶型独特,花姿优美,花香馥郁,花期长(9 月至翌年3 月),具有很高的观赏价值和经济价值[1-3],产品远销韩国、日本等地。开花性状是墨兰最重要的育种目标,而APETALA1(AP1)基因在植物成花转变和花器官发育过程中具有非常关键的作用[4]。开展墨兰AP1基因的克隆和表达分析研究,对探究墨兰开花过程中的分子调控机制具有重要意义。【前人研究进展】MADS-box 基因家族是一类在植物中广泛存在的转录因子家族,可与其他转录因子和调控因子相互作用,共同在植物花器官分化、果实发育和开花调控等方面起作用。MADSbox 基因家族通常分为两个亚家族(Type Ⅰ和Type Ⅱ),其中Type Ⅱ亚家族基因编码的蛋白质均有1 个特征性结构域K,能够折叠形成3 个α螺旋结构,介导MADS-box 蛋白之间形成二聚体,通过蛋白复合体共同调控下游靶基因。以Type Ⅱ类MADS-box 基因为核心构成的花发育ABCDE模型决定植物花器官的发育[5-6]。A 类基因主要影响花朵的外轮花器官发育,同时与E 类基因共同参与萼片的发育,并与B 类基因和E 类基因共同调控花瓣的形成和特化。AP1属于A 类基因,其突变或过表达都会对植物的开花时间和花器官产生显著影响[7-8]。在拟南芥中,过表达AP1可使拟南芥提前1 周左右开花[9]。AP1同时可以抑制最外轮花器官萼片叶腋处形成更多花原基。另外,AP1可以分别通过抑制细胞分裂素合成基因和激活细胞分裂素降解酶,减少AP1基因表达区域的细胞分裂素含量,从而维持正常花分生组织的有限生长。目前,建兰(C.ensifolium)[10]、石 斛(DendrobiumChao Praya Smile)[11]、萼脊兰(Sedireajaponica)[8]、牡丹(Paeonia suffruticosa)[12]、荔枝(Litchichinensis)[13]、大豆(Glycinemax)[14]等多种植物的AP1基因已被成功克隆,研究发现,它们在花器官的形成和花期调控中起着非常重要的作用。【本研究切入点】目前关于墨兰AP1基因的研究报道甚少,该基因在墨兰上的功能表现也尚未清楚。因此,本研究以墨兰为研究对象,克隆并鉴定到1 个墨兰AP1基因(命名为CsAP1-A),并进行基因表达模式分析[15]。【拟解决的关键问题】本研究克隆墨兰CsAP1-A基因,通过生物信息学分析其基因结构、蛋白结构域和进化关系,利用RTqPCR 方法分别检测CsAP1-A在墨兰不同器官、不同花发育阶段和不同花组织部位的表达情况,通过转录组测序分析CsAP1-A在5 个不同花型墨兰品种花组织部位的表达情况,并采用蛋白互作预测软件分析CsAP1-A 与其他蛋白的互作关系,为进一步研究CsAP1-A 在墨兰花发育过程的功能奠定基础。
1 材料与方法
1.1 试验材料
基因克隆、表达分析供试的墨兰品种为‘小香’,栽培于广东省农业科学院环境园艺研究所国家墨兰种质资源圃内。挑选3 株长势良好的墨兰,采集其花芽、成熟花器官及根、茎、叶和果各3 g 左右,用液氮速冻,-80 ℃保存备用。
不同花型转录组测序分析供试的5 个墨兰品种为‘瑞金’(WT 普通花型)、‘安康梅’(花瓣蕊柱化的梅瓣花型,Gynostegium-like petal variety,GPV)、‘大圣’(重瓣花型,Multi perianth variety,MPV)、‘金凤蝶’(花瓣唇瓣化花型,Labellum -like petal variety,LaPV)和‘六瓣花’(唇瓣萼片化花型,Null-labellum variety,NLV),均来源于广东省农业科学院环境园艺研究所国家墨兰种质资源圃。采集的花朵立即用液氮速冻处理。
DH5α 化学感受态细胞、荧光定量试剂盒(Taq Pro Universal SYBR qPCR Master Mix)、高保真酶试剂盒(2×Phanta Flash Master Mix)、产物纯化试剂盒(FastPure Gel DNA Extraction Mini Kit)、克隆载体试剂盒(5 min TA/Blunt Cloning Kit)和RNA 提取试剂盒(FastPure Universal Plant Total RNA Isolation Kit),均购自南京诺唯赞生物科技股份有限公司。
1.2 总RNA 提取及反转录
用多糖多酚植物RNA 提取试剂盒提取墨兰花芽的RNA,操作过程严格按照试剂盒说明书进行。使用蛋白核酸分析仪检测RNA 浓度,使用1%琼脂糖凝胶电泳检测RNA 质量,将检测合格的RNA 进行反转录反应得到cDNA。
1.3 目的基因克隆
以前期基因组测序得到的CsAP1-ACDS 为参考序列,使用NCBI 设计基因克隆的PCR 引物:CsAP1-A-F 5'ATGGGAAGAGGGAGGGTT3'、CsAP1-A-R 5'TTATCCATTCATATGAGTGAGC3'。以墨兰花芽cDNA 为模板,按照高保真酶试剂盒说明书操作进行CsAP1-A基因克隆,PCR 体系为50 μL,反应程序:98 ℃预变性30 s;98 ℃预变性10 s、58 ℃退火5 s、72 ℃延伸5 s,34 个循环;72 ℃延伸1 min。扩增产物回收纯化后与TA 克隆载体连接,转化到DH5α 化学感受态细胞中培养,次日挑选阳性菌液送至生工生物工程(上海)股份有限公司测序,得到CsAP1-A基因完整序列。
1.4 CsAP1-A 生物信息学分析
使用Expasy-ProtParam(https://www.expasy.org/)分析CsAP1-A 蛋白的分子量大小、亲水性等理化性质;使用NCBI(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析CsAP1-A 的保守结构域;使用DNAMAN 软件将CsAP1-A 与6 个同源蛋白进行多序列比对;使用Mega6.0 软件的邻接法构建CsAP1-A 系统进化树。
1.5 CsAP1-A 基因表达分析
使用RT-qPCR 方法对CsAP1-A在墨兰不同器官(根、茎、叶、花、果)、不同花发育阶段(花芽分化初期S1、花芽分化发育期S2、花梗伸长期S3、排铃期S4 和开花期S5)和不同花组织部位(萼片、花瓣、唇瓣、合蕊柱)的表达进行分析。以CsActin作为内参基因(表1),PCR 反应程序为:95 ℃ 2 min;95 ℃ 15 s、60 ℃ 30 s、72 ℃ 30 s,40 个循环。基因表达试验重复3 次,使用2-ΔΔCt公式计算CsAP1-A相对表达量[16]。
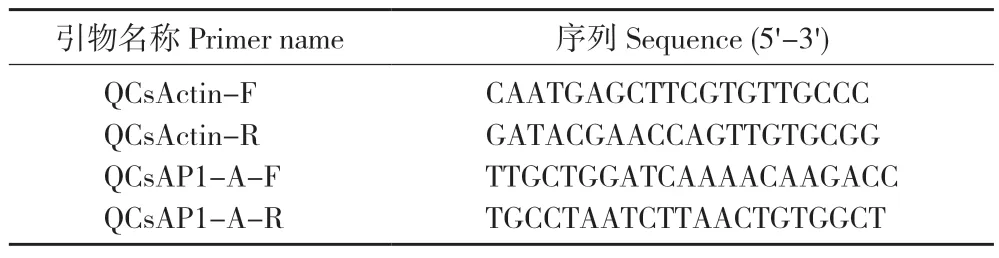
表1 CsAP1-A 基因荧光定量PCR 引物Table 1 Primers for fluorescence quantitative PCR of CsAP1-A gene
1.6 不同花型转录组测序分析
采集5 个不同花型(WT、GPV、MPV、LaPV、NLV)墨兰品种(‘瑞金’‘安康梅’‘大圣’‘金凤蝶’‘六瓣花’)的花朵,立即液氮速冻处理,送至生工生物工程(上海)股份有限公司进行转录组测序。对CsAP1-A的FPKM 值进行log2转换,并利用R 语言中的Pheatmap 工具包生成热图。
1.7 CsAP1-A 蛋白互作关系
通过STRING 数据库(https://cn.string-db.org/)预测可能与CsAP1-A 发生互作的蛋白质,并以水稻作为参考,构建CsAP1-A 与其他蛋白的互作关系图。
2 结果与分析
2.1 CsAP1-A 基因全长克隆
以墨兰花芽为材料提取RNA,并将RNA 反转录为cDNA。以cDNA 为模板,以墨兰基因组参考序列设计引物,扩增得到约750 bp 的单一片段(图1)。将回收的DNA 片段与TA 克隆载体进行连接并转化感受态细胞,最后通过测序得到CsAP1-A基因序列,全长744 bp,编码248 个氨基酸(图2)。

图1 CsAP1-A 基因克隆PCR 产物Fig.1 PCR product of CsAP1-A gene cloning

图2 CsAP1-A 基因的核苷酸序列和推导的氨基酸序列Fig.2 Nucleotide acid sequence of CsAP1-A gene and deduced amino sequence
2.2 CsAP1-A 生物信息学分析
2.2.1 CsAP1-A 蛋白理化性质分析根据Expasy-ProtParam 预测分析结果,CsAP1-A 蛋白的分子式为C1242H2038N370O376S9,蛋白分子量为28.4 kD,总原子数为4 035,脂肪系数为83.40,平均亲水性为-0.762,说明CsAP1-A 是一个亲水蛋白。选择模型一致性高达98.38%的同源蛋白AOA1P8SCC5.1A 作为模板,通过SWISS-MODEL在线软件构建CsAP1-A 蛋白的三级结构,发现该结构包含4 个保守的α-螺旋和2 个β 折叠结构(图3)。

图3 CsAP1-A 蛋白三级结构预测Fig.3 Tertiary structure prediction of CsAP1-A protein
2.2.2 CsAP1-A 蛋白保守域分析与同源序列比对 通过NCBI 数据库分析蛋白序列可知,CsAP1-A 拥有保守的MADS-box 结构域和K-box结构域(图4),属于MADS-box转录因子家族成员。此外,通过NCBI 数据库得到多个与CsAP1-A 同源性很高的蛋白序列,其中,CsAP1-A 与春兰(C.goeringii)AP1/FUL(APY18447.1)和蕙兰(C.faberi)MADS1(AGE15496.1)的同源性均高达98.38%,与金钗石斛(D.nobile)MADSbox protein 1(ABQ08573.1)、蝴蝶兰(Phalaenopsis amabilis)AP1-related protein(AAZ76263.1)、华山姜(Alpiniaoblongifolia)APETALA1-like protein(ABS83558.1)、银合欢(Nelumbonucifera)APETALA1(AGY54940.1)的同源性分别为85.83%、82.19%、66.27%和60.32%(图5)。

图4 CsAP1-A 蛋白保守结构域分析Fig.4 Analysis of conserved domains of CsAP1-A protein

图5 CsAP1-A 蛋白同源序列比对Fig.5 Homologous sequence alignment of CsAP1-A protein
2.2.3 CsAP1-A 氨基酸序列的系统进化 为进一步了解CsAP1-A 蛋白的系统进化情况,从NCBI数据库中挑选20 条与CsAP1-A 氨基酸序列具有一定同源性的氨基酸序列,利用MEGA6.0 软件的NJ 法构建进化树。结果(图6)表明,CsAP1-A的进化树可以分为单子叶植物和双子叶植物两类[17],其中在单子叶植物中,CsAP1-A 与其他兰科植物亲缘关系较近,并聚类一起。

图6 CsAP1-A 蛋白NJ 系统进化树Fig.6 Neighbor-joining phylogenetic tree of CsAP1-A protein
2.3 CsAP1-A 基因时空表达分析
为研究CsAP1-A的表达模式,用RT-qPCR方法分别检测其在墨兰根、茎、叶、花、果不同器官,不同花发育阶段,以及萼片、花瓣、唇瓣、合蕊柱不同花朵组织部位的表达情况。结果(图7)表明,CsAP1-A在墨兰不同器官中均有表达,在花中表达量最高,其次分别为茎、果、根和叶。

图7 CsAP1-A 在墨兰不同器官中的相对表达量Fig.7 Relative expression of CsAP1-A in different organs of Cymbidium sinense
在墨兰花芽分化发育的不同阶段,CsAP1-A集中在花发育早期阶段表达,在S1阶段的表达量最高,之后逐渐下降,在S3 阶段的表达量降至60%,在S5 阶段的表达量降至最低。此外,对墨兰不同花组织部位的表达分析发现,CsAP1-A在合蕊柱中的表达量最高,其次分别是唇瓣、花瓣和萼片(图8)。
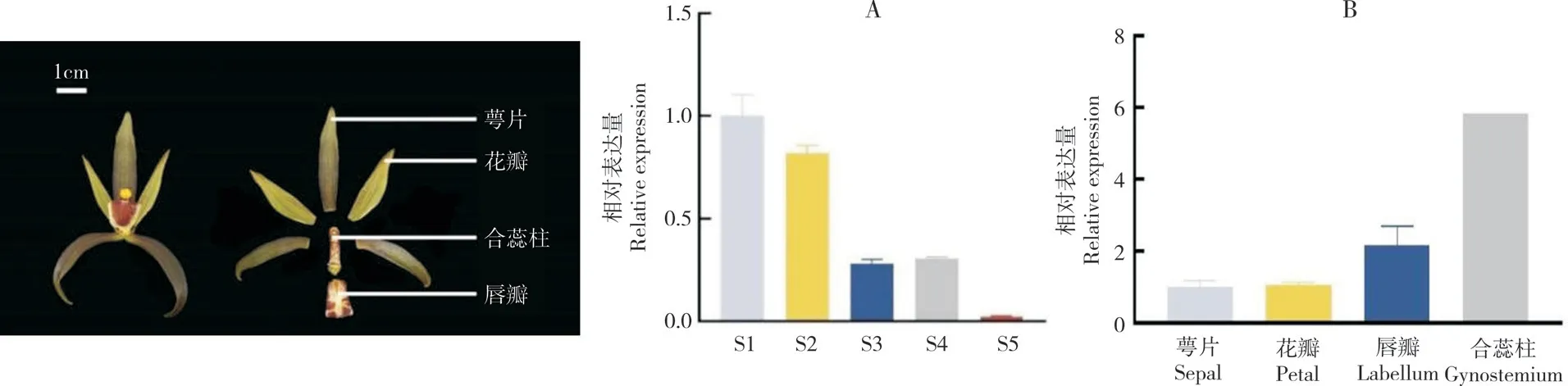
图8 CsAP1-A 在墨兰花中的相对表达量Fig.8 Relative expression of CsAP1-A in flower of Cymbidium sinense
2.4 不同花型墨兰CsAP1-A 表达模式分析
分析墨兰不同花型转录组数据集,用热图形式显示不同花型CsAP1-A基因的表达情况。结果(图9)表明,CsAP1-A在WT、MPV、LAPV 和NLV 4 种花型[18]中均以合蕊柱中的表达量最高、萼片中的表达量最低;在合蕊柱异常发育的MPV中,CsAP1-A在合蕊柱的表达量显著提高,而在GPV 中的整体表达量最高,且表达区域从合蕊柱扩展到花瓣。
2.5 CsAP1-A 蛋白互作预测分析
使用String 在线网站预测CsAP1-A 蛋白与其他蛋白之间的互作可能性,并以水稻作为参考,结果(图10)表明,CsAP1-A 可能与MADS1(A类基因)、MADS6(D 类基因)、MADS47(B 类基因)、MADS8(C 类基因)等10 个蛋白存在互作关系。MADS1 与MADS47 的综合得分较高,推测CsAP1-A 与它们互作的可能性更大。而在水稻中,OsMADS1 和OsMADS6 蛋白均属于MADSbox 转录因子家族成员,且这些蛋白在花器官发育和花期调控方面发挥重要作用[19]。因此,推测CsAP1-A 蛋白参与墨兰花的发育。
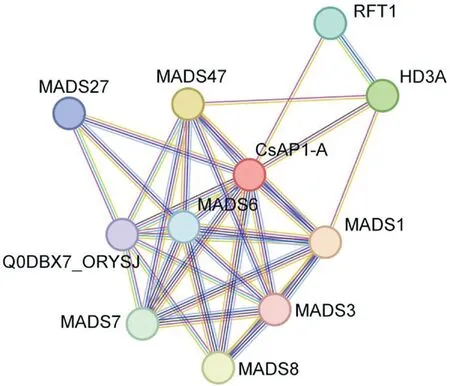
图10 CsAP1-A 蛋白互作关系预测Fig.10 Prediction of CsAP1-A protein interactions
3 讨论
MADS-box 转录因子在调控植物花的形态和发育过程方面扮演着重要角色,而AP1基因是MADS-box 转录因子家族的重要成员,被归类为拟南芥ABCDE 开花模型中的A 类基因,在许多植物中均被证实能够发挥调控植物开花、调控花器官发育的作用[20]。五峰玉兰MawuAP1基因可以使拟南芥提前开花,并在花序顶端产生顶生花[21]。过表达麻风树JcAP1基因能够显著缩短拟南芥的生长周期并导致提前开花[22]。过表达月季RcAP1也可以使拟南芥提前开花[23]。
本研究从墨兰花芽中克隆出CsAP1-A基因,该基因编码区为744 bp,编码248 个氨基酸,含有MADS-box 和K-box 结构域,表明CsAP1-A是典型MADS-box 转录因子。通过与其相似度较高的蛋白进行多序列比对,发现它们的保守结构域相同。系统进化树分析表明,CsAP1-A 蛋白与春兰AP1/FUL3 蛋白聚为一支,说明二者亲缘关系最近。
大多数A 类基因在生殖器官的表达量均高于营养器官[24]。本研究比较了CsAP1-A基因在墨兰根、茎、叶、花、果5 个器官的相对表达量,发现CsAP1-A在花中的表达量最高,在其他器官的表达量较低,说明CsAP1-A与花的发育和形成有关。在墨兰花芽分化的5 个时期中,CsAP1-A在花芽分化初期(S1)的表达量最高,然后逐渐下降,在开花期(S5)的表达量降到最低,这与大部分的A 类基因在不同花发育时期表达规律相似,如山茶的CjAPL1[25]、麻风树的JcAP1[22]和洋桔梗的EgAP1[26],因为S1 期是花器官形成的起始阶段和关键阶段,AP1作为一个转录因子,可以在此阶段启动信号来激活其他基因促进花的形成,而随着花芽的不断发育,其他相互作用的调控因子和信号通路逐渐介入,AP1的表达量就会逐渐降低。在墨兰花朵的不同组织部位中,CsAP1-A在合蕊柱的表达量最高,其次是唇瓣,推测CsAP1-A主要参与墨兰合蕊柱的发育。对墨兰不同花型进行转录组测序分析,发现CsAP1-A在WT、MPV、LaPV 和NLV 4 种花型的合蕊柱中表达量均最高,这与RT-qPCR 检测WT 花型中CsAP1-A的表达结果相一致。AP1作为A 类基因主要在第一、二轮花器官中表达,诱导花瓣和萼片的发育[7];但在兰科植物中,AP1不在第一、二轮花器官表达,而是在内轮的合蕊柱中表达[27]。
根据蛋白互作关系的预测结果可知,CsAP1-A 大多与MADS-box 蛋白家族存在相互作用,而这些蛋白均与花器官发育和花期相关,因此预测CsAP1-A 蛋白在墨兰花器官发育过程中起重要作用,这为进一步研究墨兰花器官发育分子调控机制提供理论依据。
4 结论
本研究在墨兰花芽中克隆得到CsAP1-A基因,该基因编码248 个氨基酸,含有MADS-box转录因子家族的MADS-box 和K-box 结构域。墨兰CsAP1-A与春兰和蕙兰的亲缘关系最近,且可能与MADS1、MADS6、MADS47、MADS8 等蛋白具有相互作用。CsAP1-A在墨兰花中的相对表达量显著高于其他器官,且在花芽分化初期的表达量最高,并随着花朵发育而逐渐下降;在墨兰花朵不同组织部位中,CsAP1-A在合蕊柱的表达量最高,其次是唇瓣、花瓣和萼片。通过对不同花型的墨兰品种转录组测序发现,CsAP1-A在WT、MPV、LaPV 和NLV 4 种花型的合蕊柱中表达量均最高。综上所述,CsAP1-A可能在墨兰花发育和合蕊柱形成中具有重要作用。
