姜黄素纳米胶囊亲水改性及体外评价综合实验设计
2023-11-13刘焕迪张红蕾贾新超张路路
刘焕迪,杜 洁*,张红蕾,贾新超,张路路,李 玮
(1.河北大学 化学与材料科学学院,保定 071002;2.晨光生物科技集团股份有限公司,邯郸 056000;3.河北牧群生物科技有限公司,保定 071002)
姜黄素(Curcumin,Cur)是从姜科植物中提取的一种可食用色素,安全无毒,具有抗肿瘤、抗炎、抗氧化等广泛的药理作用[1];近期研究还发现,姜黄素能有效抑制新冠病毒的活性及繁殖能力[2-4]。但姜黄素难溶于水,生物利用率低,抗氧化性差[5-7]等缺点影响了其发展及临床上的应用。为了克服姜黄素稳定性差、生物利用率低等缺点,许多研究者利用纳米粒[8-9]、脂质体[10]、介孔材料[11]等药物载体材料运载姜黄素,使其能够在生物体内更加稳定且高效地发挥其药效。但是,递送载体本身存在生物相容性差、降解产物导致正常细胞炎性等不足,并且没有解决水溶性差的问题,影响其在临床上的广泛应用。因此选择一种安全有效无毒的递送载体,构建易分散于水的递药系统,对姜黄素应用具有重要的临床意义。
聚羟基脂肪酸酯(polyhydroxyalkanoates,PHA)是一类由多种微生物胞内发酵合成的生物可降解高分子材料,有着良好的生物可降解性、生物相容性等性能。其在体内可被完全降解为二氧化碳、水和一些水溶性的分子团,不会对机体带来毒性,被广泛应用在生物医学领域[12]。其作为载体在疏水性药物的包封及缓释方面也具有独特的优势[13],已有研究利用PHA 作为载体分别对免疫抑制剂硫唑嘌呤(AZA)[14]、抗癌药物5-氟尿嘧啶(5-FU)[15]进行递送,表现出了优异的生物相容性及药物缓释效果。本课题组前期采用乳化固化法,以PHA 纳米颗粒作为药物递送载体包裹疏水性药物姜黄素,制备出姜黄素生物可降解的纳米胶囊(Cur@PHA),并对其包封率及载药量进行了研究[16]。
为了进一步改善Cur@PHA 在水中的分散性及稳定性,我们利用天然PHA 表面结合的颗粒表面结合蛋白(PhaP)的两亲特性,对姜黄素纳米胶囊进行表面改性。本实验首先设计并合成了PHAP蛋白并对其进行纯化,通过自组装的方式将其修饰在前期所制备的Cur@PHA 表面。PhaP 疏水结构域吸附在PHA 载体表面,亲水结构域暴露在水溶液中,将Cur@PHA 表面由疏水性改性为亲水性,以期提高药物在水中的分散性。然后我们对所制备的表面改性姜黄素纳米胶囊(PHA@Cur-PhaP)形貌、血清稳定性、PH 稳定性、光稳定性、药物释放性能及细胞毒性进行了表征与评价,构建出易分散于水、生物利用度高、光稳定性能优的绿色、无细胞毒性的姜黄素纳米胶囊系统。该工作对解决疏水性药物姜黄素的体内递送具有现实意义。
本实验来源于产业需求,以解决实际问题为出发点,涉及分子生物学、材料学、仪器分析等专业知识,以提高学生应用创新能力为目标开展实验教学,系统的实验思考与操作过程能够加深学生对本专业领域的体会与定位,强化学生的学习目标,增强学生对个人发展目标的认识,激发学生对化学生物学科的浓厚兴趣与热情。
1 实验药品与仪器
试剂耗材:咪唑、胰蛋白胨、酵母粉、十二烷基硫酸钠、98%噻唑蓝溴化四氮唑(MTT)、100X 青霉素/链霉素溶液、DMEM 培养液、DNA连接酶快速连接试剂盒、考马斯亮蓝染液均购自上海生工;胎牛血清购自Gibco;二甲基亚砜(DMSO)购自阿拉丁试剂;硫酸卡那霉素购自BBI Life Sciences;琼脂糖购自Biowest;HisTrapTM HP 和HisTrapTM Desalting 预装柱均购自GE 生命科学。
仪器:双向磁力加热搅拌器(金坛市荣华仪器);小型离心机(德国Eppendorf);旋转蒸发仪(日本Eyela);电子天平(美国BECKMAN);超声波粉碎机(宁波新芝生物);高效液相色谱仪(美国Thermo Fisher Scientific);冷冻干燥机(日本Eyela);扫描电子显微镜(日本Hitachi);电泳仪(北京六一生物);PCR 仪(德国Eppendorf);蛋白纯化系统(美国GE);大型离心机(美国Thermo Fisher Scientific);凝胶成像分析仪(上海天能科技);立式压力蒸汽灭菌器(上海博讯医疗生物仪器);恒温培养振荡器(上海智城分析仪器);多功能酶标仪(美国BioTek)和细胞培养箱(新加坡ESCO)。
2 实验方法
2.1 亲水性颗粒蛋白PhaP 的合成及纯化
由蜡样芽孢杆菌基因组(登录号:CP023245)中注释的phap 基因设计引物phap-F:CGGGATCCATGGAAACTAAACCATACG,phap-R:CCCTCGAGTTACTTGATGGAAGTAAATAG。使用上述引物,以HBL-AI 全基因组为模板,对phap基因片段进行扩增。琼脂糖凝胶电泳对PCR 产物进行检测,并对目标条带进行纯化。使用限制性内切核酸酶BamHI 和Xhol 消化纯化后的PCR 产物及质粒pET-28a,使二者具有相同的粘性末端,并利用DNA 连接试剂盒对其进行连接。连接产物转化E.coli DH 5α 感受态细胞,筛选阳性重组子。将重组质粒转化至E.coli BL21(DE3)plysS 中。挑取单菌落置于添加卡那霉素(终浓度100 μg/mL)的LB 培养基中,37 ℃,200 rpm 振荡培养过夜。次日,对培养液进行离心,收集菌体沉淀进行高压破碎。上清液使用HisTrapTM HP 预装柱(1 mL)进行梯度洗脱纯化。随后,采用HisTrapTM Desalting 预装柱(5 mL),用1×PBS(pH=7.4)缓冲液进行洗脱,脱掉洗脱液中的盐。纯化后的PhaP 蛋白采用12%变性聚丙烯酰胺凝胶电泳进行验证分析,凝胶在80 V 下运行0.5 h,然后在130 V 下运行1 h,电泳后凝胶用考马斯亮蓝染色并观察。收集的PHAP 蛋白于4 ℃保存,备用。
2.2 Cur@PHA 与PhaP 蛋白的自组装及形态表征
称取1 mg Cur@PHA 颗粒,加入到2 mL PhaP蛋白溶液(浓度为1.2 mg/mL)中,在4 ℃环境下低速搅拌,使其反应过夜。反应液12 000 rpm,4 ℃,离心5 min,收集沉淀得到结合物Cur@PHA-PhaP。然后采用BCA 蛋白浓度检测方法测定吸附前后上清液中PhaP 浓度,通过差值法计算PHA 表面的PHAP 蛋白吸附量,来评估蛋白吸附量情况。
分别取10 μL Cur@PHA-PhaP 样品沉积在硅片表面上,自然干燥,15 kV 电压下,放大30 000倍,进行扫描电镜(SEM)的观察。
2.3 Cur@PHA 改性前后分散性测试
准确称取8 mg 的Cur@PHA 颗粒于50 mL 离心管中,加入过滤好的磷酸盐缓冲液(pH=7.4)1 mL 重悬,使用95%的功率,低温超声20 min,待颗粒全部重悬后转移至1.5 mL 玻璃小瓶中,立即拍照。
准确称取8 mg 的Cur@PHA 颗粒于50 mL 离心管中,加入16 mL PhaP 蛋白溶液,低温过夜结合。将结合后的溶液经12 000 rpm,4 ℃,离心5 min,收集沉淀,将沉淀用过滤好的1 mL 磷酸盐缓冲液(pH=7.4)重悬并转移至1.5 mL 玻璃小管中,立即拍照。
将以上两种溶液静置2.5 h 后,拍照并观察二者分散稳定性。
2.4 Cur@PHA-PHAP 体内稳定性测试
1)血清稳定性:将Cur@PHA-PhaP 溶液与等体积的10%非加热灭活的胎牛血清混合,置于37 ℃下孵育。分别在孵育的1、2、4、8 和12 h 取混合液进行10%非变性聚丙烯酰胺凝胶电泳分析。
2)pH 稳定性:将Cur@PHA-PhaP 分别浸入到Tris-HCl 溶液(pH=4.5),PBS 溶液(pH=7.4)和磷酸氢二钠溶液(pH=9.0)中,于37 ℃进行孵育。分别在孵育0.25、0.5、1、2、4、8 和12 h 后,取混合液进行10%非变性聚丙烯酰胺凝胶电泳分析。
2.5 Cur@PHA-PhaP 的释药性能测定
将1 mL Cur@PHA-PhaP 溶液(终浓度100 μmol/L)转移到透析袋(MWCO 10kDa)中,并浸入醋酸-醋酸钠的缓冲液(pH=4.5)中,在37 ℃条件下,以100 rpm 的转速在振荡器中轻轻摇动。分别于间隔时间0、2、4、6、8、12、24、48、72、96、120、144、168、192、216、240、264、288、312、336、360 和384 h,取出500 μL 透析袋外的混合溶液,进行HPLC 检测。通过Cur 标准曲线依次计算出对应浓度。通过如下公式计算Cur 的释药率。
释药率R(%)=C1/ C0×100%
其中C1是释放的Cur 浓度,C0是装载在Cur@PHA-PHAP 中的Cur 浓度。
释药时间作为横坐标,释药率作为纵坐标,分析Cur@PHA-PhaP 的体外释放行为。
2.6 Cur@PHA-PhaP 光稳定性测试
称取Cur@PHA-PhaP 和Cur 各15 mg 分别加入到15 mL 甲醇中配制成溶液,置于阳光下进行照射。在阳光照射的0~10 天内,每天分别取上述两种溶液10 μL 混合到3 mL 氯仿溶液中,采用紫外分光光度仪在425 nm 波长下检测Cur 的含量,观察Cur 含量的变化。
2.7 Cur@PHA-PhaP 的细胞毒性测试
MGC803 细胞培养于含有10%(v/v)胎牛血清和100 U/mL 青霉素和100 μg/mL 链霉素的DMEM培养基中。将指数生长期的MGC803 细胞以1×105个细胞/孔的浓度接种到96 孔板中,37 ℃,5%CO2环境下孵育。培养24 h 后,取10 μL PHA缓冲溶液、Cur 溶液和Cur@PHA-PhaP 溶液分别加入到上述96 孔板中,继续培养24 h。然后向每个孔中加入10 μL 的MTT(5 mg/mL),于37 ℃下孵育4 h。弃去上清液,向各孔中加入100 μL DMSO。记录570 nm 波长下的吸光值。通过以下公式计算细胞生长抑制率。
细胞生长抑制率(%)=(OD 阴性对照-OD 处理)×100%/(OD 阴性对照-OD 背景)。
每次实验5 组平行。
3 实验结果与讨论
3.1 亲水性蛋白PhaP 的纯化
以HBL-AI 全基因组为模板,通过PCR 成功克隆了phap 基因(541 bp),结果如图1(a)所示。PCR 反应均为单一条带无非特异性扩增,条带大小与预期相符。

图1 电泳测试结果分析
目的基因片段经酶切、连接、转化后,挑取阳性转化子测序验证,测序结果显示:成功构建重组质粒pET-28a(+)&phap。将重组质粒转化至E.coli BL21(DE3)plysS 中,通过诱导表达,得到可溶性目的蛋白。蛋白经亲和层析、脱盐、浓缩进行纯化。将纯化后的蛋白经SDS-PAGE 电泳检测结果如图1(b)所示:蛋白条带大小与PhaP 分子量(23.9 kDa)大小相同且条带单一,蛋白可用于后续实验。
3.2 Cur@PHA-PhaP 的组装及形貌表征
将Cur@PHA 与纯化得到的PhaP 蛋白溶液进行混合,利用PHAP 蛋白与PHA 之间的疏水作用力,使其自发吸附到Cur@PHA 表面,形成自组装体Cur@PHA-PhaP。通过差值法计算得到的1 mg Cur@PHA 吸附PHAP 蛋白的量为0.5 mg,确定蛋白确实吸附在Cur@PHA 上。
将自组装体Cur@PHA-PhaP 进行SEM 观察,结果如图2 所示。经过表面改性后,Cur@PHAPhaP 粒径大小约为200 nm,微球表面粗糙,基本呈球形。微球中间颜色深,边缘颜色浅,也表明PhaP 蛋白修饰在胶囊外围。

图2 Cur@PHA-PhaP 的SEM 图
3.3 Cur@PHA-PhaP 分散性分析
为了比较纳米胶囊表面改性前后的分散性,我们对其悬浊液进行了对比,如图3(a)所示。改性前的纳米胶囊水溶液,胶囊颗粒大部分悬浮于水溶液中,少部分发生团聚并开始沉降。改性后的纳米胶囊颗粒能够均匀的悬浮于水溶液中,其分散性更优。

图3 分散性测试分析
同时,我们对二者2.5 h 静置后所呈现悬浊液的分散性进行了对比,结果如图3(b)所示:改性前的纳米胶囊经过2.5 h 的静置大部分发生沉降,而经过表面改性的纳米胶囊沉降现象不明显,分散性及稳定性更优。
3.4 Cur@PHA-PhaP 体外稳定性分析
1)血清稳定性。为了研究Cur@PHA-PhaP血清环境稳定性,将其放置于中性的血清环境中进行孵育。在孵育的不同时间取样进行SDS-PAGE电泳分析,结果显示Cur@PHA-PhaP 随着在血清中孵育时间的延长,在点样孔处可以清晰地看到条带未发生变化,如图4(a)所示,也未检测到因结构解体而生成的PhaP 蛋白条带,说明Cur@PHAPhaP 在血清中结构稳定性良好。

图4 SDS-PAGE 电泳分析Cur@PHA-PhaP 稳定性
2)pH 稳定性。我们研究了Cur@PHA-PhaP在不同pH 条件下的稳定性及变化。从图4(b)中可以看出:Cur@PHA-PhaP 在中性环境(pH 7.4)中可以保持稳定的组装体结构,在pH 4.5 和pH 8.0环境下,胶块上可以检测到PHAP 蛋白条带,说明在酸性和碱性条件下Cur@PHA-PhaP 体系不稳定,结构发生解离。
上述结果表明Cur@PHA-PhaP 载药体系有利于药物在输送过程中保持稳定,而运输至酸性环境的肿瘤患处,载药体系发生解离,有利于胶囊到达细胞溶酶体后释放出包裹的姜黄素,以此达到药物控释的效果。
3.5 Cur@PHA-PhaP 体外药物释放分析
我们在酸性环境下对Cur@PHA-PhaP 的药物释放进行了研究。从图5 可以看出,经过24 h,Cur 仅释放了35.46%。随着时间延长,Cur 被持续释放,在384 h 时,Cur 达到较大释放率(89.56%)。
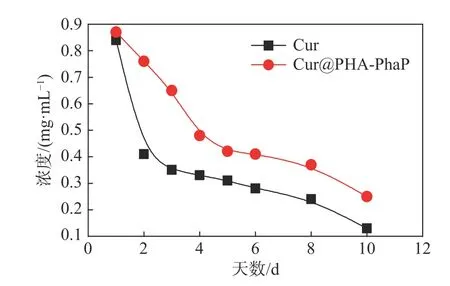
图5 光稳定性分析
这是由于Cur 被包裹在PHA 微球内部,在中性环境(pH 7.4)中可以保持较稳定的组装体结构,药物无法释放。当环境发生改变,酸性环境中PHA 被破坏,Cur 逐渐从疏水核心释放到外部溶液。由此说明Cur@PHA-PhaP 结构可对姜黄素的药物缓释起到很好的效果。
3.6 Cur@PHA-PhaP 光稳定性分析
游离的姜黄素本身在光照下极易被降解,为了研究Cur@PHA-PhaP 的光稳定性,将Cur 和Cur@PHA-PhaP 同时置于太阳光照下,每天定时取样,HPLC 分析姜黄素降解情况。如图6 所示,在第二天时,游离姜黄素含量降低了近一半,到第十天游离姜黄素基本全部被降解。而制成纳米胶囊的Cur@PHA-PhaP,因有PHA 材料的包裹作为保护,降解速率明显变慢。这说明纳米胶囊结构能够有效帮助姜黄素抵御光解作用,更利于药物保存。

图6 姜黄素的释放
3.7 Cur@PHA-PhaP 体外细胞毒性
很多研究表明PHA 材料本身没有明显的细胞毒性,也没有先天的免疫原性。本文通过MTT 实验验证了随着PHA 浓度的增加,细胞存活率并未发生改变,证明PHA 纳米颗粒本身对细胞无毒性,如图7 所示。

图7 PHA 对细胞的毒性评价
同样采用MTT 实验将Cur 与Cur@PHA-PhaP对细胞的毒性情况进行了评价。结果如图8 所示,Cur 的IC50 值为29.03±3.275 μmol/L,Cur@PHAPhaP 的IC50 值更低,仅为2.575±3.509 μmol/L,说明包裹Cur 的纳米胶囊对癌细胞表现出更强的毒性。上述结果也说明Cur@PHA-PhaP 对姜黄素药物具有较好装载效果,显著增强了细胞对药物的摄取能力,从而产生更强的抗肿瘤作用。

图8 Cur 与 Cur@PHA-PhaP 对癌细胞的毒性评价
4 结束语
本实验中,我们对前期所制备出的Cur@PHA进行了表面改性,将设计合成的两亲性PHAP 蛋白成功修饰于Cur@PHA 表面,获得颗粒均匀、分散性更优的Cur@PHA-PhaP 纳米胶囊载药体系。
我们对优化后的Cur@PHA-PhaP 血清稳定性、PH 稳定性及体外释放性能进行了评价:该载药体系在血清中稳定性良好,PHA 对姜黄素具有一定的保护作用;载药体系能够在酸性条件下发生解离,姜黄素从疏水中心得以释放,实现了纳米载药体系对药物的缓/控释作用,从而可以更有效地发挥其药效。光稳定性实验表明:该载药体系能提高姜黄素的稳定性,有效保护姜黄素抵御光解作用。细胞毒性实验表明:PHA 纳米材料本身对细胞无毒性,而装载姜黄素的纳米胶囊显著增强了细胞对姜黄素的摄取能力,表现出优异的癌细胞毒性,增强了药物的利用率。
本实验作为一项综合创新型实验,将专业知识与产业需求相结合,针对医药产业的实际问题引发学生思考,激发学生对所解决问题及实验设计产生浓厚兴趣。学生依据问题设计相应的实验方案,对实验内容进行合理规划,在具体的实验过程中使科学问题得到解决,培养了学生的实验探究能力。同时,学生能够利用原有实验设计出有价值的新实验,结合广泛的理论知识及实验技术手段更深层次的开展科学研究,在科学性、合理性、可行性的基础上,提高了学生的创新意识。此外,通过解决实际问题,强化了专业知识在社会发展中的具体应用及带来的具体成果,增强了学生的学习主动性和社会责任感。
