生物质碳点为还原剂的银纳米颗粒的合成及其催化性能研究
2023-11-13李晨雨谢振宇赵海港郑保战
赵 燕,李晨雨,谢振宇,赵海港,杜 娟,郑保战
(四川大学 化学学院,成都 610065)
银纳米颗粒具有独特的物理化学性质,在表面等离子体共振、催化、抗菌、生物医学、传感等领域应用广泛[1-4]。目前已有多种方法用于银纳米颗粒的制备,主要包括物理法、化学法和生物法等。其中,化学法由于反应条件温和、制备方法简便、合成的纳米颗粒均匀而得到大家的青睐。大多数化学法是在稳定剂存在下,基于各种还原剂对银盐前驱体的还原。常使用的还原剂有硼氢化钠[5]、柠檬酸钠[6]、水合肼[7]等,但这些物质往往反应活性较高,具有潜在的环境和生物风险;多余的稳定剂如表面活性剂[8]、聚合物[9]、DNA[10]等常需要经过水洗、热处理等方式去除,不仅增加了后处理的难度,还会造成纳米颗粒的团聚,不利于反应物质与银纳米颗粒活性位点的有效接触,从而降低银纳米颗粒的催化性能;一些方法还会用到有机溶剂,不利于后续的实际应用。为了克服上述缺点,需要发展新的方法使银纳米颗粒的制备更简单,性能更加优良,符合绿色环保的理念和分析化学实验教学改革的要求。
碳点因其独特的光致发光性质、稳定的物理化学性质、超低毒性以及良好的生物兼容性而备受关注,广泛应用于光电器件[11]、生物医学成像[12]、传感[13]、防伪[14]、光催化及诊断等领域。近年来,碳点被证明具有比传统的有机表面活性剂更优良的电子性能[15],已有多项研究采用碳点来制备金属纳米颗粒来作为传感器或者催化剂[16-18],但这些研究中多采用化学试剂作为碳源来制备碳点,从某种意义上讲并不环保。绿色快速合成碳点,不仅方法简单可以一步生成,而且无须昂贵的材料和复杂的实验设备,后处理简便快捷。
作为环境友好的天然产物,与其他碳源相比,生物质碳源具有低成本、易获取、储量丰富、绿色环保等优点,含有杂原子的生物质更是制备碳点的绝佳选择。各种各样的生物质被用来制备碳点,如大蒜、冬瓜、辣椒、菠菜、牛奶、芦荟、橙子皮、荸荠等等[19-26]。银杏,作为成都市一种常见的市政绿化植物,在四川大学校园内广泛分布,银杏叶富含多种氨基酸和多糖,能够提供丰富的碳以及氮元素,因此,我们推测其可作为前体用于制备还原型的生物质碳点用以银纳米颗粒的合成。另外,通过生物废弃物银杏叶来制备碳点,不仅可以为碳点的绿色、高效和工业化生产提供一种新的途径,也可以为银杏叶的处理和再利用提供一种新的解决方案。
本文以生物废弃物银杏叶为碳源,利用传统的水热法,通过一步反应制备了具有黄色荧光的生物质碳点,利用该碳点的还原性制备了银纳米颗粒。实验证明,在硼氢化钠(NaBH4)存在条件下,该银纳米颗粒对于有机染料甲基橙(MO)和罗丹明6G(R6G)的还原脱色具有较好的催化性能。
本实验涉及天然产物的前处理、定量分析的基本操作以及紫外-可见分光光度计的操作,可显著提高学生的综合实验能力,为分析化学实验教学改革提供参考,可作为综合或者创新创意实验面向大一、大二化学专业及其他具有化学学科背景、拥有化学专业基础知识的学生开放,激发学生对环境问题的关注,同时可引导学生针对碳点的其他光学性质以及更多环境污染物的降解开展更深入细致的研究工作。
1 实验目的
1)学习碳点及银纳米颗粒的常用制备方法和表征手段;
2)了解催化动力学的基本概念及其在染料降解领域的应用。
3)学习并掌握紫外-可见分光光度计的原理及使用方法。
4)激发学生对环境问题的关注,并针对更多环境污染物的降解开展更深入的研究。
2 实验原理
一般情况下,可通过两种策略来制备银纳米颗粒,即自上而下(top-down)和自下而上(bottomup)法。自上而下的合成方法包括电弧放电法、激光消融法和球磨法等,属于物理制备方法,即将大块的银单质通过物理手段变成粒径为纳米级别,这种方法设备昂贵且制作成本高;自下而上的合成方法则是通过化学还原、电化学、超声等方法将金属前驱体还原,再进一步生长为银纳米颗粒。常见的化学还原法是利用水或溶剂来制备银纳米颗粒的。大多数化学还原法是在稳定剂存在下,基于各种还原剂对银盐前驱体的还原。银纳米颗粒的生长过程中,前驱体被还原为银原子,属于氧化-还原反应,不同尺寸、形状的银纳米颗粒的形成还伴随着复杂的晶体形成的物理过程。
碳点是一类球形或者类球形的,由碳、氢、氧、氮等元素组成的粒径一般小于10 nm 的碳纳米材料,通常由sp2杂化的碳结构作为核心和表面丰富的官能团组成。银杏叶富含多种氨基酸和多糖,可为碳点的制备提供有效的碳源和氮源,采用水热法,以银杏叶为原料,制备了生物质碳点,得到的碳点具有良好的水溶性和还原性,可作为还原剂和稳定剂来制备银纳米颗粒,进一步的研究表明,在硼氢化钠存在的条件下,该银纳米颗粒可催化硼氢化钠对于甲基橙和罗丹明6G 的还原脱色。
3 仪器与试剂
3.1 主要仪器
BSA124S 型电子天平(赛多利斯);101-2A 电热恒温鼓风干燥箱(北京中兴伟业仪器有限公司);FW200 型高速万能粉碎机(北京中兴伟业仪器有限公司);UV-1780 型紫外-可见分光光度计(日立);H-8100 TEM 透射电镜(日立);XRD 6100 X 射线粉末衍射仪(岛津);6700 型傅里叶变换红外光谱仪(赛默飞);TGL-16 型高速离心机(四川蜀科仪器有限公司);UPH-I-40L 型超纯水机(四川优普超纯科技有限公司)。
3.2 材料和试剂
黄色的银杏叶收集于四川大学江安校区,通风阴凉干燥处保存;硝酸银、氨水、硼氢化钠、甲基橙、罗丹明6G 购于成都科隆化学品有限公司,均为分析纯,未经进一步处理,直接使用。
4 实验步骤
4.1 水热法制备生物质碳点
将银杏叶用去离子水清洗干净,置于65 ℃的电热恒温干燥箱中烘干后,粉碎机粉碎成粉末。准确称取1.00 g 的银杏叶粉末,加入20 mL 去离子水,超声混匀后转移至聚四氟乙烯水热反应釜中,于烘箱中 160 ℃条件下保温1 h 进行水热反应,自然冷却至室温,8 000 r/min 离心5 min 后收集上清液,经0.22 μm 微孔滤膜过滤后稀释至20 mL,即得到银杏叶碳点,ginkgo leaf carbon dots,记为GL-CDs(50 g/L,以银杏叶粉末质量计)。制备流程如图1 所示。

图1 生物质碳点GL-CDs 的制备流程图
4.2 银纳米颗粒的制备
室温搅拌下,向25 mL 1.5 g/L 的GL-CDs 溶液中滴加80 μL 的银氨溶液(80 mmol/L),溶液颜色从淡黄色变为棕红色表明银纳米颗粒AgNPs/GLCDs 的生成[27]。将制得的AgNPs/GL-CDs 置于冰箱4 ℃下避光保存。
4.3 银纳米颗粒催化性能的研究
以有机染料MO 和R6G 在NaBH4存在条件下的还原脱色作为模型反应体系,考察AgNPs/GLCDs 的催化性能。
配制MO 水溶液(10 mg/L、25 mg/L)和R6G水溶液(10 mg/L)备用,0.5 mol/L 的NaBH4溶液现配现用。基本操作步骤如下:移取2.00 mL 的染料溶液和0.20 mL 的NaBH4溶液于石英比色皿中,混合均匀后,加入20 μL 的AgNPs/GL-CDs,在不同的反应时间下通过紫外-可见分光光度计记录最大吸收波长处的吸光度值的变化,监测染料的还原脱色过程。
作为对比,同时研究了混合溶液在GL-CDs作为催化剂条件下吸光度随时间的变化,即移取2.00 mL 的染料溶液和0.20 mL 的NaBH4溶液于石英比色皿中,混合均匀后,加入20 μL 的GLCDs 溶液,在不同的反应时间下记录紫外-可见吸收光谱来监测其催化性能。
5 结果与讨论
5.1 形貌和结构表征
通过XRD 表征了GL-CDs 和AgNPs/GL-CDs的晶体结构,如图2 所示。GL-CDs 在2θ=22°左右处存在一个明显的宽峰,表明GL-CDs 存在无定形碳,证明碳点被成功的合成;对于AgNPs/GLCDs,在2θ=38°、44°、64°、77° 观察到的几个特征衍射峰则对应着面心立方银的(111)、(200)、(220)、(311)晶面,与标准数据库的数据一致(JCPDS 卡,4-783 号),没有其他杂质峰表明所得到的AgNPs/GL-CDs 为高纯度的银纳米颗粒。

图2 GL-CDs 和AgNPs/GL-CDs 的XRD 图
采用傅里叶变换红外光谱(FT-IR)对GL-CDs和AgNPs/GL-CDs 的表面官能团信息进行了进一步的确定,如图3 所示。出现在3 000~3 500 cm-1处的宽峰为O-H/N-H 的伸缩振动峰,表明在碳点表面存在羟基和氨基等亲水性基团,1 600 cm-1处左右的峰应为—C=O 的伸缩振动峰,可能来自于合成过程中多糖中—OH 的氧化;1 400 cm-1处左右的峰应为C—N 的伸缩振动峰;900~1 100 cm-1范围内的峰对应C—O 的伸缩振动。这些官能团的存在增加了GL-CDs 和AgNPs/GL-CDs 在水溶液中的稳定性及水溶性。
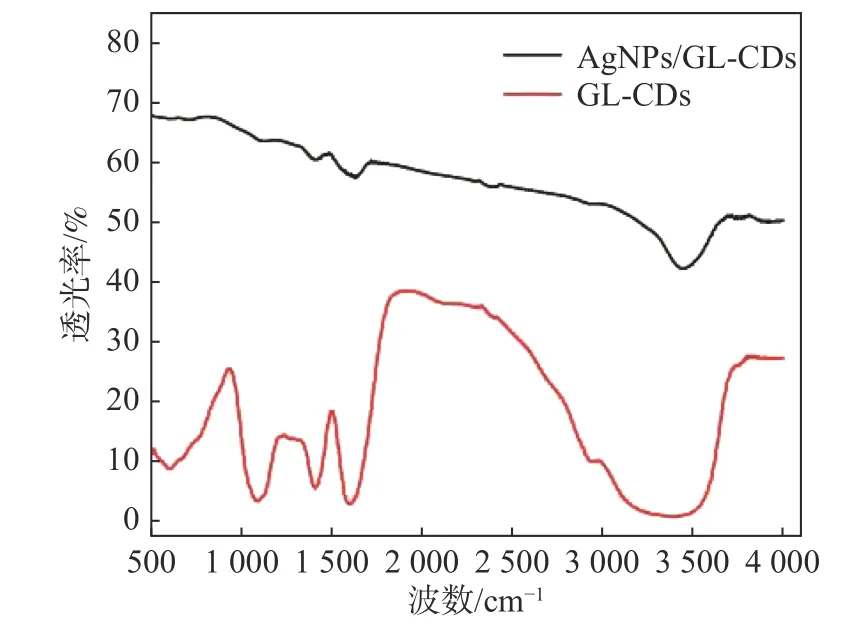
图3 GL-CDs 和AgNPs/GL-CDs 的FT-IR 图
5.2 银纳米颗粒催化性能的研究
有机染料广泛应用于印刷、纺织、造纸、油漆和塑料等行业。有机染料废水的污染已成为一个严重的环境问题,威胁到水生生物和人类社会的健康,如水溶性的有机染料MO 和R6G,不仅有毒,而且无法生物降解。NaBH4可将其还原脱色,但速率缓慢,实验表明,银纳米颗粒AgNPs/GL-CDs 的加入,可显著催化该进程。
在自然光下,MO 与NaBH4混合溶液在有无催化剂AgNPs/GL-CDs 的条件下随时间变化的数码照片,如图4 所示。从左到右依次为混合溶液(GL-CDs 作催化剂)、混合溶液(无催化剂)和混合溶液(AgNPs/GL-CDs 作催化剂)。肉眼可见,碳点GL-CDs 和NaBH4加入之后,溶液颜色无显著变化,说明两者对于MO 的还原脱色无明显作用。银纳米颗粒AgNPs/GL-CDs 加入之后,混合溶液颜色逐渐消失,最后漂白,表明MO 发生了还原脱色。图5 为MO 在还原过程中随时间变化的紫外-可见吸收光谱图,MO 的特征吸收峰逐渐减弱,约0.5 min 左右几乎完全消失,表明MO 还原进程的完成。

图4 自然光下MO 与NaBH4 混合溶液随时间变化的数码照片

图5 MO 随时间变化的紫外-可见吸收光谱图
我们同时考察了R6G 与NaBH4混合溶液在有无AgNPs/GL-CDs 做催化剂条件下的还原脱色情况,如图6 所示。从左到右依次为:混合溶液(GL-CDs作催化剂),混合溶液(无催化剂),混合溶液(AgNPs/GL-CDs 作催化剂)。从图中肉眼可见,碳点溶液GL-CDs 加入之后,R6G 的颜色无显著变化,NaBH4对于R6G 具有还原脱色的作用,但速率较慢,整个过程需要大约12 min 左右可完成(如图7(a)所示),加入银纳米颗粒AgNPs/GL-CDs 之后,该进程缩短至5 min 左右(如图7(b)所示)。

图6 自然光下R6G 与NaBH4 混合溶液随时间变化的数码照片
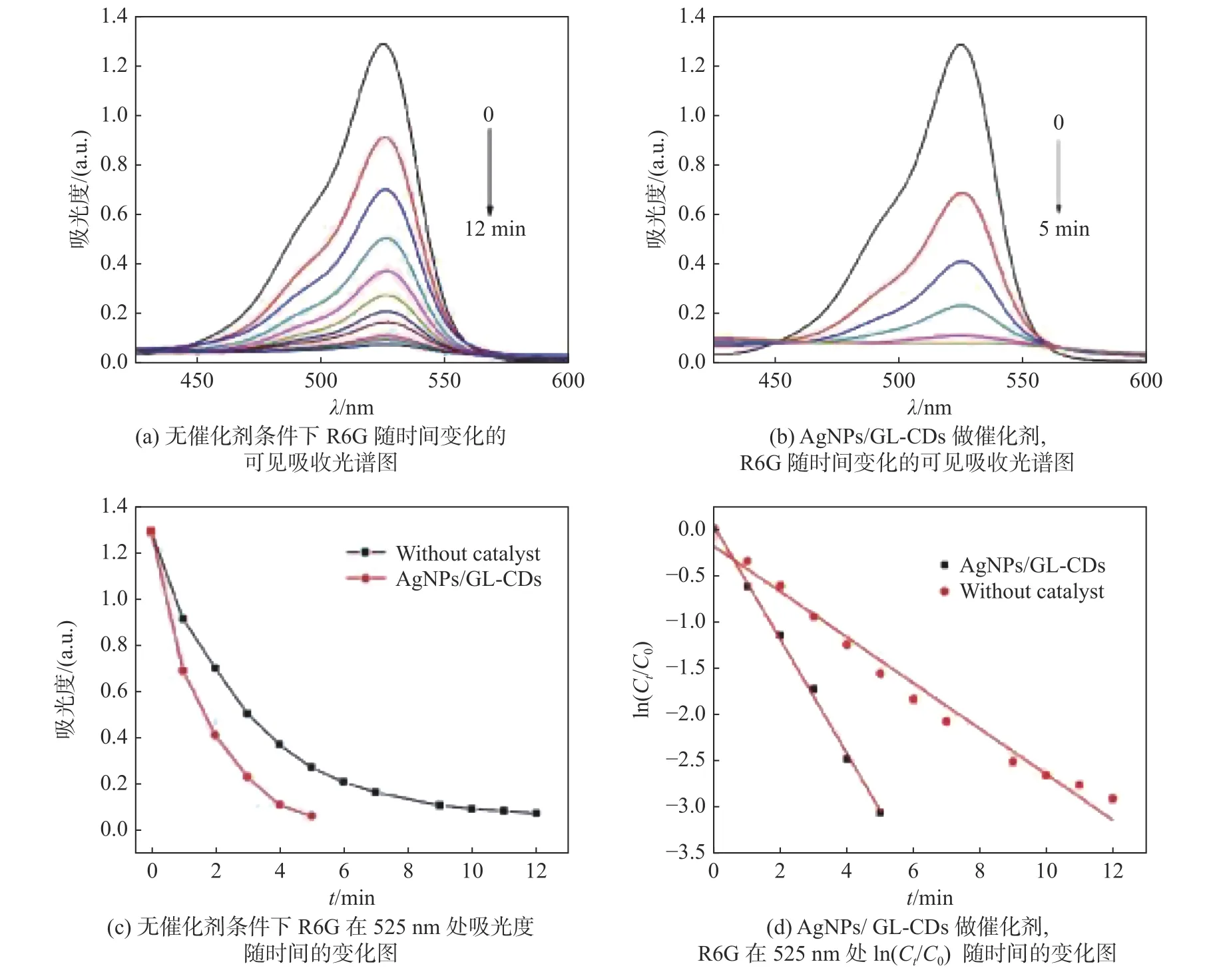
图7 AgNPs/GL-CDs 催化降解R6G 的性能研究
在该催化体系中,NaBH4的量远大于R6G,因此我们采用准一级动力学模型对R6G 的催化还原脱色进行描述,其动力学方程可表述为:
式中,C0为反应开始时R6G 在 525 nm 处的吸光度,Ct为反应过程中的吸光度,k为催化反应的反应速率常数,t为反应时间。
图7 为根据准一级动力学模型拟合的曲线,计算得到的反应速率常数分别为-0.24 min-1(无催化剂)和-0.61 min-1(AgNPs/GL-CDs 作催化剂),表明AgNPs/GL-CDs 具有较强的催化性能。
6 结束语
本实验基于天然产物银杏叶,通过水热合成法制备了生物质碳点,利用该碳点的还原性制备了银纳米颗粒,并进一步研究了银纳米颗粒的催化性能。将生物废弃物的处理和再利用与定量分析的基本操作以及紫外-可见分光光度计的使用结合起来,同时,又引入了纳米技术和催化动力学的概念,既锻炼了学生的基本操作技能,提高了学生的科研兴趣和热情,又能够解决实际问题,增强环保意识,此外又将绿色化学的理念同步渗透进实验教学过程中,可大大提高基础化学实验教学的质量,为分析化学实验教学改革提供参考。
