基于Nomogram建立肝硬化并发急性肾损伤的风险评估模型
2023-11-10潮燕陈聪
潮燕, 陈聪
池州市人民医院感染科,安徽池州 247200
肝硬化患者由于全身血流动力学改变、免疫调节紊乱、肝细胞反复损伤等,易导致一系列并发症,其中急性肾损伤(acute kidney injury,AKI)是肝硬化患者常见的并发症[1]。研究表明,肝硬化并发AKI患者的病死率明显高于单纯肝硬化患者[2],故如何及早预测肝硬化并发AKI的风险并加以防控一直是临床关注的热点。Nomogram即列线图,是一种由带有刻度的线段排列而成,能够将风险定量化的平面统计模型。近年来已有研究将列线图应用于AKI的风险评估[3],并证实较常规模型具有一定的优势,但目前就肝硬化并发AKI的风险而言,尚未形成统一且有效的风险评估模型。本文拟在筛选肝硬化并发AKI危险因素的基础上构建列线图风险评估模型,为临床对肝硬化并发AKI的早期识别和防控工作提供参考。
1 资料和方法
1.1 研究对象
选取本院2019年1月—2021年9月住院的肝硬化患者作为研究对象。纳入标准:①符合肝硬化诊断标准[4];②入院时间>48 h,肾功能检查次数≥2次;③HBV-DNA<20 IU/mL和HCV-RNA<15 IU/mL;④临床资料完整。排除标准:①既往有慢性肾损伤病史,即尿蛋白>500 mg/天,尿红细胞镜检阳性;②近3个月内接受过手术或造影剂检查;③合并严重心脑血管、血液、免疫系统疾病;④因其他系统疾病引起的继发性AKI。本研究经本院伦理委员会审批通过。共入选174例肝硬化患者,其中男120例,女54例,年龄(52.25±9.62)岁,住院时间(19.74±8.28)天。采用计算公式n=[(Ζα/2)2×P×(1-P)]/δ2对样本量进行验证[5],则应接触样本量为139例,故此次纳入样本量充足(174>139)。参照AKI诊断标准[6]:入院48 h内血清肌酣(serum crea tinine,Scr)较基线升高≥26.5 μmol/L,或7天内Scr升高超过基线值的50%。并根据AKI发生情况对患者进行分组。
1.2 资料收集
通过医院信息系统收集患者临床资料,具体包括性别、年龄、体质指数(body mass index,BMI)、肝硬化病因、肾囊肿、肾结石、消化道出血、细菌感染、腹水、食管胃静脉曲张、谷丙转氨酶、谷草转氨酶、血清白蛋白、血钠和Child-pugh分级。根据Child-pugh分级标准[7]:5~6分为A级,7~9分为B级,≥10分为C级。
1.3 统计学处理
采用SPSS 22.0软件进行数据分析。组间比较采用χ2检验。采用LASSO回归筛选出非零系数的影响因素,采用Logistic回归方程筛选肝硬化并发AKI的危险因素。采用R(R3.5.3)软件包和rms程序包绘制列线图。采用bootstrap自抽样法作内部验证,通过计算C-index、绘制校正曲线、ROC曲线和决策曲线验证模型的风险评估效能。P<0.05为差异有统计学意义。
2 结 果
2.1 肝硬化患者AKI并发情况
174例肝硬化患者中发生AKI 41例,占23.6%,其中肾前性34例(82.9%),肾性5例(12.2%),肾后性2例(4.9%)。
2.2 肝硬化并发AKI的单因素分析
基于AKI发生情况将患者分为AKI组41例和非AKI组133例。两组患者年龄、消化道出血、细菌感染、腹水、血清白蛋白、血钠和Child-pugh分级资料间比较,差异有统计学意义(P<0.05;表1)。
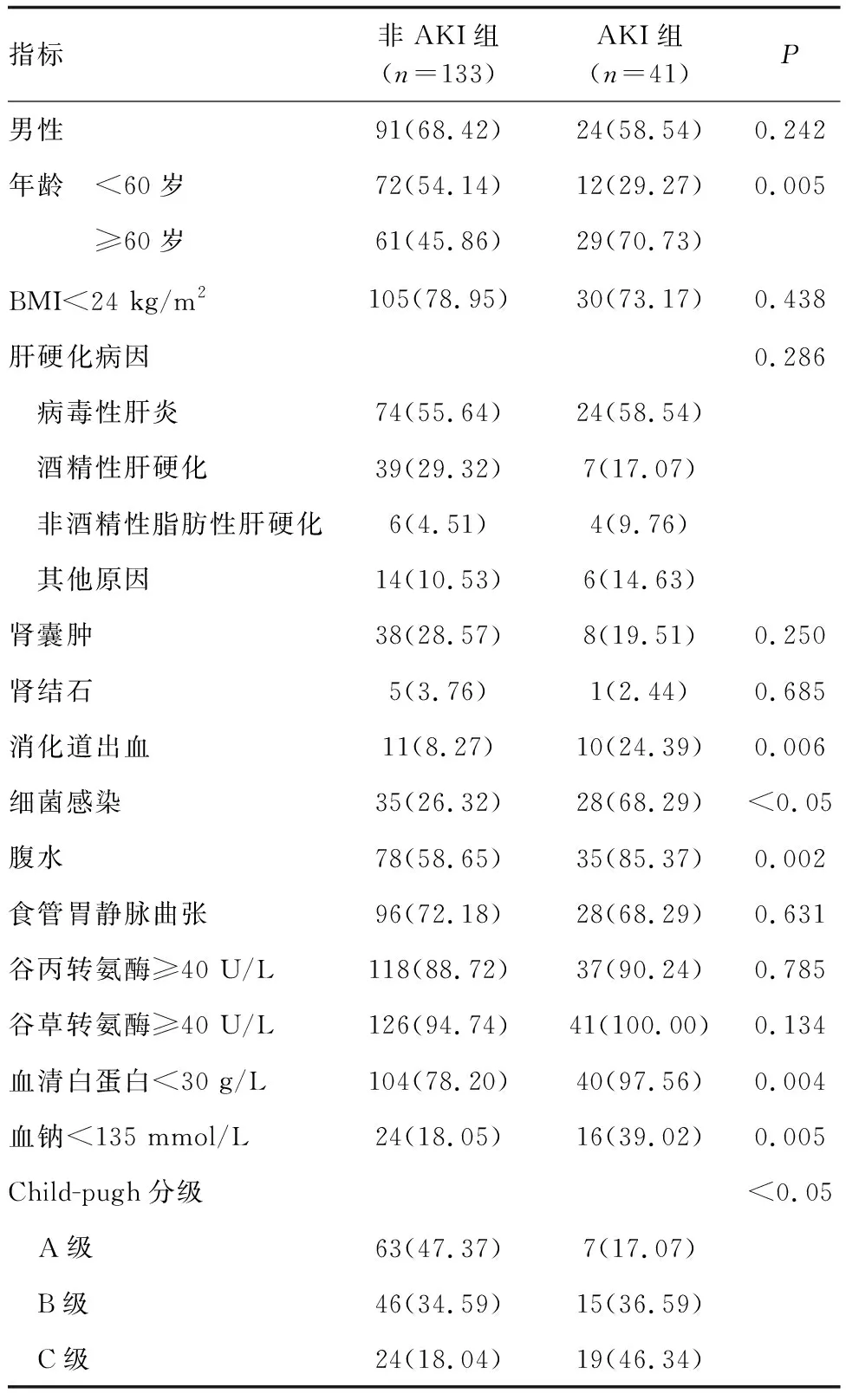
表1 肝硬化并发AKI的单因素分析 例(%)
2.3 肝硬化并发AKI的影响因素筛选
LASSO回归结果显示,年龄、消化道出血、细菌感染、腹水、血清白蛋白、血钠和Child-pugh分级为系数不为零的重要影响因素(图1)。
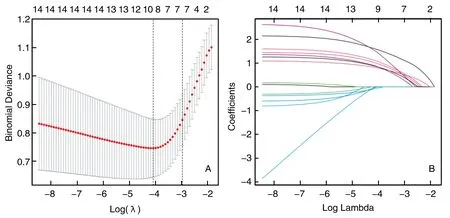
图1 LASSO回归分析筛选影响因素图A为二项式偏差曲线与log(λ)的关系曲线,虚线垂直线显示为最佳λ值;B为14个特征因素的LASSO系数分布。
2.4 肝硬化并发AKI的多因素Logistic回归分析
以AKI发生情况为因变量(发生=1,未发生=0),以LASSO回归中筛出的重要影响因素(年龄≥60岁=1,<60岁=0;消化道出血有=1,无=0;细菌感染有=1,无=0;腹水有=1,无=0;血清白蛋白<30 g/L=1,≥30 g/L=0;血钠<135 mmol/L=1,≥135 mmol/L=0;Child-pugh分级C级=2,B级=1,A级=0)为自变量,进行多因素Logistic回归分析。结果显示,高龄、消化道出血、细菌感染、腹水、低蛋白血症、低钠血症和Child-pugh分级高是肝硬化并发AKI的独立危险因素(P<0.05;表2)。
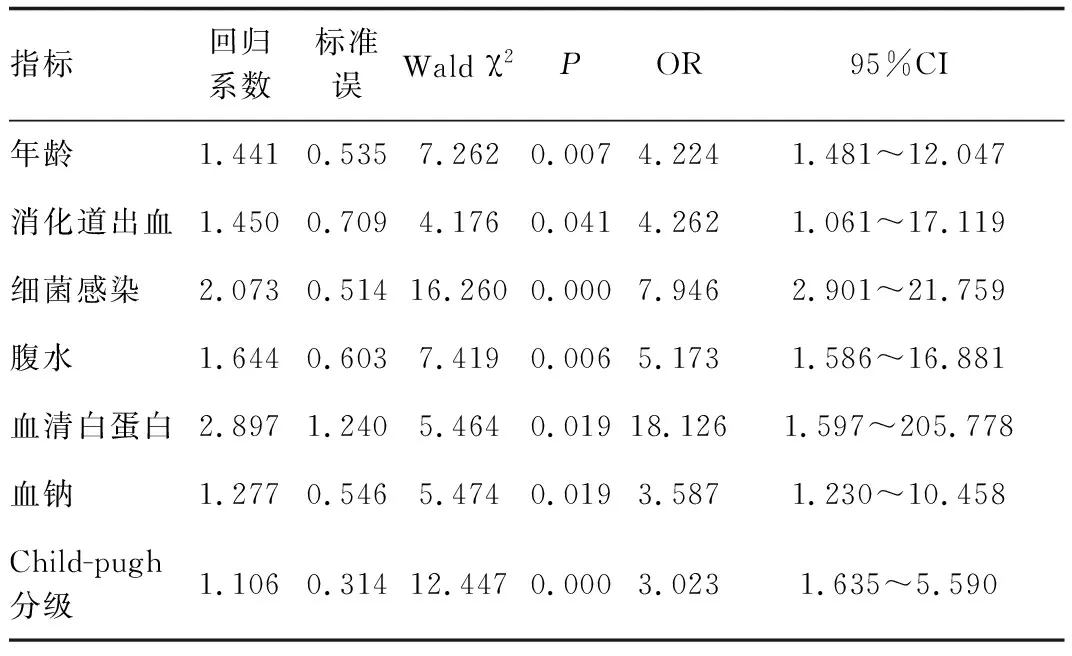
表2 肝硬化并发AKI的多因素Logistic回归分析
2.5 肝硬化并发AKI列线图风险评估模型的建立
基于上述危险因素构建肝硬化并发AKI的列线图风险评估模型,见图2。
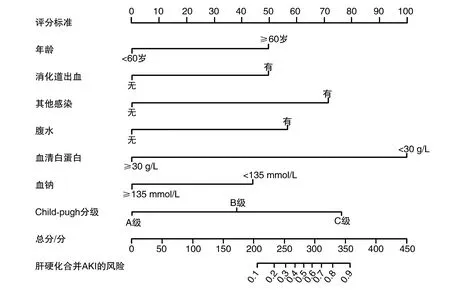
图2 肝硬化并发AKI的列线图风险评估模型
2.6 列线图模型的验证
模型验证结果显示:C-index为0.884;校正曲线趋近于理想曲线(图3A),表明该模型具有良好的评估精度。AUC为0.898(95%CI:0.854~0.933,图3B),表明该模型具有良好的区分度。决策曲线表明,在2%~91%范围内,列线图评估肝硬化并发AKI风险净获益值较高(图3C),表明该模型临床风险评估效能良好。
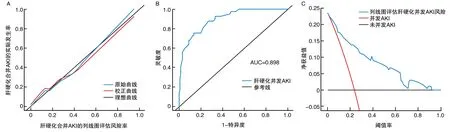
图3 列线图模型的验证A为校正曲线图;B为ROC曲线;C为决策曲线分析图。
3 讨 论
本文结果显示,肝硬化并发AKI的患者占肝硬化患者的23.6%,低于国外报道[8-9],其差异可能与选定的肌酐基线不同有关;但高于国内报道[10];表明肝硬化患者是AKI的高风险人群。
本研究筛选出高龄、消化道出血、细菌感染、腹水、低蛋白血症、低钠血症和Child-pugh分级高是肝硬化并发AKI的独立危险因素。史冬梅等[11]研究显示,老年慢性肝病患者更易发生AKI。分析原因,可能是老年患者应激能力和肾脏储备能力有所下降。Hsieh等[12]研究显示,消化道出血与肝硬化并发AKI密切相关,与本文结果相同;可能是因为消化道出血会加重患者外周血容量不足,导致肾脏缺血受损。Koola等[13]报道,低钠血症是失代偿期肝硬化发生AKI的危险因素。肝硬化患者常由于伴腹水而长期限钠或使用利尿剂,引起低钠血症;而低钠血症反过来又可加重腹水,两者恶性循环进一步降低了肾脏血流量,从而易诱发AKI。肝硬化患者常合并自发性腹膜炎、肺炎等细菌感染,机体产生炎性介质、免疫复合物等可进一步加重肾灌注不足,从而引起肾损伤[14]。文献[15]指出,腹水是急性肾损伤的重要预测因子,与本文观点一致。腹水引起的腹内压升高会对肾血管造成直接压迫,使肾血流量减少,继而可引发肾损害。低蛋白血症诱发AKI的主要原因也是有效循环血流量的不足[16]。刘艺琪等[17]报道,肝硬化并发AKI组的Child-pugh评分显著高于单纯肝硬化组,其机制可能与免疫复合体沉积、肾血流动力学的改变、钠排泄受损等有关。
既往有研究通过决策树模型来评估AKI的发生风险[18],且整体精准度达到了86.0%,但此模型无法输出每例患者的评估风险值。刘强等[19]虽然以代数方程的形式构建了能够个体化预测AKI的模型,但在临床实操中需要繁琐的数学运算,实用价值有限。本研究构建的列线图模型不仅达到了个体化预测的目标,而且直观明了,使用快速简洁,可供临床直接使用,实用价值较高。本研究通过计算C-index,绘制校正曲线、ROC曲线和决策曲线多种验证方式对模型进行系统性验证,证明了模型具有良好的风险评估能力。
综上所述,临床对高龄、消化道出血、细菌感染、腹水、低蛋白血症、低钠血症和Child-pugh分级高的肝硬化患者应高度警惕其发生AKI。根据危险因素建立的列线图模型对肝硬化并发AKI的风险具有一定的评估价值,有助于临床及早筛查AKI高风险的患者并采取干预措施。
