溪黄草对circ_0091579/miR-515-5p、肺癌细胞A549增殖及凋亡的影响
2023-11-10何苗姚文秀谷涉群
何苗, 姚文秀, 谷涉群
1.绵阳市第三人民医院 四川省精神卫生中心健康管理中心,四川绵阳 621000;2.四川省肿瘤医院胸部肿瘤内科,四川成都 610041;3.郴州市第一人民医院肿瘤内科,湖南郴州 423099
中药溪黄草在肝癌、结肠癌的发生或进展方面具有抑制作用[1-2]。研究表明,环状RNA(circular RNA,circRNA)和微RNA(microRNA,miRNA)表达失调与癌症启动、进展关系密切,靶向circRNA和miRNA治疗可能是阻止癌症发生发展的有效措施[3]。circ_0091579在肝细胞癌(hepatocellular carcinoma,HCC)患者中显著上调,下调circ_0091579表达可显著抑制HCC细胞增殖和转移能力[4]。miR-515-5p介导沉默LINC00519对肺癌细胞增殖、迁移和肿瘤生长的抑制作用[5]。本研究探讨溪黄草对肺癌细胞增殖和凋亡的影响及其具体机制。
1 材料和方法
1.1 材料
肺癌A549细胞购自美国ATCC公司;溪黄草生药饮片由本院中药房提供;Lipofectamine® 2000购自美国Invitrogen公司;重组荧光素酶载体、si-circ_0091579(5′-AGUCAUGUCGAUGUCGUACUU-3′)、si-NC、pcDNA-circ_0091579、pcDNA购自上海生工技术公司;CCK-8、GAPDH兔多抗(ab9485)、山羊抗兔IgG二抗(ab205718)、裂解的Caspase-3(cleaved-Caspase-3)兔多抗(ab2302)购自上海艾博抗贸易公司;膜联蛋白V-异硫氰酸荧光素(Annexin V/FITC)凋亡检测试剂盒、TRIzol试剂购自北京索莱宝生物公司。Multiskan SkyHigh全波长酶标仪购自美国ThermoFisher公司;CytoFLEX流式细胞仪购自BeckmanCoulter公司;荧光定量PCR仪购自美国ABI stepone公司;电转仪、琼脂糖凝胶电泳装置购自北京六一仪器厂。
1.2 溪黄草乙醇提取物的制备
参照文献[2]制备溪黄草乙醇提取物,将溪黄草饮片粉碎,75%乙醇提取1 h,共3次,过滤,合并滤液,回收乙醇,浓缩至稠膏,冷冻干燥,得到干粉。磷酸盐缓冲液(PBS)将干粉配制成10 g/L的贮存液,过微孔滤膜(0.22 μm)除菌,4 ℃保存备用。
1.3 A549细胞培养和分组
将A549细胞于含5%二氧化碳DMEM培养液、37 ℃培养箱中孵育。采用Lipofectamine 2000进行转染si-circ_0091579(si-circ_0091579组)、si-NC(si-NC组)、pcDNA(pcDNA组)、pcDNA-circ_0091579(pcDNA-circ_0091579组)到A549细胞中。收集转染48 h A549细胞,qRT-PCR检测circ_0091579表达水平。分别用含0、20、40、80 mg/L溪黄草的培养液孵育A549细胞,记为对照组、溪黄草20 mg/L组、溪黄草40 mg/L组、溪黄草80 mg/L组。用含80 mg/L溪黄草的培养液孵育转染pcDNA-circ_0091579的A549细胞,记为溪黄草+pcDNA-circ_0091579组,并使用含80 mg/L溪黄草的培养液孵育细胞作为对照,记为溪黄草组。
1.4 CCK-8检测细胞增殖
将对照组、si-circ_0091579组、si-NC组、pcDNA-circ_0091579组的细胞按5×103个/孔接种于96孔板,按照各组给与对应质量浓度溪黄草的培养液,孵育48 h后,每孔加入10 μL CCK-8溶液在37 ℃下孵育2 h。酶标仪检测450 nm处光密度(optical density,OD)值。抑制率(%)=(1-实验组OD值/对照组OD值)×100%。
1.5 平板克隆实验检测细胞克隆形成数
将各组A549细胞以5×102个/孔接种到6孔板,每周换液2~3次,持续培养2周。细胞克隆用甲醇固定15 min,0.1%结晶紫溶液染色20 min,PBS洗去多余染色液,自然晾干,倒置显微镜下计数细胞克隆形成数。
1.6 流式细胞仪检测细胞凋亡率
各组A549细胞PBS洗涤2次,向约1×105个细胞中加入500 μL结合缓冲液,随后加入Annexin V/FITC和碘化丙啶避光染色15 min。采用流式细胞术检测细胞凋亡。
1.7 Western blotting检测cleaved-Caspase-3蛋白表达
RIPA裂解法从各组细胞样品中提取总蛋白。定量后,将蛋白与上样缓冲液混匀,100 ℃煮沸5 min。取30 μg蛋白样品行SDS-PAGE,随后湿法转移蛋白至聚偏氟乙烯膜上。5%脱脂牛奶室温下封闭膜1 h,加入cleaved-Caspase-3兔多抗(1∶1 000)4 ℃下孵育过夜。GAPDH兔多抗(1∶1 000)作为内参。加入山羊抗兔IgG二抗孵育膜1 h。用增强化学发光试剂盒显色,凝胶成像仪下拍照。采用Quantity One v4.6.2软件对cleaved-Caspase-3条带灰度值定量分析。
1.8 qRT-PCR检测circ_0091579、miR-515-5p表达
TRIzol试剂提取各组A549细胞总RNA。用反转录试剂盒合成cDNA,将生成的cDNA与SYBR green master mix、特异性引物混合,然后进行qRT-PCR。circ_0091579上游5′-TGAGCCAGTGGTCA GTCAAA-3′,下游5′-GTGGAGTCAGGCTTGGGTAG-3′;GAPDH上游5′-TGAATGGGCAGCCGTTAGG-3′,下游5′-TGGACTCCACGACGTACTCA-3′;miR-515-5p上游5′-CGGGTTCTCCAAAAGAAAGCA-3′,下游5′-CAGCCACAAAAGAGCACAAT-3′;U6上游5′-CTCGCTTCGGCAGCACA-3′,下游5′-AACGCTTCAC GAATTTGCGT-3′。RNA、蛋白检测分别以U6和GAPDH为内参,2-ΔΔCt法计算其相对表达量。
1.9 双荧光素酶报告实验
circular RNA interactome预测circ_0091579、miR-515-5p之间的靶向关系。将含有miR-515-5p结合位点的circ_0091579片段克隆到pmirGLO载体,构建野生型(wild type,WT)重组载体WT-circ_0091579、突变型(mutant,MUT)重组载体MUT-circ_0091579。Lipofectamine 2000将WT-circ_0091579载体、MUT-circ_0091579载体分别与miR-515-5p mimic或miR-NC共转染到A549细胞中,采用双荧光素酶报告基因检测系统分析转染48 h荧光素酶活性。
1.10 统计学方法
采用SPSS 21.0软件分析。两组比较采用独立样本t检验,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 溪黄草对A549细胞circ_0091579、miR-515-5p表达及细胞增殖和凋亡的影响
与对照组比较,各溪黄草(20、40、80 mg/L)组A549细胞circ_0091579水平、细胞克隆形成数降低(P<0.05),miR-515-5p、cleaved-Caspase-3蛋白表达水平、细胞抑制率、凋亡率显著升高,且呈质量浓度依赖性(P<0.05;图1、表1)。
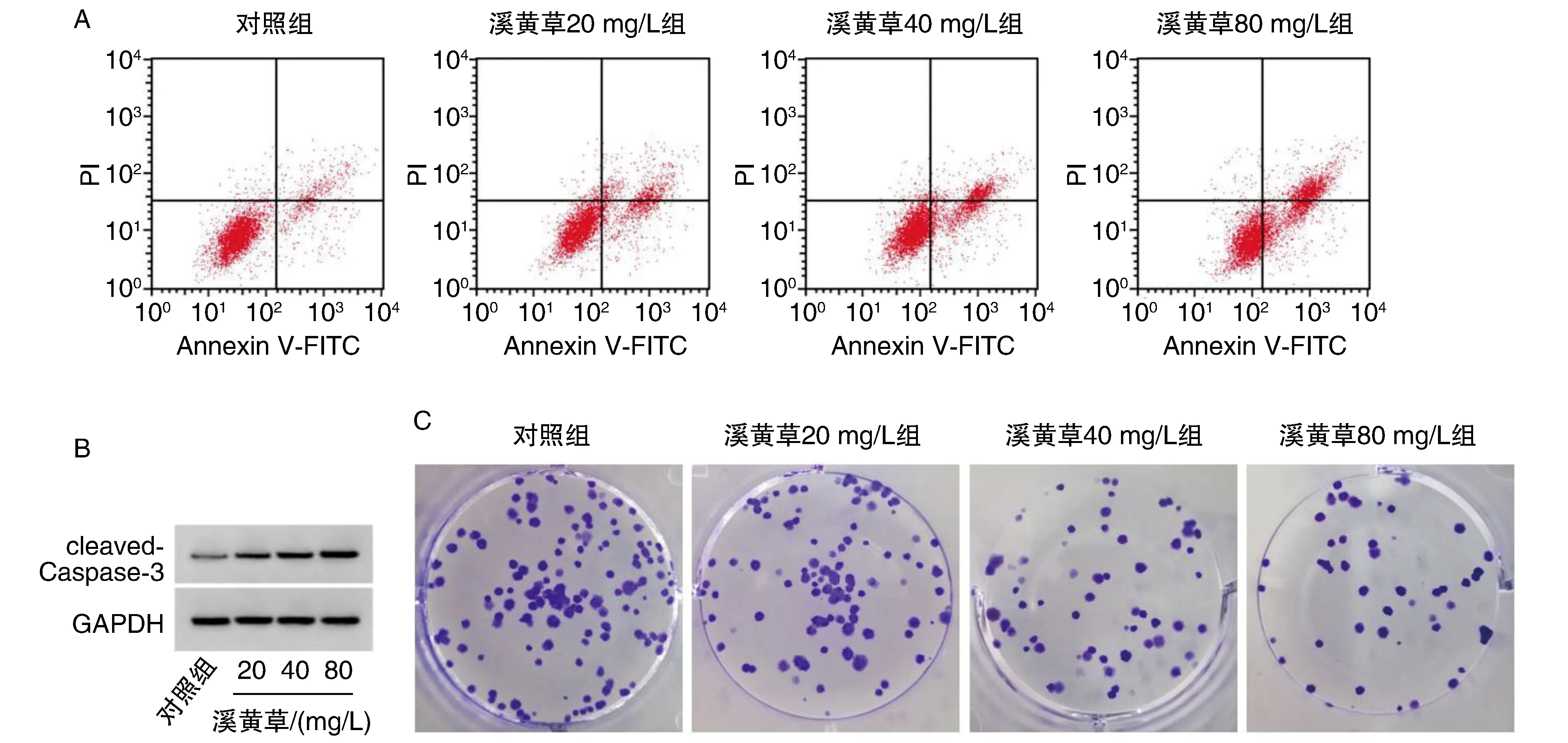
图1 溪黄草对A549细胞增殖及凋亡的影响A为溪黄草诱导A549凋亡;B为cleaved-Caspase-3蛋白表达;C为显微镜下克隆细胞(结晶紫染色)。
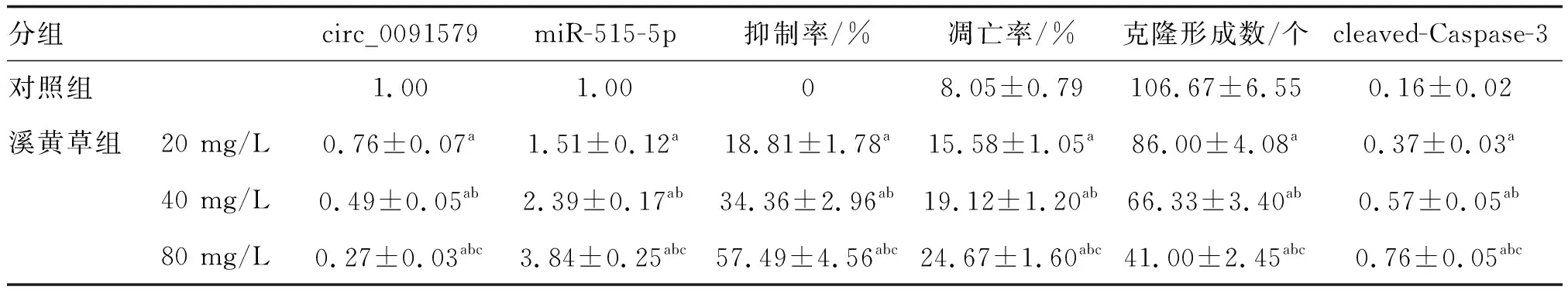
表1 溪黄草对A549细胞circ_0091579、miR-515-5p表达及细胞增殖和凋亡的影响
2.2 下调circ_0091579对A549增殖和凋亡的影响
下调circ_0091579表达可降低A549细胞的克隆形成数,促进细胞凋亡,诱导cleaved-Caspase-3蛋白表达水平上调(P<0.05;图2、表2)。

图2 下调circ_0091579对A549细胞增殖和凋亡的影响A为A549细胞凋亡;B为cleaved-Caspase-3蛋白表达;C为显微镜下克隆细胞(结晶紫染色)。
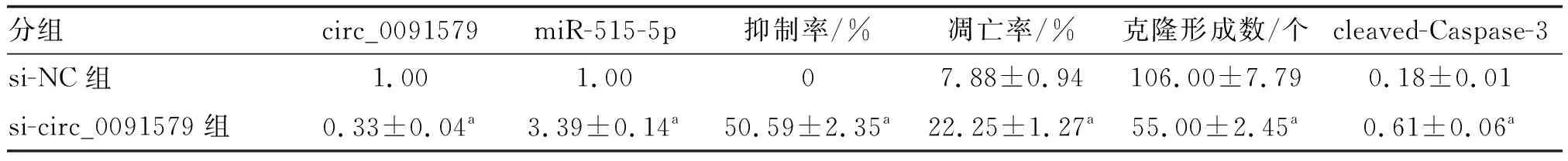
表2 下调circ_0091579对A549细胞增殖和凋亡的影响
2.3 上调circ_0091579逆转溪黄草对A549细胞增殖和凋亡的影响
与对照组比较,溪黄草组A549细胞抑制率、凋亡率、cleaved-Caspase-3蛋白表达、miR-515-5p相对水平显著升高(P<0.05),克隆形成数、circ_0091579相对水平显著减少(P<0.05);与溪黄草组比较,溪黄草+pcDNA-circ_0091579组A549细胞上述指标逆转(P<0.05;图3、表3)。
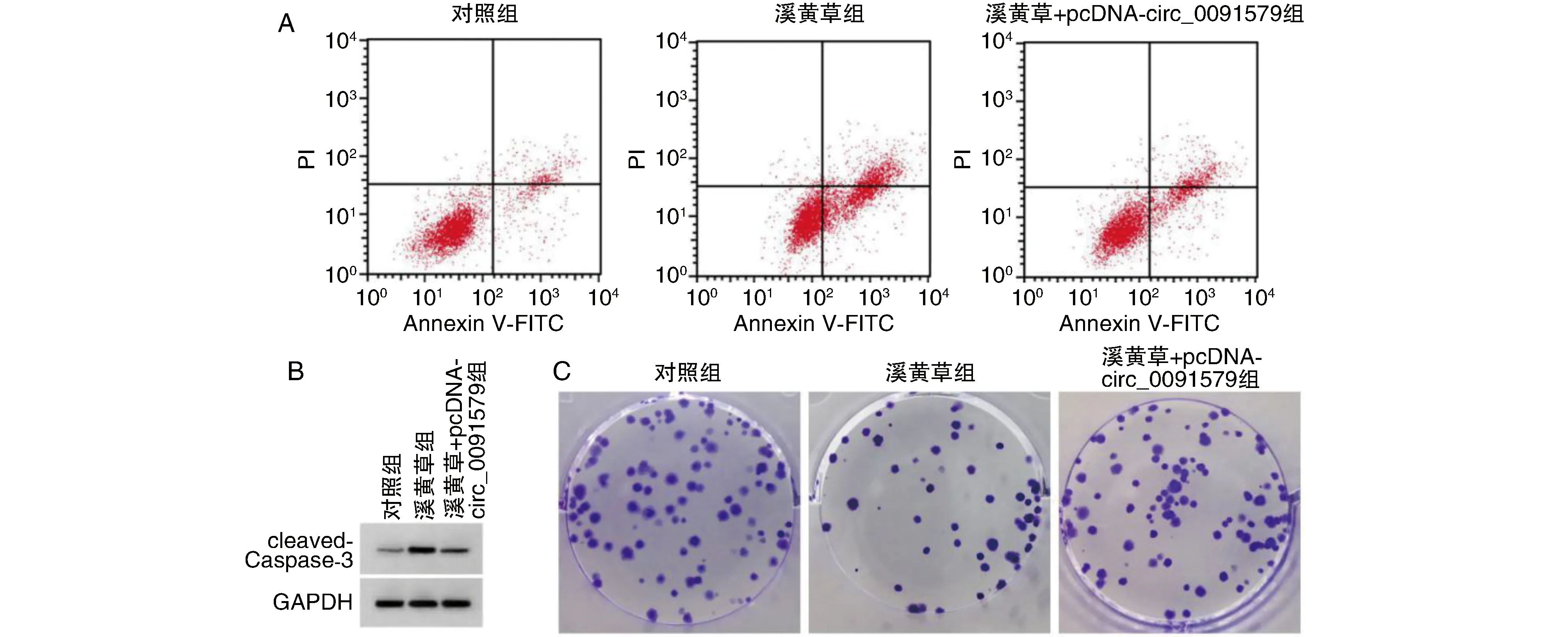
图3 上调circ_0091579可逆转溪黄草对A549细胞增殖和凋亡的影响A为A549细胞凋亡;B为cleaved-Caspase-3蛋白表达;C为显微镜下克隆细胞(结晶紫染色)。
表3 上调circ_0091579可逆转溪黄草对A549细胞增殖和凋亡的作用
2.4 circ_0091579靶向调控miR-515-5p表达
circ_0091579和miR-515-5p存在互补位点(图4A)。与miR-NC组比较,miR-515-5p组WT-circ_0091579相对荧光素酶活性显著下降(P<0.05;图4B)。si-circ_0091579组A549细胞miR-515-5p相对水平高于si-NC组(P<0.05);pcDNA-circ_0091579组A549细胞miR-515-5p相对水平低于pcDNA组(P<0.05;图4C)。
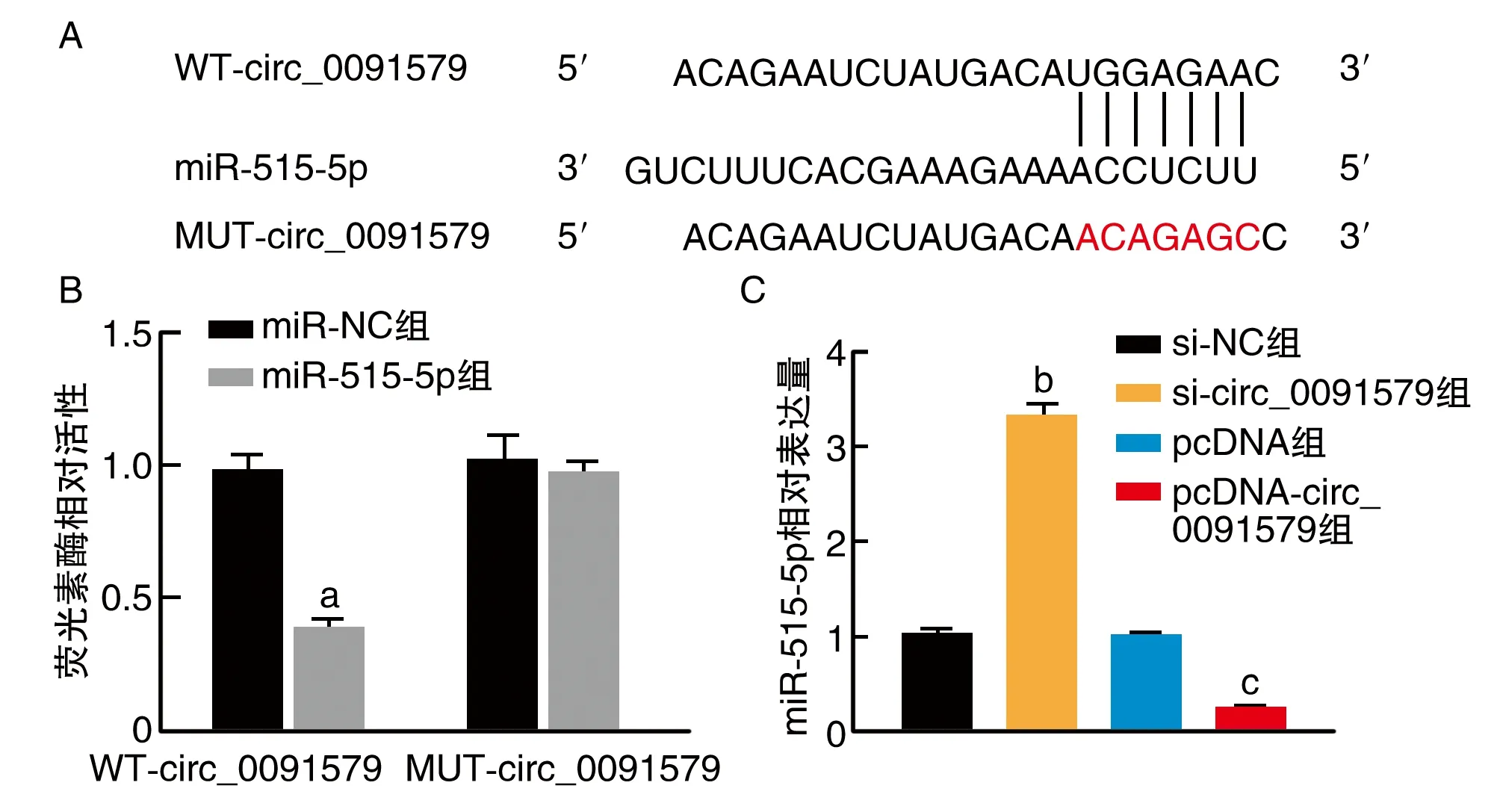
图4 circ_0091579靶向调控miR-515-5p表达A为circ_0091579和miR-515-5p的互补序列;B为双荧光素酶报告实验;C为circ_0091579调控miR-515-5p的表达。a为P<0.05,与miR-NC组比较;b为P<0.05,与si-NC组比较;c为P<0.05,与pcDNA组比较。
3 讨 论
近年来肺癌的发病率和病死率明显上升,其常用治疗手段存在较大的不良反应,严重影响患者生活质量[6]。中药具有成本低、毒副作用小、耐药概率低,其优势极大弥补现有肿瘤治疗药物的不足,是抗肿瘤药物研发的热点。本研究结果显示,溪黄草显著降低A549细胞的增殖和克隆形成能力,诱导cleaved-Caspase-3表达上调,促进细胞凋亡,且具有一定的质量浓度依赖性,这与前人[7]报道溪黄草的体外抗肿瘤活性一致,但其抗肿瘤机制尚不清楚。
研究发现,circRNA、miRNA与天然植物提取物的抗癌作用密切相关,circRNA、miRNA可能作为致癌因子或抑癌因子参与其中[8]。本研究中,经溪黄草处理后,A549细胞中circ_0091579表达降低,miR-515-5p表达增加。circ_0091579靶向miR-515-5p。研究发现,HCC中circ_0091579高表达具有致癌作用,下调circ_0091579可抑制体内移植瘤生长,抑制HCC细胞的增殖、瓦博格效应、迁移和侵袭,诱导细胞凋亡[9]。本研究结果显示,下调circ_0091579表达可降低A549细胞的增殖和克隆形成能力,促进细胞凋亡,诱导cleaved-Caspase-3表达上调,证实circ_0091579在肺癌中的致癌作用。miR-515-5p曾被报道可抑制多种肿瘤进展,多种非编码RNA的下游靶点在肺癌中发挥抑癌功能[10-13]。本研究结果提示溪黄草可能通过调控circ_0091579/miR-515-5p通路发挥抗癌功能。上调circ_0091579逆转了溪黄草对A549细胞的增殖抑制和凋亡促进功能,进一步证实溪黄草通过调控circ_0091579/miR-515-5p通路在肺癌中发挥抗肿瘤活性。
综上所述,溪黄草可抑制肺癌细胞A549增殖,诱导凋亡,其机制与下调circ_0091579/miR-515-5p途径有关,为肺癌防治提供了新的理论基础和治疗靶点。
