SNHG6靶向miR-101/TGFBR1促进AMI小鼠左心室心肌纤维化
2023-11-10张梦伟赵忠帅杨林王明杨雪飞王倩
张梦伟, 赵忠帅, 杨林, 王明, 杨雪飞, 王倩
1.山东大学齐鲁医院德州医院心脏康复医学科,山东德州 253000;2.德州市立医院老年医学科,山东德州 253000
急性心肌梗死(acute myocardial infarction,AMI)由心肌组织持续严重缺血引起的急性坏死,是全球主要的致命性疾病之一[1-2]。尽管过去十年来治疗策略有所改进,但AMI仍具有高致死率及多种并发症[3]。因此,寻找诊断、治疗急性心肌梗死的新方法迫在眉睫。
长链非编码RNA(long non-coding RNA,lncRNA)是一类不具备编码蛋白功能的RNA,其长度超过200个核苷酸[4]。越来越多的证据表明,心肌缺血再灌注损伤中,lncRNA起着重要作用[5-6]。其中SNHG6作为一种新型lncRNA[7-8],在急性心肌梗死中的作用尚未被阐明,本研究旨在通过构建AMI小鼠模型,深入探究lncRNA SNHG6在急性心肌梗死中的作用机制。
1 材料和方法
1.1 主要试剂与仪器
雄性C57/BL6小鼠购自赛业生物公司;CD31抗体、Col1α1抗体、Nppa抗体、辣根过氧化物酶标记的兔二抗、TGFBR1抗体、GAPDH抗体均购于美国Abcam公司;所有引物合成购于擎科生物公司;ECL化学发光底物购于Bio-Rad公司;H9C2细胞购于普拉特泽生物公司;DAB显色液购于迈新生物公司;苏木精染色液、丽春红酸性复红液、天狼星红染色液、RIPA裂解液和PBS缓冲液均购于赛维尔生物公司。
1.2 AMI小鼠模型的构建及分组
雄性C57/BL6小鼠36只,4~8周,体质量(18.42±2.53)g,随机选取30只造模成功的AMI小鼠,均分为AMI组、AMI+SNHG6组、AMI+miR-101-3p组、AMI+SNHG6+miR-101-3p组、AMI+miR-101-3p+TGFBR1组,另选6只小鼠为假手术组。30只造模小鼠用2%水合氯醛(100 mg/kg)腹腔注射麻醉,胸骨左缘第2~4肋开胸,识别前降支走行范围,7/0滑线结扎左前降支,结扎区域颜色变为苍白,并且心电图提示心肌梗死表现时则认定AMI小鼠造模成功。假手术组开胸但不结扎左冠状动脉,其他步骤同造模小鼠。AMI造模结束后,AMI+SNHG6组、AMI+miR-101-3p组、AMI+SNHG6+miR-101-3p组、AMI+miR-101-3p+TGFBR1组小鼠尾静脉分别注射SNHG6、miR-101-3p、SNHG6+miR-101-3p、miR-101-3p+TGFBR1质粒,每周2次,连续4周,假手术组、AMI组尾静脉注射等量生理盐水。
1.3 AMI小鼠模型心脏功能检测
末次处理24 h后,取各组6只小鼠麻醉,采用心脏彩超检查各组小鼠左室射血分数(left ventricular ejection fraction,LVEF)。
1.4 RNA提取及实时定量聚合酶链式反应
TRIzol提取小鼠组织总RNA,紫外分光光度法测定RNA含量,琼脂糖凝胶电泳检测其完整性。利用反转录酶合成cDNA,并以cDNA为模板按照说明书进行qRT-PCR扩增。SNHG6引物序列F为5′-TTGAGGTGAAGGTGTATG-3′,R为5′-GGTAACGAAGCAGAAGTA-3′;TGFBR1引物序列F为5′-ACGGCGTTACAGTGTTTCTG-3′,R为5′-GCACATACAAACGGCCTATCTC-3′;GAPDH引物序列F为5′-GATATTGTTGCCATCAATGAC-3′,R为5′-TTGATTTTGGAGGGATCTCG-3′;miR-101-3p引物序列F为5′-ACGGGCGAGCTACAGTACTGTG-3′,R为5′-CCAGTGCAGGGTCCGAGGTA-3′;U6引物序列F为5′-CGCTTCGGCAGCACATATAC-3′,R为5′-TTCACGAATTTGCGTGTCAT-3′。PCR反应条件95 ℃ 2 min,95 ℃ 15 s,60 ℃ 20 s,72 ℃ 20 s,共40个循环。分别以GAPDH、U6为SNHG6、miR-101-3p的内参计算相对表达量。
1.5 马松染色
心功能检测后将小鼠麻醉处死,迅速取出心脏,切取小鼠心肌组织,石蜡切片脱蜡至水,用苏木精染液染核10 min,充分水洗后用盐酸酒精分化,再蒸馏水洗。用丽春红酸性复红液10 min。1%磷钼酸水溶液分化5 min,甩掉磷钼酸后直接用苯胺蓝染5 min,再依次用95%乙醇、无水乙醇、二甲苯透明、中性树胶封固。
1.6 天狼星红染色
小鼠心肌组织石蜡切片脱蜡水化,天狼星红染色液染色10 min,稍微冲洗后用苏木精染色液染色8 min,流水冲洗10 min。常规梯度乙醇进行脱水,二甲苯透明,中性树胶封片。
1.7 免疫组化染色
石蜡切片脱蜡入水,微波加热法修复抗原,94 ℃,10~15 min,加入5%正常羊血清封闭,室温孵育15 min;随后添加一抗CD31抗体(1∶100)、Col1α1抗体(1∶100)、Nppa抗体(1∶100),4 ℃孵化过夜。加入辣根过氧化物酶标记的兔二抗(1∶200),37 ℃孵育30 min。滴加辣根酶标记链霉卵白素工作液,37 ℃孵育30 min。DAB显色后,苏木精复染2 min,脱水,封片,正置显微镜观察切片。
1.8 细胞培养和分组
37 ℃、5%CO2条件下用10%胎牛血清、100 U/mL青霉素和100 mg/L链霉素的DMEM培养基培养H9C2细胞株。转染前24 h将生长状态良好的细胞按5×105个/孔接种于6孔板,随机分为阴性对照组(NC组)、SNHG6组、miR-101-3p组,通过LipofectamineTM2000介导分别转染质粒SNHG6、miR-101-3p至SNHG6组、miR-101-3p组,阴性对照组转染空质粒。
1.9 Western blotting
采用RIPA裂解液提取细胞蛋白,遵照BCA法测定蛋白水平,加入缓冲液后变性蛋白。每泳道加入50 μg蛋白,用12% SDS-PAGE电泳分离蛋白,然后将蛋白转到PVDF膜上,5%脱脂奶粉37 ℃封闭1 h,分别加入TGFBR1(1∶500)及兔抗GAPDH抗体(1∶1 000)的抗体稀释液中4 ℃过夜,TBST洗3次,每次10 min,再放入辣根酶标记山羊抗兔的二抗中室温孵育1 h,TBST洗3次,ECL液暗室发光显影,采集图像并分析。
1.10 双荧光素酶报告基因实验
构建SNHG6/TGFBR1的野生型(wild type,wt)和突变型(mutant,mut)质粒。分别提取SNHG6/TGFBR1-wt和SNHG6/TGFBR1-mut质粒,与miR-101-3p mimic共同转染H9C2细胞。转染48 h后,倒掉细胞培养液,PBS清洗,加入20 μL细胞裂解液裂解细胞,然后上机检测荧光素酶活性。
1.11 统计学方法
采用SPSS 22.0统计软件进行分析。两组数据间比较采用t检验,多组间比较采用one-way ANOVA。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠血清SNHG6和miR-101-3p表达水平的比较
AMI小鼠较假手术小鼠血清SNHG6表达水平显著升高[(1.67±0.12)比(1.00±0.09),P<0.05],而miR-101-3p表达水平降低[(0.47±0.04)比(1.00±0.11),P<0.05]。
2.2 各组小鼠LVEF比较
与AMI组小鼠比较,AMI+SNHG6组小鼠LVEF降低(P<0.05),AMI+miR-101-3p组小鼠LVEF升高(P<0.05);与AMI+SNHG6组比较,AMI+SNHG6+miR-101-3p组LVEF升高(P<0.05);与AMI+miR-101-3p组比较,AMI+miR-101-3p+TGFBR1组LVEF降低(P<0.05;图1)。
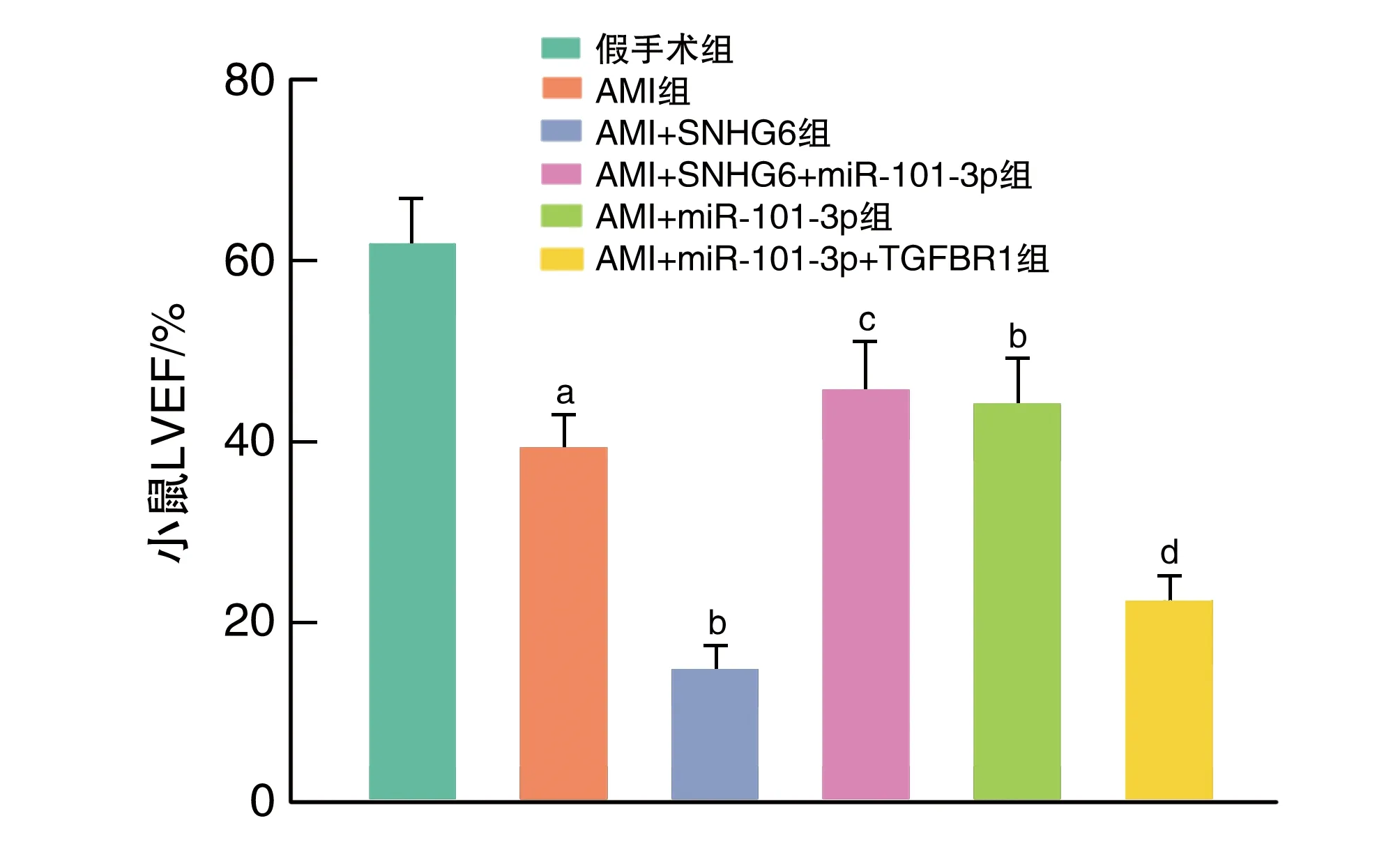
图1 各组小鼠LVEF比较a为P<0.05,与假手术组比较;b为P<0.05,与AMI组比较;c为P<0.05,与AMI+SNHG6组比较;d为P<0.05,与AMI+miR-101-3p组比较。
2.3 各组小鼠心肌纤维化程度比较
与假手术组比较,AMI组小鼠心肌纤维化加重,CD31抗体、Col1α1抗体及Nppa抗体阳性信号增加;与AMI组比较,AMI+SNHG6组纤维化程度加重及以上抗体阳性信号增加,AMI+miR-101-3p组纤维化程度减轻及以上抗体阳性信号减少;与AMI+SNHG6组比较,AMI+SNHG6+miR-101-3p组心肌纤维化程度减轻及以上抗体阳性信号减少;与AMI+miR-101-3p组比较,AMI+miR-101-3p+TGFBR1组小鼠心肌纤维化程度加重及以上抗体阳性信号增加(图2)。
2.4 SNHG6抑制miR-101-3p上调TGFBR1表达
Western blotting结果显示,与NC组比较,SNHG6组TGFBR1蛋白表达明显升高,miR-101-3p组TGFBR1蛋白表达降低(P<0.05;图3)。
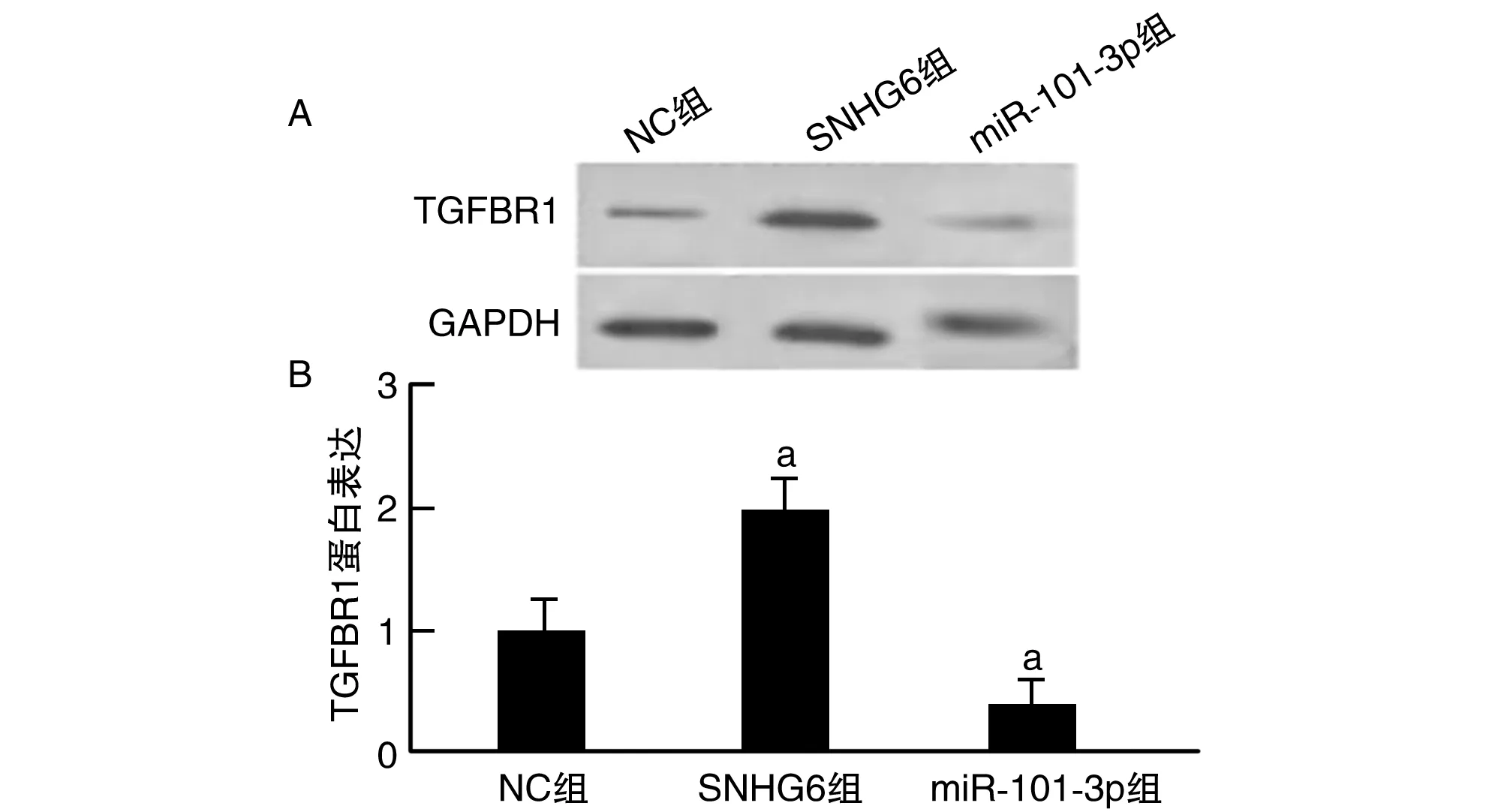
图3 SNHG6抑制miR-101-3p上调TGFBR1表达a为P<0.05,与NC组比较。
2.5 预测并验证SNHG6/miR-101-3p/TGFBR1调控关系
TargetScan预测结果显示,SNHG6的3′-UTR存在miR-101-3p的结合位点,而miR-101-3p与TGFBR1也具有潜在的靶向结合关系(图4A)。双荧光素酶报告基因实验显示,miR-101-3p组SNHG6-wt、TGFBR1-wt质粒荧光素酶活性较NC组明显降低(P<0.05),但对SNHG6-mut、TGFBR1-mut荧光素酶活性均无明显影响(P>0.05;图4B)。

图4 SNHG6靶向调控miR-101-3p/TGFBR1轴A为生物信息软件预测SNHG6/miR-101-3p/TGFBR1结合点位;B为双荧光素酶报告实验。a为P<0.05,与NC组比较。
3 讨 论
随着医学的发展,急性心肌梗死诊断和治疗均有了明显提升[9],但其仍是中国病例死亡、残疾的主要原因之一[10]。研究发现,急性心肌梗死发病机制主要为心室重构,因此如何减缓急性心肌梗死后心室重构成为了近十年研究的热点[11]。
近年来,lncRNA在心血管领域中的作用引起了广泛的关注,SNHG6在慢性心血管疾病中发挥重要作用,SNHG6在动脉粥样硬化中通过miR-135 a-5p/Rock调节氧化型低密度脂蛋白诱导内皮细胞损伤[12];但SNHG6在AMI中的确切机制尚不清楚。本研究首先构建了AMI小鼠模型,发现AMI小鼠较假手术小鼠血清中SNHG6表达显著增加,提示SNHG6可能参与AMI的发生发展。
lncRNA影响内源性微RNA(microRNA,miRNA)的表观遗传修饰,进而影响miRNA的靶基因发挥相关生物学功能[13-15]。因此为了探究lncRNA SNHG6在AMI中的作用机制,本文预测并验证miR-101-3p是SNHG6的靶向miRNA,TGFBR1是miR-101-3p的靶基因;提示SNHG6可作为竞争性内源RNA(competing endogenous RNA,ceRNA),与miR-101-3p结合,减弱miR-101-3p对TGFBR1的调控作用。
本文结果显示,与AMI组小鼠比较,AMI+SNHG6组小鼠LVEF下降,而加入miR-101-3p后,回补了SNHG6对LVEF的表达水平;同时AMI+SNHG6组AMI小鼠中Nppa抗体的表达水平明显升高,提示SNHG6可促进AMI小鼠LVEF进一步降低,从而促进心肌梗死的发展,而过表达miR-101-3p可使AMI小鼠心肌梗死好转、心功能提升。随后采用马松和天狼星红染色及免疫组化实验,也验证了这一结果。本研究结果显示,miR-101-3p显著抑制AMI组小鼠心肌纤维化,而TGFBR1逆转了miR-101-3p的抑制效果,提示在AMI小鼠模型中,SNHG6可竞争性吸附miR-101-3p上调TGFBR1表达,从而促进小鼠心肌纤维化程度加重。
综上,本研究阐述了SNHG6作为ceRNA,竞争性吸附miR-101-3p上调TGFBR1导致AMI小鼠左心室心肌纤维化增加,心肌梗死程度加重,SNHG6未来可能会成为AMI诊断及治疗的新靶点。
