miR-451a对慢性心衰细胞模型心肌细胞H9c2凋亡与自噬的影响
2023-11-10朱继荣杨波张博媛
朱继荣, 杨波, 张博媛
深圳市第二人民医院心内科,广东深圳 518000
慢性心力衰竭简称慢性心衰,主要因为心肌梗死、心肌病、血流动力学负荷过重等引起的心肌损伤[1]。心肌损伤机制复杂多样,心肌细胞凋亡、自噬在慢性心衰发展过程中具有重要作用[2]。微小RNA(microRNA,miRNA)在人体不同组织、不同病理或生理过程中表达不同。miRNA异常表达与心肌细胞损伤有关,通过调控相关信号通路参与疾病的发展[3]。研究发现,慢性心衰患者血清miR-451a低表达与患者分级有关[4],但是对慢性心衰细胞模型的研究尚不清楚。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路在心肌细胞损伤中激活能力降低,因此,抑制mTOR信号通路可促进心肌细胞凋亡和自噬[5-6]。本研究通过构建慢性心衰细胞模型,探究miR-451a对心肌细胞凋亡和自噬的影响,以及可能相关的信号通路。
1 材料和方法
1.1 细胞和主要试剂
大鼠心肌细胞H9c2购自中国科学院上海细胞库;DMEM培养基、胎牛血清购自美国Gibco公司;阿霉素(doxorubicin,DOX)、CCK-8试剂盒购自北京索莱宝科技有限公司;Lipofectamine 2000试剂盒购自赛默飞世尔公司;miR-NC、miR-451a、引物由广州锐博公司设计合成;TRIzol试剂盒、miScript逆转录试剂盒、荧光定量试剂盒购自日本TaKaRa公司;mTOR通路抑制剂CCI-779购自美国Houston公司;凋亡试剂盒购自碧云天生物公司;剪切的Caspase-3(cleaved-Caspase-3)抗体、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体、Beclin-1抗体、微管相关蛋白1轻链3Ⅰ(LC3I)抗体、LC3II抗体、磷酸化mTOR(p-mTOR)抗体、mTOR抗体、p-p70s6k抗体、p70s6k抗体购自美国Abcam公司。
1.2 细胞培养和模型建立
心肌细胞H9c2用DMEM培养基进行孵育,将细胞置于37 ℃、5% CO2恒温培养箱中。细胞融合超过80%,使用胰蛋白酶消化培养。
取对数期心肌细胞H9c2,胰酶消化处理后,接种至96孔板,在恒温培养箱中培养24 h后,弃培养基更换新鲜培养基,将细胞分为Control组、DOX组、DOX+miR-NC组、DOX+miR-451a组、DOX+miR-451a+CCI-779组。Control组为正常心肌细胞H9c2;DOX组采用1 μmol/L DOX处理细胞24 h,参照文献[7]建立慢性心衰细胞模型;DOX+miR-NC组、DOX+miR-451a组为成功转染miR-NC、miR-451a 6 h后,更换新鲜培养基用1 μmol/L DOX处理细胞24 h;DOX+miR-451a+CCI-779组成功转染miR-451a 6 h后,更换新鲜培养基用1 μmol/L DOX和mTOR通路抑制剂CCI-779处理细胞24 h。细胞转染时参照Lipofectamine 2000试剂盒说明书。
1.3 qRT-PCR检测miR-451a相对表达水平
取Control组、DOX组、DOX+miR-NC组、DOX+miR-451a组心肌细胞H9c2按照TRIzol法提取细胞总RNA,分光光度计检测RNA水平,以miScript逆转录试剂盒进行反转录合成cDNA模板,配置荧光定量反应体系进行PCR反应。2-ΔΔCt方法检测miR-451a相对表达水平,U6作为内参基因。miR-451a上游引物;5′-ACACTCCAGCTGGGAAACCGTTACCATTACT-3′,下游引物:5′-CTGGTGTCGTGGAGTCGGCAA-3′;U6上游引物:5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游引物:5′-CGCTTCAGAATTTGCGTGTCAT-3′。
1.4 CCK-8检测细胞增殖活性
收集心肌细胞H9c2,按照1.2进行处理接种96孔板内,继续培养48 h,每孔中加入100 μL CCK-8溶液,继续培养4 h,酶标仪检测450 nm处光密度(optical density,OD)值,细胞活性(%)=实验组OD值/对照组OD值×100%。
1.5 流式细胞术检测细胞凋亡
收集培养24 h的各组心肌细胞H9c2,PBS冲洗细胞,然后制细胞悬液,加入5 μL Annexin V-FITC和PI溶液,避光反应15 min,置于流式细胞仪检测细胞凋亡变化。
1.6 Western blotting检测
使用蛋白裂解液提取心肌H9c2细胞蛋白,BCA法检测蛋白水平,将30 μg蛋白样品进行SDS-PAGE电泳分离,90 V电压转膜,封闭培养60 min,将cleaved-Caspase-3、Bax、Beclin-1、LC3I、LC3II、p-mTOR、mTOR、p-p70s6k、p70s6k抗体稀释为1∶600,4 ℃过夜孵育,室温下加入辣根过氧化物酶标记的二抗稀释液,孵育60 min,ECL显色,曝光。用Image J软件分析蛋白条带。
1.7 统计学分析
采用SPSS 22.0软件分析。多组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 成功建立慢性心衰细胞模型
光镜下观察到正常H9c2细胞为梭形,结构完整,DOX处理后H9c2细胞呈圆梭形,细胞间连接减少,伪足消失,并伴有不同程度的细胞肿胀和坏死,提示慢性心衰细胞模型构建成功(图1)。

图1 DOX处理后H9c2细胞形态变化A为正常H9c2细胞;B为1 μmol/L DOX处理24 h的H9c2细胞。
2.2 各组miR-451a表达水平比较
与Control组比较,DOX组miR-451a相对表达水平显著降低(P<0.05);与DOX+miR-NC组比较,DOX+miR-451a组miR-451a相对表达水平显著升高(P<0.05;图2)。
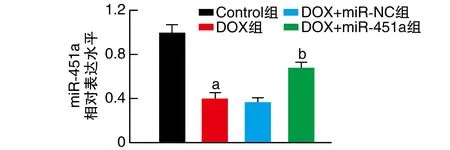
图2 转染miR-451a在细胞中的表达a为P<0.05,与Control组比较;b为P<0.05,与DOX+miR-NC组比较。
2.3 上调miR-451a对DOX诱导H9c2心肌细胞凋亡的影响
与Control组比较,DOX组细胞活性显著降低,凋亡率、cleaved-Caspase-3、Bax蛋白表达显著升高(P<0.05);与DOX+miR-NC组比较,DOX+miR-451a组细胞活性显著升高,凋亡率、cleaved-Caspase-3、Bax蛋白表达显著降低(P<0.05;图3)。
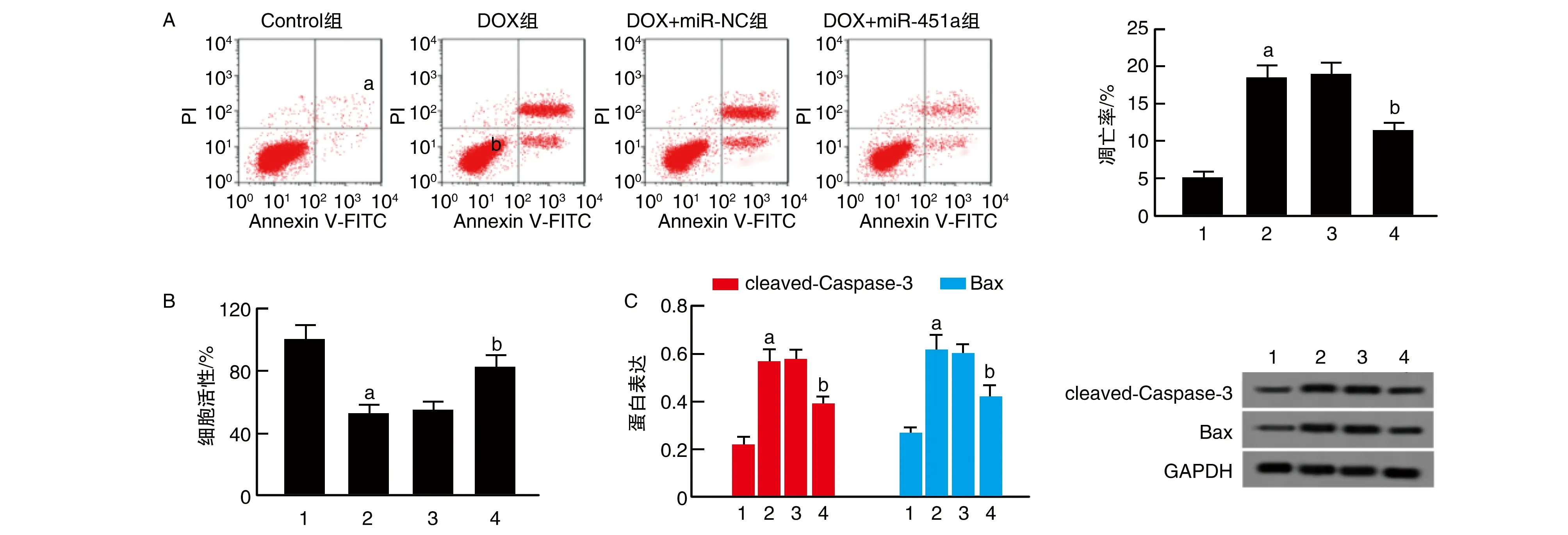
图3 上调miR-451a对阿霉素诱导H9c2心肌细胞凋亡的影响1为Control组;2为DOX组;3为DOX+miR-NC组;4为DOX+miR-451a组。A为细胞凋亡;B为细胞活性;C为凋亡相关蛋白表达。a为P<0.05,与Control组比较;b为P<0.05,与DOX+miR-NC组比较。
2.4 上调miR-451a对DOX诱导H9c2心肌细胞自噬的影响
与Control组比较,DOX组Beclin-1、LC3II/I蛋白表达显著升高(P<0.05);与DOX+miR-NC组比较,DOX+miR-451a组Beclin-1、LC3II/I蛋白表达显著降低(P<0.05;图4)。

图4 上调miR-451a对阿霉素诱导H9c2心肌细胞自噬的影响1为Control组;2为DOX组;3为DOX+miR-NC组;4为DOX+miR-451a组。a为P<0.05,与Control组比较;b为P<0.05,与DOX+miR-NC组比较。
2.5 上调miR-451a对DOX诱导H9c2心肌细胞相关通路蛋白表达的影响
与Control组比较,DOX组p-mTOR、p-p70s6k蛋白表达显著降低(P<0.05);与DOX+miR-NC组比较,DOX+miR-451a组p-mTOR、p-p70s6k蛋白表达显著升高(P<0.05;图5)。
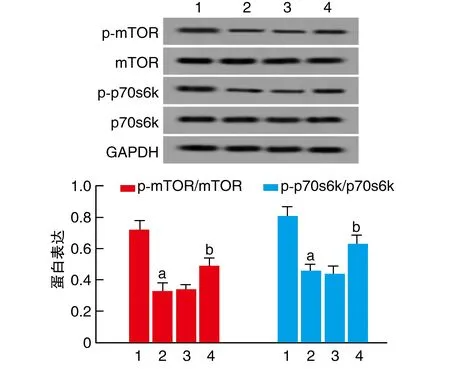
图5 上调miR-451a对DOX诱导H9c2心肌细胞相关通路蛋白表达的影响1为Control组;2为DOX组;3为DOX+miR-NC组;4为DOX+miR-451a组。a为P<0.05,与Control组比较;b为P<0.05,与DOX+miR-NC组比较。
2.6 miR-451a通过调控mTOR信号通路对DOX诱导H9c2心肌细胞凋亡、自噬的影响
与DOX+miR-451a组比较,DOX+miR-451a+CCI-779组细胞活性降低,而凋亡率、cleaved-Caspase-3、Bax、Beclin-1、LC3II/I蛋白表达升高(P<0.05;图6、表1)。
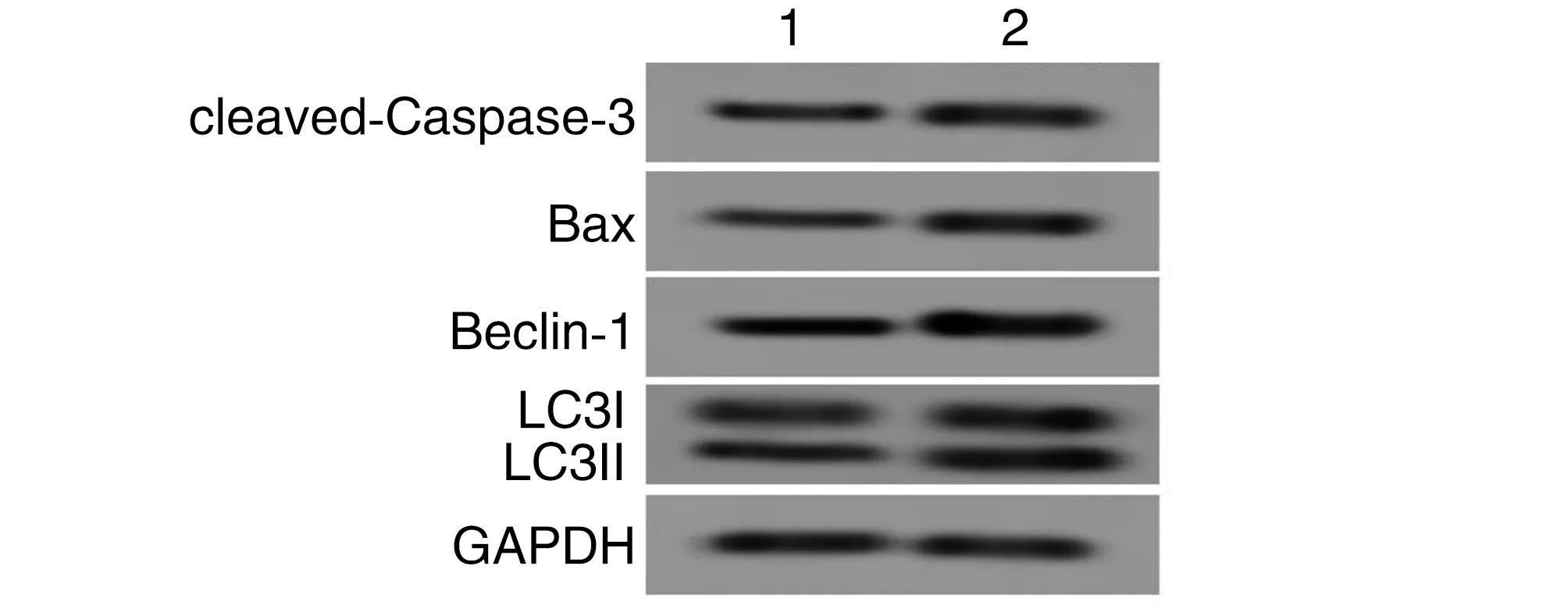
图6 miR-451a通过调控mTOR信号通路对DOX诱导H9c2心肌细胞凋亡、自噬相关蛋白的影响1为DOX+miR-451a组;2为DOX+miR-451a+CCI-779组。
3 讨 论
阿霉素是常见的抗肿瘤药物,常用于白血病、淋巴瘤、乳腺癌等恶行肿瘤的治疗,但阿霉素也具有明显的心脏毒性,可诱发慢性心衰[8-9]。多数动物体内实验、体外细胞实验常用阿霉素诱导建立慢性心衰模型[10-11]。阿霉素诱导心肌细胞,导致心肌细胞发生氧化应激反应,促进细胞凋亡和自噬,导致心肌细胞严重损伤从而诱发慢性心衰[12]。cleaved在正常条件下以无活性的酶原形式存在,外界刺激后以活化酶切的形式存在,常见成员有cleaved-Caspase-3等,Bax促进线粒体膜通透性转变,使细胞色素C释放进入细胞质,可激活cleaved-Caspase-3,并促进细胞凋亡[13]。Beclin-1是自噬相关蛋白,与自噬体的形成和成熟形成有关,自噬发生时,LC3I经过剪切与磷脂酰乙醇胺结合后生成LC3II,LC3II/I比值常用来反馈自噬水平[14]。本研究使用阿霉素诱导心肌细胞建立慢性心衰模型,结果显示,细胞活性降低,凋亡率增加,cleaved-Caspase-3、Bax、Beclin-1、LC3II/I蛋白表达上调,提示慢性心衰细胞模型构建成功。
miRNA与人类疾病发展有关,还可成为一些疾病分子靶向的靶点[15]。miR-451a通过基质金属蛋白酶(matrix metalloprotease,MMP)-2/MMP-9调节心脏重塑的发展[16]。在阿霉素诱导小鼠建立心脏毒性模型的结果显示,在小鼠模型血浆和组织内miR-34a-5p和miR-451a低表达,表明miR-34a-5p和miR-451a与阿霉素诱导心脏毒性有关[17]。本研究结果显示,阿霉素诱导心肌细胞中miR-451a表达下调,上调miR-451a可增加细胞活性,降低凋亡率,下调cleaved-Caspase-3、Bax、Beclin-1、LC3II/I,提示上调miR-451a可减轻阿霉素诱导心肌细胞凋亡和自噬。
miRNA可通过调控信号通路转导途径参与疾病的发展[18]。本研究中,上调miR-451a可增加阿霉素诱导心肌细胞中p-mTOR、p-p70s6k蛋白表达。mTOR信号通路有上游信号分子、下游信号蛋白以及mTOR复合体构成,p70s6k是mTOR信号通路底物,mTOR信号通路与心脏疾病发生密切相关[19]。研究表明,mTOR信号通路在阿霉素诱导的心肌细胞中表达降低,通过激活信号转导途径参与心肌损伤[20]。本研究结果显示,加入mTOR信号通路抑制剂逆转了上调miR-451a对阿霉素诱导心肌细胞凋亡和自噬的影响,提示miR-451a通过调控mTOR信号通路影响阿霉素诱导的心肌细胞损伤。
综上所述,上调miR-451a可抑制阿霉素诱导心肌细胞凋亡和自噬,其作用机制可能与mTOR信号通路有关。
