抗Hp治疗对溃疡性结肠炎患者肠道菌群及疾病活动的影响
2023-11-10陆筱祎段超勤华婷琰
陆筱祎, 段超勤, 华婷琰
苏州市立医院消化内科,江苏苏州 215008
溃疡性结肠炎(ulcerative colitis,UC)是一种累及回肠、直肠及结肠等范围的非特异性肠道炎症性疾病,其发病以青壮年人群多见,近年发病率呈明显上升趋势,已成为全球范围内的公共卫生问题之一[1]。UC的发病机制尚不明确,可能与遗传、免疫、环境及肠道菌群等密切相关,其中肠道菌群失调是公认的影响UC发生发展的重要因素[2]。幽门螺杆菌(Helicobacter pylori,Hp)是一种寄生于胃内的革兰氏阴性菌,其可通过免疫机制自我保护的同时造成胃肠道损伤,通过分泌机制引起胃肠道环境及胃肠道菌群的改变[3-4]。有研究发现,Hp感染与UC疾病进展可能存在着某种联系,但结论并不完全相同,抗Hp治疗在一定程度上可能改变患者肠道菌群的数量、分布和比例[5-6]。本研究从这个角度出发,探索抗Hp治疗对UC患者肠道菌群及疾病活动的影响,为进一步明确UC与Hp之间的生物学联系提供参考。
1 资料和方法
1.1 一般资料
选取本院2019年5月1日—2021年12月31日确诊UC患者60例,根据Hp检查结果分为Hp(+)组和Hp(-)组各30例,同时纳入健康体检者30例为对照组。各组一般资料比较差异无显著性(P>0.05;表1),具有可比性。纳入标准:①病理确诊为UC,根据文献[7]标准诊断为UC疾病活动期;②均行14C尿素呼气试验检测Hp;③1个月内未使用抗生素、抗炎、糖皮质激素及免疫抑制药物;④临床资料齐全。排除标准:①克罗恩病;②对四联疗法药物过敏;③严重心、肝、肾功能障碍;④妊娠、哺乳期女性;⑤恶性肿瘤;⑥系统性红斑狼疮、类风湿性关节炎;⑦不能配合完成研究。
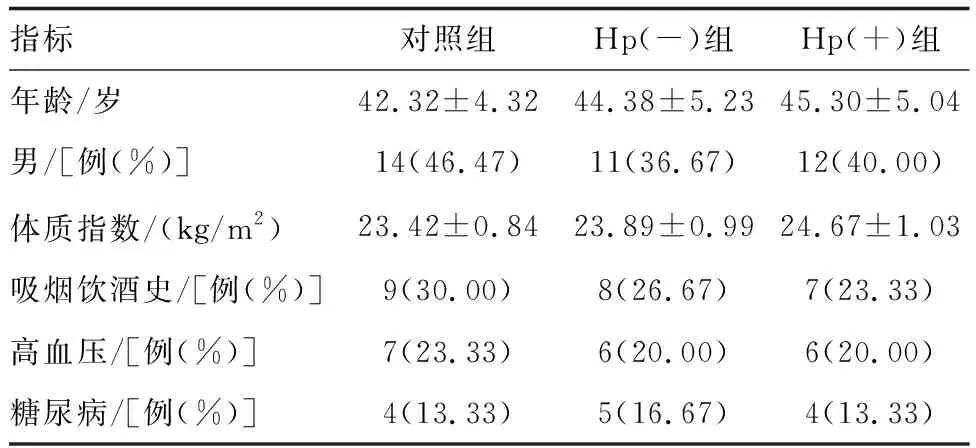
表1 各组一般情况的比较(n=30)
1.2 常规治疗和抗Hp治疗方法
参照《炎症性肠病诊断与治疗的共识意见(2018年·北京)》[7]标准对所有UC患者进行常规治疗,轻中度患者采用5-氨基水杨酸制剂(美沙拉嗪肠溶片,Losan Pharma GmbH,H20100261)口服(每次2片,每天3次,或遵医嘱)联合或不联合灌肠(每晚1次,每次1支,或遵医嘱)。进行诱导缓解及维持治疗,效果不佳则改用糖皮质激素,根据患者实际情况联合免疫抑制剂或5-氨基水杨酸等维持治疗。Hp(+)UC患者进行抗Hp四联疗法,即阿莫西林(哈尔滨制药集团,H23020932)、克拉霉素(扬子江制药集团有限公司,H19990376)、托拉唑钠肠溶胶囊(海南双河药业有限公司,H20093903)、柠檬酸铋剂钾片(丽珠集团制药厂,H10900084),疗程2周。
1.3 UC疾病活动性的评估
UC病变范围采用蒙特利尔分型[8]。E1型:病变分布于直肠,肠镜下所见病变最大范围局限于直肠而未达乙状结肠;E2型:病变分布于左半结肠,肠镜下所见病变最大范围局限于左半结肠;E3型:广泛病变。
UC疾病活动性评估采用改良Mayo评分系统[9]。根据患者排便次数、便血程度、内镜结果及病情评价4个维度评分,每个维度0~4分,计算总分。临床缓解:≤2分,且无单项评分>1分;轻度活动:3~5分;中度活动:6~10分;重度活动:11~12分。
1.4 肠道菌群的检测
在无菌条件下获取新鲜粪便10 g(治疗前及治疗后),按照日本光冈知足法的原则[10],选择肠杆菌(enterobacter,EB)、肠球菌(enterococcus,EC)、酵母菌(saccharomycetes,SM)、葡萄球菌(staphylococcus,SP)、拟杆菌(bacteroidetes,BD)、乳杆菌(lactobacillus,LC)、双歧杆菌(bifidobacterium,BF)、消化球菌(peprococcus,PC)、小梭菌(clostridiu,CD)及真杆菌(eubacterium,EU)共10种肠道微生物作为肠道菌群的评估指标。
将0.5 g新鲜粪便放入装有4.5 mL稀释液和4粒玻璃珠的无菌安培瓶中,旋涡混匀器上振荡1 min(300 r/min),梯度稀释后滴种于培养基,常温干燥10 min,厌氧菌平板倒置于37 ℃厌氧培养箱中培养72 h,需氧菌平板倒置于37 ℃恒温培养箱中24 h。所有菌落数据的结果均取lgN(CFU/g)。
1.5 统计学处理
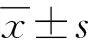
2 结 果
2.1 不同Hp检测结果UC患者疾病活动程度的比较
Hp(+)组与Hp(-)组治疗前和治疗后UC患者疾病活动程度均存在差异(P<0.05;表2)。
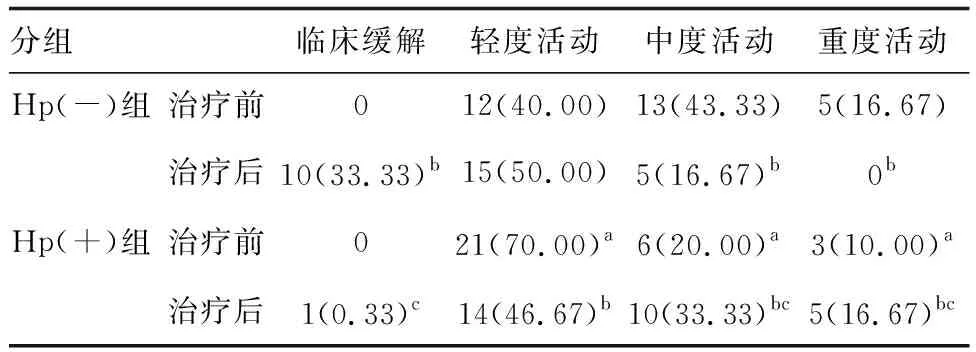
表2 不同Hp检测结果UC患者疾病活动程度的比较(n=30) 例(%)
2.2 不同疾病活动程度患者肠道菌群的比较
治疗前,临床缓解0例,轻度活动32例,中度活动20例,重度活动8例,与对照组30名人群进行对比,结果显示,不同疾病活动度UC患者SM、BD、LC、BF、PC菌群数量明显高于对照组(P<0.05),EU菌群数量明显低于对照组(P<0.05),其他类型微生物菌群数量对比差异无统计学意义(P>0.05;表3)。随疾病活动度增加,上述变化更明显(P<0.05;表3)。
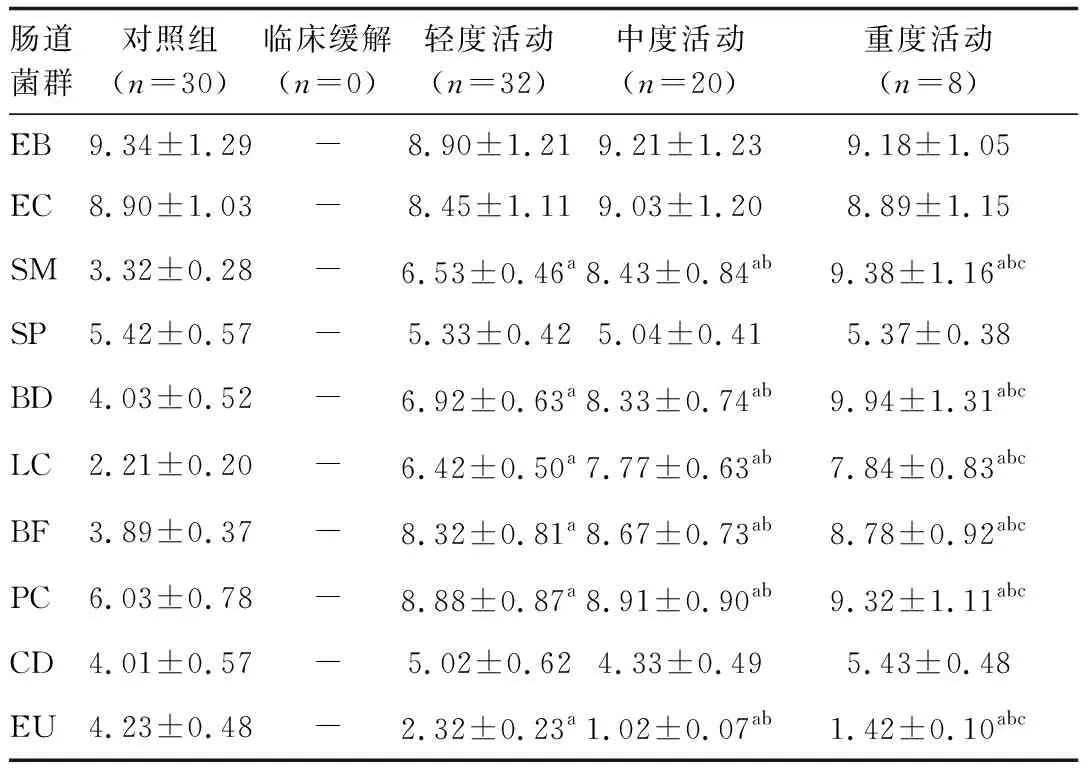
表3 不同疾病活动程度患者肠道菌群的比较
2.3 不同Hp检测结果UC患者肠道菌群的比较
治疗前后Hp(+)和Hp(-)UC患者SM、BD、LC、BF、PC菌群数量明显高于对照组(P<0.05),EU菌群数量明显低于对照组(P<0.05),其他类型微生物菌群数量对比差异无统计学意义(P>0.05;表4)。治疗前,Hp(-)UC患者较Hp(+)UC患者上述变化更明显(P<0.05;表4)。
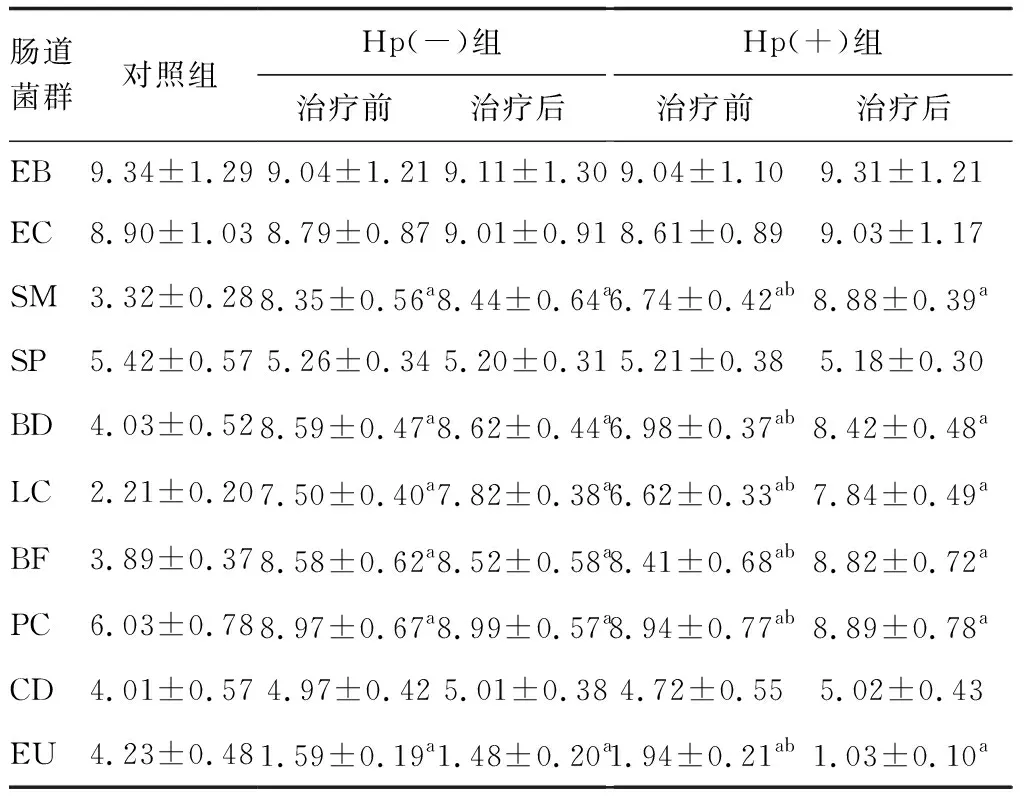
表4 不同Hp检测结果UC患者治疗前后肠道菌群的比较(n=30) lg CFU/g
3 讨 论
Hp感染与包括炎症性肠病、系统性红斑狼疮及肾病等多种自身免疫性疾病相关,特别是Hp感染所引起的肠道微生态的失调也与炎症性肠病患者的疾病转归具有密切的关联,相关研究是当前的热点问题[11]。目前对于UC与Hp的关系尚没有统一的定论,不少研究在结论上完全相反,Owyang等[12]研究显示,Hp基因组存在一种特殊的免疫调节序列,幽门定居的Hp可以将DNA释放到肠腔中,肠固有层树突状细胞受到Hp免疫调节序列的影响后,通过介导人Toll样受体-9信号途径而导致I型干扰素生成减少,肠黏膜炎症程度降低。Engler等[13]研究显示,在动物实验中,Hp感染可以一定程度缓解葡聚糖硫酸钠诱导的慢性结肠炎和T细胞转移诱导的结肠炎大鼠的临床症状。可见Hp在肠道微生态改变中的作用,而临床常用的抗Hp四联疗法也可以在一定程度上改变肠道微生态。
本研究发现,Hp(+)UC患者较Hp(-)UC患者具有相对更轻的疾病活动度,这可能是Hp存在对肠道微生态或肠道免疫反应具有良好的调节作用。随后进一步分析发现,轻度活动、中度活动及重度活动的UC患者SM、BD、LC、BF、PC菌群数量明显高于健康人群,EU菌群数量明显低于健康人群,一些条件致病菌如EC和SM的增多,使肠黏膜屏障功能减退,容易引发肠道炎性改变,而诸如BF、LC等肠道保护细菌也增多,这可能是一种肠道自我保护机制,而真杆菌的数量显著下降,这些微生物的动态改变与当前对UC的研究结果较为一致[14]。本文进一步研究显示,治疗前Hp(+)UC患者SM、BD、LC菌群数量均低于Hp(-)UC患者,EU菌群数量明显高于Hp(-)UC患者,说明Hp(+)对肠道微生态的影响有助于缓解UC患者的活动状态。抗Hp治疗后,Hp(+)组中重度活动患者由9例增加到15例,Hp(-)组中重度活动患者由18例下降到5例,进一步表明Hp(+)对UC疾病的保护作用,提示Hp(+)可降低UC病变区域的炎症反应而缓解病情。
综上所述,Hp(+)是UC的一个保护性因素,而抗Hp治疗可能会诱发或加重UC的疾病进展。同时本研究也注意到自身存在样本量少的缺陷,可能对本研究的结论造成一定的影响,有待后续进一步研究证实。
