沉默lncRNA NEAT1通过抑制NF-κB通路减轻LPS 诱导的支气管上皮细胞炎症反应
2023-11-10王静邵小美盛娜杨震
王静, 邵小美, 盛娜, 杨震
南京江北医院 1.呼吸与危重症科,2.呼吸科,江苏南京 210000
人支气管上皮(human bronchial epithelium,HBE)在维持呼吸系统稳态方面发挥重要作用[1]。炎症细胞因子白细胞介素(interleukin,IL)-1β、IL-6、IL-8及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等在多种刺激下均可在HBE细胞中上调[2]。长链非编码RNA(long non-coding RNA,lncRNA)参与多种生理和病理过程,包括炎症反应。在脓毒症中,抑制lncRNA NEAT1的表达可阻碍脓毒症的发展和脂多糖(lipopolysaccharide,LPS)诱导的细胞损伤及炎症反应[3]。核因子-κB(nuclear factor-κB,NF-κB)与细胞炎症反应密切相关[4]。香烟烟雾提取物通过激活16HBE细胞中NF-κB通路促进细胞的氧化应激和炎症反应[5]。本文采用LPS建立气道炎症模型,分析lncRNA NEAT1在LPS诱导的HBE细胞炎症中的作用以及NF-κB信号通路所发挥的作用。
1 材料和方法
1.1 细胞、试剂及仪器
人16HBE细胞购于深圳Otwo Biotech公司。胎牛血清购于兰州荣晔生物科技有限责任公司;DEME培养基、胰蛋白酶购于上海联迈生物工程有限公司;LPS购于上海碧云天生物技术有限公司;Lipofectamine® 2000转染试剂、SuperScript反转录试剂盒购于美国英杰生命技术有限公司;Total RNA提取试剂盒购于福州飞净生物科技有限公司;SYBR Green qPCR Master Mix购于美国Med Chem Express(MCE)生物科技公司;人IL-1β、IL-6及TNF-α的ELISA试剂盒均购于武汉菲恩生物科技有限公司;MTT细胞增殖及细胞毒性检测试剂盒购于北京索莱宝科技有限公司;Annexin V-FITC/碘化丙啶(PI)凋亡检测试剂盒、高敏型ECL化学发光检测试剂盒购于南京诺唯赞生物科技股份有限公司;蛋白酶/磷酸酶抑制剂混合物购于上海雅吉生物科技有限公司;RIPA裂解缓冲液购于美国AMRESCO公司;一抗PCNA、p53、NF-κB抑制蛋白α(IκBα)、磷酸化-IκBα(p-IκBα)、NF-κB p65、p-NF-κB p65及内参α-tubulin均购于英国Abcam公司;异硫氰酸荧光素标记IgG(FITC-IgG)购于上海阿拉丁试剂有限公司;引物及针对lncRNA NEAT1特定的小干扰RNA(si-NEAT1)及siRNA干扰对照(si-NC)均由上海生工生物工程股份有限公司设计合成。Applied Biosystems ABI 7500型荧光定量PCR仪购自美国应用生物系统公司;Multlskan Mk3酶标仪购自美国赛默飞世尔科技公司;BD Accuri®C6流式细胞仪购自美国BD公司;FV1000激光共聚焦显微镜购自日本奥林巴斯株式会社。
1.2 细胞培养及分组
采用含10%胎牛血清的DEME培养基于37 ℃、5%CO2培养箱中培养16HBE细胞,待其生长铺满培养皿85%时,去除培养基,使用PBS清洗后添加胰蛋白酶消化,显微镜观察到细胞回缩,间隙变大后终止消化,去除消化液后添加新的培养基,按照1∶3的比例进行传代培养。选取培养的16HBE细胞接种于6孔细胞培养板中(1×106个/孔),当细胞生长至培养板75%时,向每孔中添加50 mg/L LPS[6],再继续将培养板置于37 ℃、5%CO2培养箱中培养24 h,收集细胞进行后续研究。
16HBE细胞分为Control组(等体积生理盐水培养)、LPS组(50 mg/L LPS处理24 h)、LPS+si-NC组(si-NC转染24 h后添加50 mg/L LPS处理24 h)和LPS+si-NEAT1组(si-NEAT1转染24 h后添加50 mg/L LPS处理24 h)。参照Lipofectamine®2000转染试剂盒说明书进行瞬时转染。
1.3 lncRNA NEAT1及炎症细胞因子水平检测
使用Total RNA提取试剂盒依次从各组培养的16HBE细胞中提取总RNA,使用SuperScript反转录试剂盒进行反转录,随后使用SYBR Green qPCR Master Mix配制反应体系在荧光定量PCR仪中对mRNA进行定量分析。以β-actin为内参,2-ΔΔCt法计算。实时荧光定量PCR反应程序:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,共40个循环。ELISA法检测各组细胞培养液中IL-1β、IL-6及TNF-α的含量,所有操作流程均根据试剂盒说明书进行。
lncRNA NEAT1:F-5′-CTTCCTCCCTTTAACTTATCCATTCAC-3′,R-5′-CTCTTCCTCCACCATTACCAACAATAC-3′;IL-6:F-5′-CCAGGAGAAGATTCCAAAGATGTA-3′,R-5′-CGTCGAGGATGTACCGAATTT-3′;IL-1β:F-5′-CTCTCACCTCTCCTACTCACTT-3′,R-5′-TCAGAATGTGGGAGCGAATG-3′;TNF-α:F-5′-GGATGGATGGAGGTGAAAGTAG-3′,R-5′-TGATCCTGAAGAGGAGAGAGAA-3′;β-actin:F-AATCTGGCACCACACCTTCTA-3′,R-5′-ATAGCACAGCCTGGATAGCAA-3′。
1.4 MTT法检测细胞增殖活力
取各组16HBE细胞,以2×103个/孔接种于96孔培养板中培养24 h后,向每孔中添加100 μL DEME培养基(含10% MTT溶液)后置于培养箱中继续培养4 h,添加100 μL Formanzan溶解液继续培养细胞约4 h,直至观察Formazan被完全溶解,使用37 ℃预热的酶标仪于570 nm处读取各孔光密度值(OD)。
1.5 流式细胞仪检测细胞凋亡率
取各组16HBE细胞,以1×106个/孔接种于6孔培养板中,培养24 h,去除上清,收集细胞,使用培养基稀释细胞为1×105个/mL,添加200 μL 1×Binding buffer悬浮细胞后添加5 μL Annexin V-FITC和PI,在室温避光孵育15 min,添加300 μL 1×Binding buffer,混匀后于流式细胞仪中分析各组细胞凋亡率。
1.6 Western blotting检测
将各组16HBE细胞在含1%蛋白酶/磷酸酶抑制剂混合物的RIPA缓冲液中冰上裂解30 min,裂解后离心10 min,收集上清液,98 ℃变性5 min。将获得的总蛋白通过10% SDS-PAGE电泳分离,将蛋白转移到PVDF膜上。添加5%脱脂牛奶封闭2 h,将膜与相对应的一抗(PCNA、p53、IκBα、p-IκBα、NF-κB p65、p-NF-κB p65及α-tubulin)4 ℃下孵育过夜,隔天将膜与二抗IgG-H&L(1∶2 000)孵育2 h。ECL化学发光检测试剂盒对蛋白质印迹条带进行可视化,Image J分析条带灰度值。最终目的蛋白的相对表达量=目的蛋白灰度值/内参蛋白灰度值。
1.7 免疫荧光技术检测细胞NF-κB p65定位
取各组5×104个/μL细胞添加在12孔板的载玻片上。PBS冲洗3次,室温下用4%多聚甲醛固定10 min,添加抗体p-NF-κB p65孵育细胞。PBS洗涤后,加入FITC-IgG。最后,对载玻片进行冲洗、安装,在激光共聚焦显微镜(488 nm)上进行观察拍照,并通过荧光定量进行细胞核和细胞质中NF-κB p65的比率分析。
1.8 统计学分析
采用GraphPad Prism 8.0软件分析。使用单因素方差分析、SNK-q检验。P<0.05为差异有显著性。
2 结 果
2.1 沉默lncRNA NEAT1对LPS诱导的16HBE细胞炎症因子的影响
与Control组比较,LPS组IL-1β、IL-6、TNF-α及其mRNA、lncRNA NEAT1表达水平显著上调(P<0.05);与LPS+si-NC组比较,LPS+si-NEAT1组上述指标表达水平显著下调(P<0.05;表1)。

表1 各组16HBE细胞中lncRNA NEAT1及IL-1β、IL-6及TNF-α水平及其mRNA相对表达量
2.2 沉默lncRNA NEAT1对LPS诱导的16HBE细胞增殖及凋亡的影响
与Control组比较,LPS组16HBE细胞增殖活力及PCNA表达水平均明显降低,凋亡率及p53表达水平明显升高(P<0.05);与LPS+si-NC组比较,LPS+si-NEAT1组16HBE细胞增殖活力及PCNA表达水平均明显升高,凋亡率及p53表达水平明显降低(P<0.05;图1)。

图1 沉默lncRNA NEAT1对LPS诱导的16HBE细胞增殖、凋亡的影响A为MTT法检测细胞活力;B、C为Western blotting检测蛋白水平及柱状图;D、E为流式细胞仪检测细胞凋亡及柱状图。a为P<0.05,与Control组比较;b为P<0.05,与LPS+si-NC组比较。
2.3 沉默lncRNA NEAT1对LPS诱导的16HBE细胞中NF-κB通路相关蛋白的影响
与Control组比较,LPS组p-IκBα、p-NF-κB p65蛋白水平升高(P<0.05);与LPS+si-NC组比较,LPS+si-NEAT1组p-IκBα、p-NF-κB p65蛋白水平降低(P<0.05;图2)。
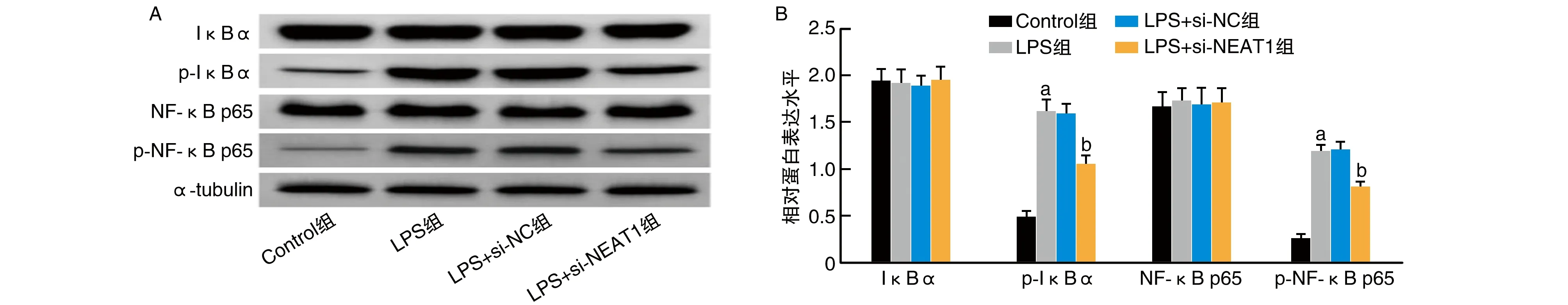
图2 Western blotting检测IκBα、p-IκBα、NF-κB p65与p-NF-κB p65蛋白水平a为P<0.05,与Control组比较;b为P<0.05,与LPS+si-NC组比较。
2.4 沉默lncRNA NEAT1对LPS诱导的16HBE细胞中NF-κB p65定位的影响
与Control组比较,LPS组16HBE细胞中p-NF-κB p65相对荧光强度(细胞核/细胞质)升高(P<0.05);与LPS+si-NC组比较,LPS+si-NEAT1组细胞中p-NF-κB p65相对荧光强度降低(P<0.05;图3)。
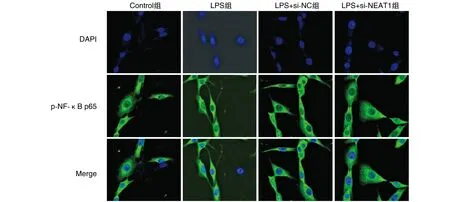
图3 免疫荧光技术测定p-NF-κB p65在16HBE细胞中的表达(100×)
3 讨 论
LPS刺激引起的炎症反应会产生大量炎症细胞因子,进一步诱发细胞凋亡和损伤[7]。本研究结果显示,LPS上调16HBE细胞中IL-1β、IL-6、TNF-α水平及其mRNA表达水平。IL-1β作为免疫反应的放大器,其过量产生可引起自身炎症,也广泛参与细胞的炎症反应[8-9];TNF-α属于TNF家族,是主要的促炎细胞因子[10]。本研究结果显示,LPS抑制16HBE细胞增殖活力及PCNA蛋白水平,并上调凋亡率和p53蛋白水平。PCNA是一种必不可少的蛋白质,参与各种DNA代谢过程,可作为细胞增殖的重要指标[11];而p53是一种转录因子,可通过调控多个基因转录激活促进细胞凋亡[12]。
lncRNA是许多生物事件发展的重要调节因子,可广泛参与细胞内多种生物过程的发生发展[13]。lncRNA NEAT1广泛存在哺乳动物的细胞中,参与多种疾病炎症反应[14-15]。但lncRNA NEAT1在HBE细胞炎症反应中的调控机制尚未可知。本研究结果显示,沉默lncRNA NEAT1可降低LPS诱导的16HBE细胞增殖活力。Gao等[4]发现,lncRNA NEAT1可促进肾小管内皮细胞中LPS诱导的细胞炎症损伤。本研究结果提示,沉默lncRNA NEAT1可明显抑制LPS诱导的16HBE的炎症细胞因子合成与释放及细胞凋亡,并促进细胞增殖。
本研究结果显示,LPS处理后16HBE细胞中p-IκBα与p-NF-κB p65蛋白表达水平明显升高。据以往报道显示,NF-κB信号通路是炎症反应调节因子[16-17]。NF-κB信号通路被激活时,最终引起NF-κB从细胞质NF-κB/IκBα复合体中释放出来,细胞质NF-κB迅速转移到细胞核中并启动靶基因表达[18-19]。以上数据提示,LPS处理激活了IκBα和NF-κB p65的磷酸化和细胞质中p-NF-κB p65向细胞核中转移,表明LPS可能通过激活NF-κB信号通路诱导16HBE细胞炎症反应。沉默lncRNA NEAT1可明显逆转LPS对16HBE细胞中NF-κB信号通路的激活作用。沉默lncRNA NEAT1可抑制IκBα和NF-κB p65的磷酸化和细胞质中的p-NF-κB p65向细胞核中转移,进而对LPS诱导的16HBE细胞的炎症反应发挥抑制作用。
综上所述,沉默lncRNA NEAT1可通过抑制NF-κB通路激活进而减轻LPS诱导16HBE细胞的炎症反应。
