肌萎缩侧索硬化症模型小鼠脑干蛋白质组学分析
2023-11-10熊伯成黎上明但丁邹良玉杨细飞
熊伯成, 黎上明, 但丁, 邹良玉, 杨细飞
1.山西医科大学公共卫生学院,山西太原 030000;2.深圳市疾病预防控制中心 深圳市现代毒理学重点实验室深圳市卫生毒理学医学重点学科,广东深圳 518000;3.深圳市人民医院 暨南大学第二临床医学院南方科技大学第一附属医院神经内科,广东深圳 518020
肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)是一种致命的进行性神经退行性疾病,以进行性运动神经元死亡为特征,表现为肌肉无力、进行性瘫痪,并在发病后3~5年内因呼吸衰竭而死亡[1-2]。
ALS的发病机制尚不完全清楚,主要的机制假说有RNA毒性、兴奋性毒性、蛋白质稳态破坏、神经炎症、轴突运输缺陷、氧化应激和线粒体功能障碍[3]。在ALS的病理过程中,脑干是重要的受损部位,ALS患者出现呼吸、循环和消化功能障碍,同时脑干调节运动和感觉功能也受到影响,导致患者出现肌无力、肌萎缩和肌阵挛等症状。研究表明,ALS患者的延髓和脑桥出现了病理学上的改变,如神经元丧失和胶质细胞激活[4]。磁共振成像显示,ALS患者的脑干体积较健康人群明显缩小[5]。
脑干作为脑组织的一部分,对ALS的发生发展有至关重要的作用,但关于ALS与脑干关系的研究较少。本研究对ALS模型小鼠脑干蛋白质组学进行分析,为药物开发提供新的思路和视角。
1 材料和方法
1.1 主要材料
13周龄携带人类SOD1基因突变体的ALS模型(SOD1G93A)雌鼠[体质量(22.20±0.97)g]和野生型雌鼠[体质量(19.60±0.71)g]各4只,均购自常州卡文斯实验动物有限公司;TMT标记试剂盒、蛋白酶和磷酸酶抑制剂、BCA蛋白定量试剂盒购自Thermo Fisher公司;胰蛋白酶购自Promega公司;脱盐柱购自OASIS公司;三乙基碳酸氢铵、乙腈、TFA、NaH2PO4、NaCl购自Sigma公司;尿素、DTT、IAA购自GEhealthcare公司;抓力测试仪购自安徽正华生物仪器设备有限公司;小鼠步态分析系统购自诺达思(北京)信息技术有限责任公司。
1.2 动物分组
将13周龄SOD1G93A雌鼠作为模型组,野生型雌鼠作为对照组。所有小鼠均在深圳市疾病预防控制中心饲养[许可证号:SYXK(粤)2022-0282,伦理号:ER-0013-005]。小鼠置于12 h明暗周期、(22±2)℃、55%±15%湿度的房间中生活,自由饮水和进食。
1.3 行为学测试
小鼠18周龄末检测行为学(抓力、爬杆、转棒、悬挂、步态);随后戊巴比妥钠麻醉,取出脑干立即放入-80 ℃冰箱中。
1.3.1 抓力测试 将小鼠轻放于仪器抓板的中央,等小鼠抓稳抓板后,均匀用力轻轻地拉小鼠尾巴。每只动物测试3次,取3次结果最大值。抓力值越大说明四肢肌肉力量越大。
1.3.2 悬挂测试 每只动物被放置在一个60 cm×40 cm的金属网中央。等小鼠抓紧金属网后,将其旋转180°呈倒置水平。记录小鼠挂在金属网格上的时间(小鼠在测试前均进行了训练,设定180 s为测试时间上限)。每只重复实验2次,取每只小鼠平均悬挂时间。悬挂时间越长,小鼠四肢的抓取力越大。
1.3.3 爬杆测试 将一根长约50 cm、直径约1 cm自制木杆用医用纱布缠绕以增加摩擦。将小鼠头朝下放在垂直杆的顶部,记录从杆顶到底部平台的下降时间。在测试前,每只小鼠连续训练3天,每天2次,分界值为15 s。实验过程重复3次,计算每只小鼠平均爬行时间。爬行时间越短,小鼠的运动和协调能力越强。
1.3.4 转棒测试 将每只小鼠放在转棒疲劳测试仪的转棒上,旋转速度最大为25 r/min[6](实验前,每只小鼠训练3天,每天2次,以180 s为分界值)。实验重复3次,每次测试间隔至少1 h。取每只小鼠平均坚持时间。坚持时间越长,小鼠耐力和平衡能力越强。
1.3.5 步态测试 采用步行追踪分析系统(Framework 4.0)进行测试。将实验小鼠放置于避光步行通道中(宽5 cm),视频采集系统在步行通道下方,对准小鼠经过的通道显示出小鼠足迹。实验时让小鼠自然进入步行通道,高速摄像机连续记录至少3个步行周期的视频进行后续的数据分析,小鼠中途不能有停顿时间,否则重新记录小鼠步行视频。
1.4 蛋白质提取和酶切
用尿素裂解脑干,随后离心吸取上清液。定量后每个样品取50 μg蛋白质用于后续实验。在每一个样品中加入DTT,混匀后在55 ℃干式加热器中孵育1 h,加入25 mmol/L IAA避光常温孵育1 h。在样品中加入胰酶放入37 ℃恒温箱中消化14 h,脱盐后TMT标记。
1.5 TMT标记与液相色谱-质谱仪/质谱仪分析
将不同标签标记的样品混合后脱盐、旋蒸、重新溶解、分组分;之后再旋蒸,重溶;然后进行液相色谱-质谱仪/质谱仪分析。最后,用蛋白质组搜索软件在UniProt小鼠Fasta数据库中检索数据。根据各多肽的报告离子强度计算蛋白质相对表达量。通过Perseus软件中的t检验方法,将蛋白质的差异表达设定为P<0.05。
1.6 生物信息学分析
在错误发现率<0.01的条件下,采用Perseus软件筛选出差异表达蛋白。通过热图分析评估差异表达蛋白的强度。使用David 6.8(https://david.ncifcrf.gov/)进行蛋白质聚类分析及基因本体分析,以确定差异表达蛋白质的生物学过程和通路。用分子络合物检测(MCODE)分析寻找蛋白质-蛋白质相互作用(protein-protein interaction,PPI)的密集区域。使用Hiplot网站(https://hiplot-academic.com/)进行图像可视化处理。
1.7 统计分析
采用GraphPad Prism 8.0统计软件进行统计学分析。组间差异采用非配对t检验。P<0.05为差异具有显著性。
2 结 果
2.1 ALS小鼠运动功能减弱
与对照组比较,模型组小鼠的各项运动表现均有明显下降:抓力降低;爬杆时间延长;悬挂和转棒时间缩短;摆动速度、身体速度、步幅均显著下降,步行周期延长(表1)。小鼠步行足印杂乱无章,四肢不协调(图1)。
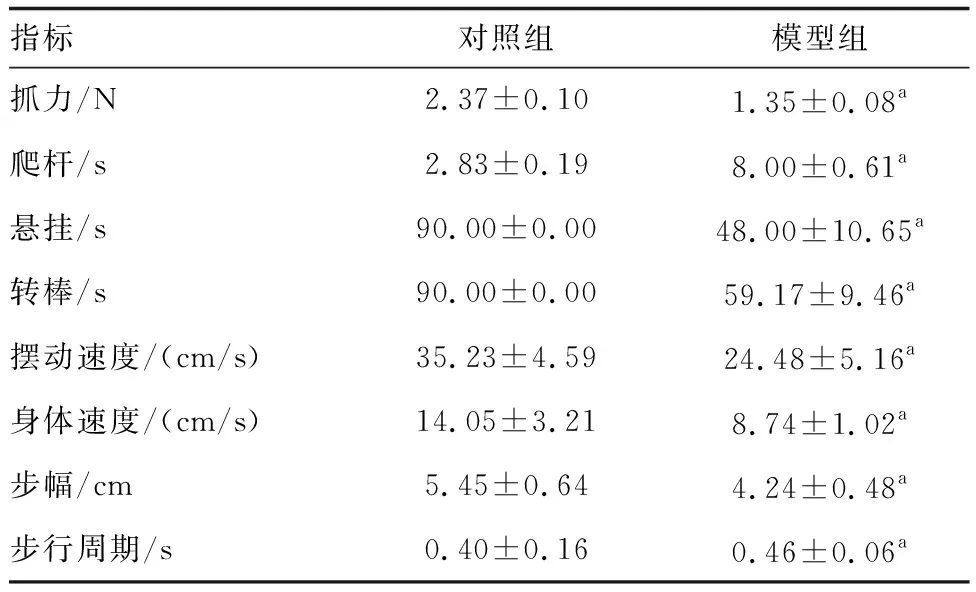
表1 行为学测试结果
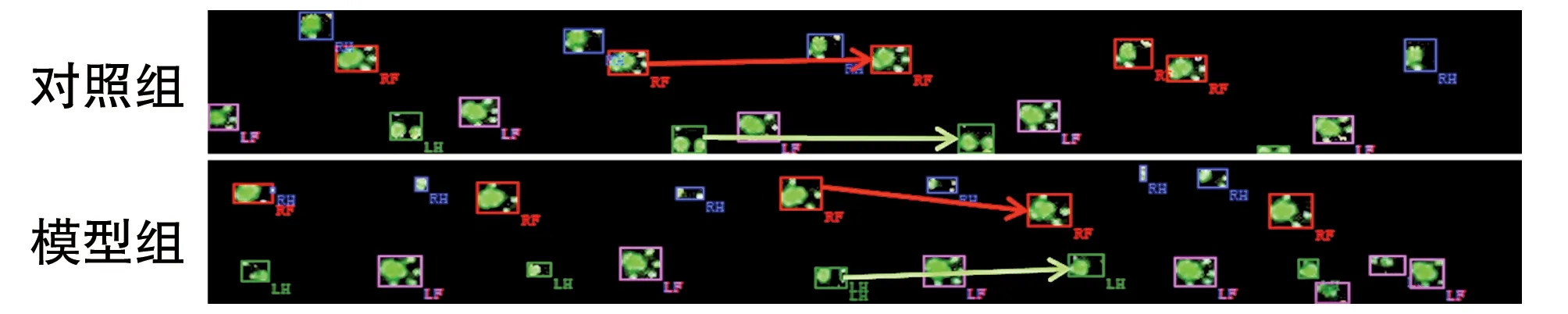
图1 小鼠代表性足印图
2.2 ALS小鼠组织差异表达蛋白
脑干组织中共鉴定和量化了6 702种蛋白质。与对照组小鼠比较,模型组小鼠有423个差异表达蛋白(图2A),其中上调265个,下调158个(图2B)。
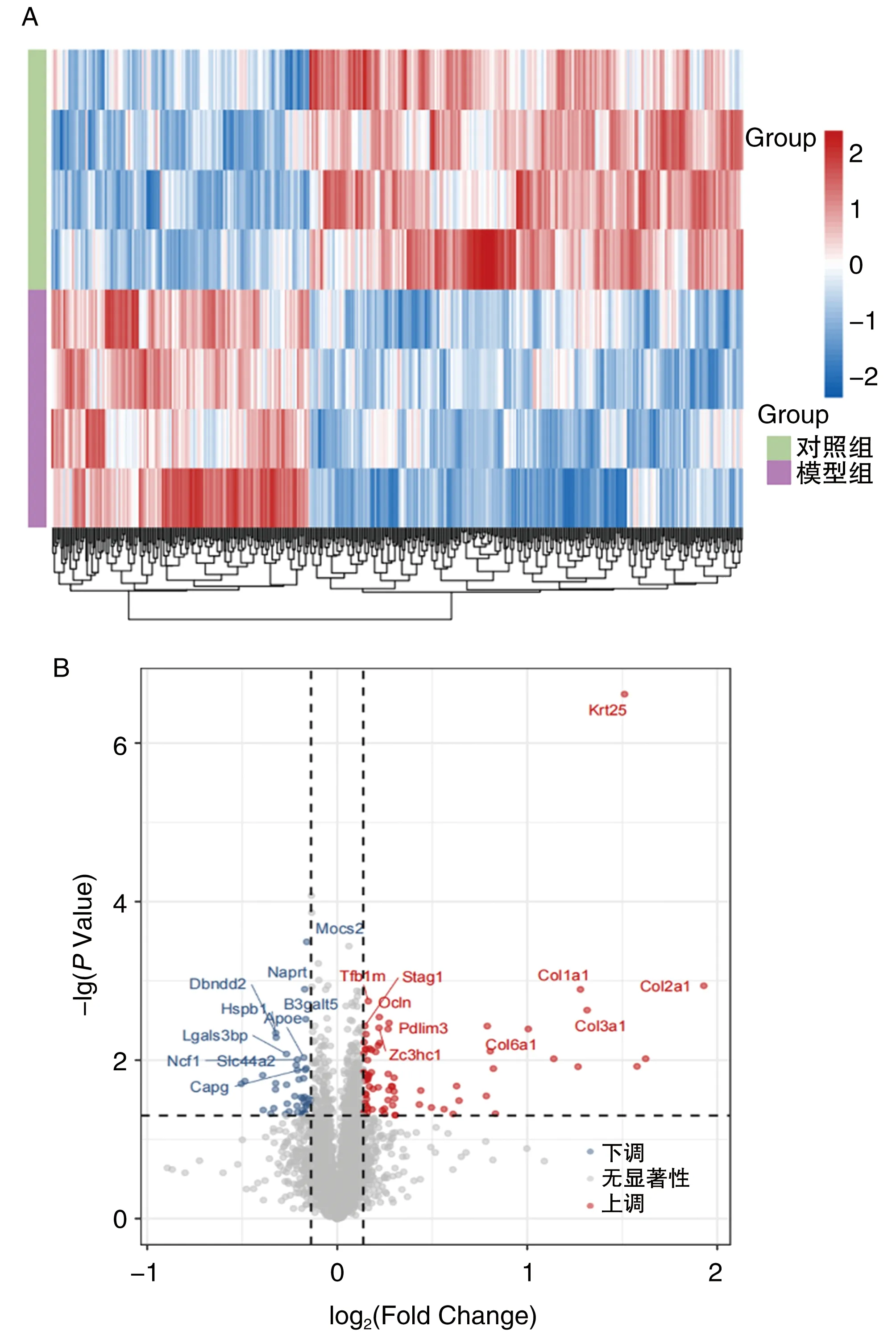
图2 ALS小鼠脑干中差异表达蛋白A为热图;B为火山图。
2.3 差异表达蛋白质生物学过程与通路
DAVID功能分析指出,ALS小鼠脑干中上调蛋白质主要富集于蛋白质运输、细胞黏附、胶原蛋白纤维组织等生物过程;蛋白质结合、相同蛋白质结合等分子功能;细胞质、高尔基体等细胞组分(图3);KEGG通路富集于ECM-受体相互作用、人类乳头瘤病毒感染等(图3)。下调蛋白质主要富集于翻译、细胞死亡的负调控等生物过程;蛋白质结合、水解酶活性等分子功能;细胞质、细胞膜、线粒体等细胞组分;KEGG通路富集于内吞、MAPK信号通路等(图4)。
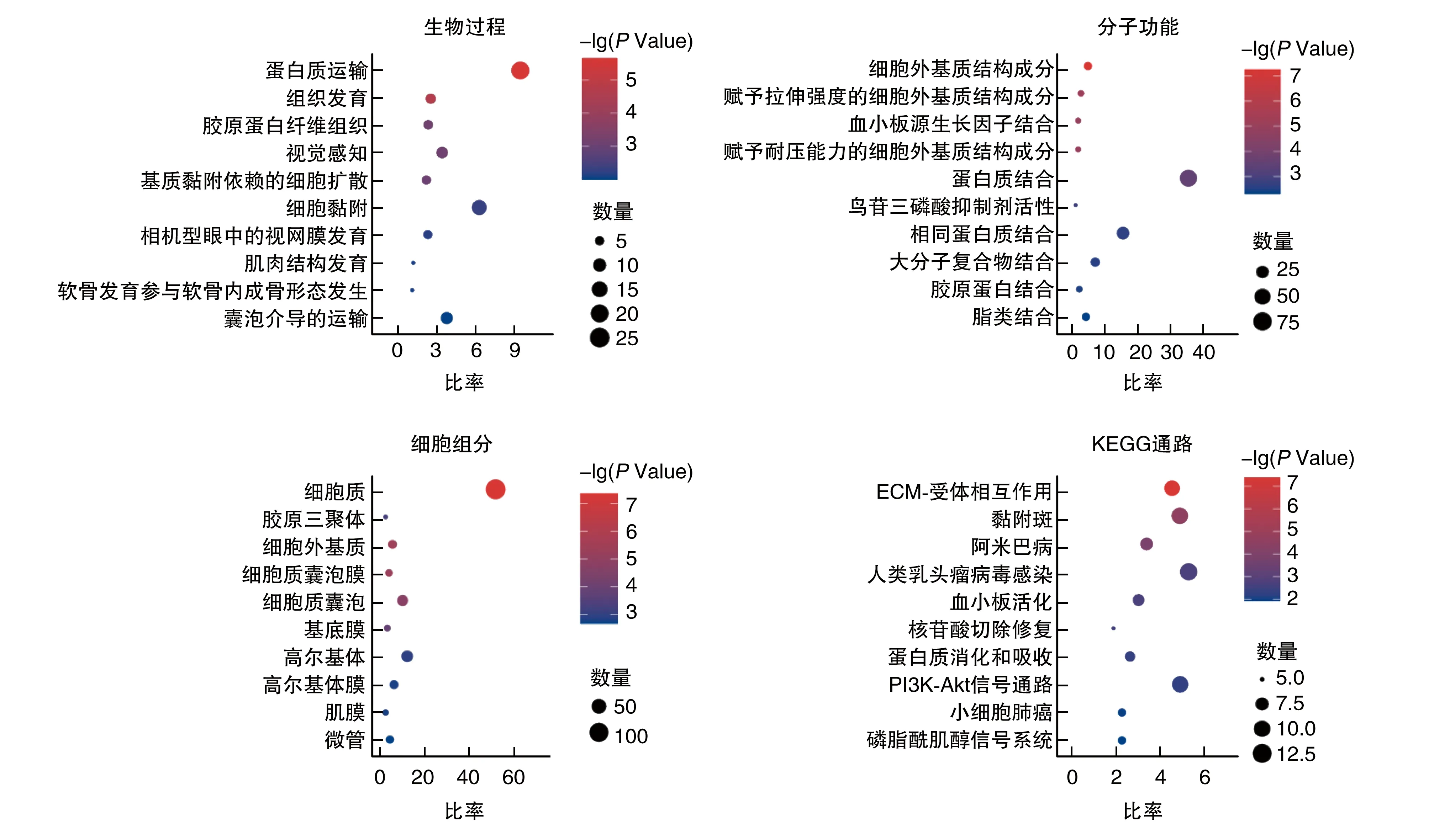
图3 ALS小鼠脑干中上调差异表达蛋白所参与生物过程、分子功能、细胞组分、KEGG通路富集结果
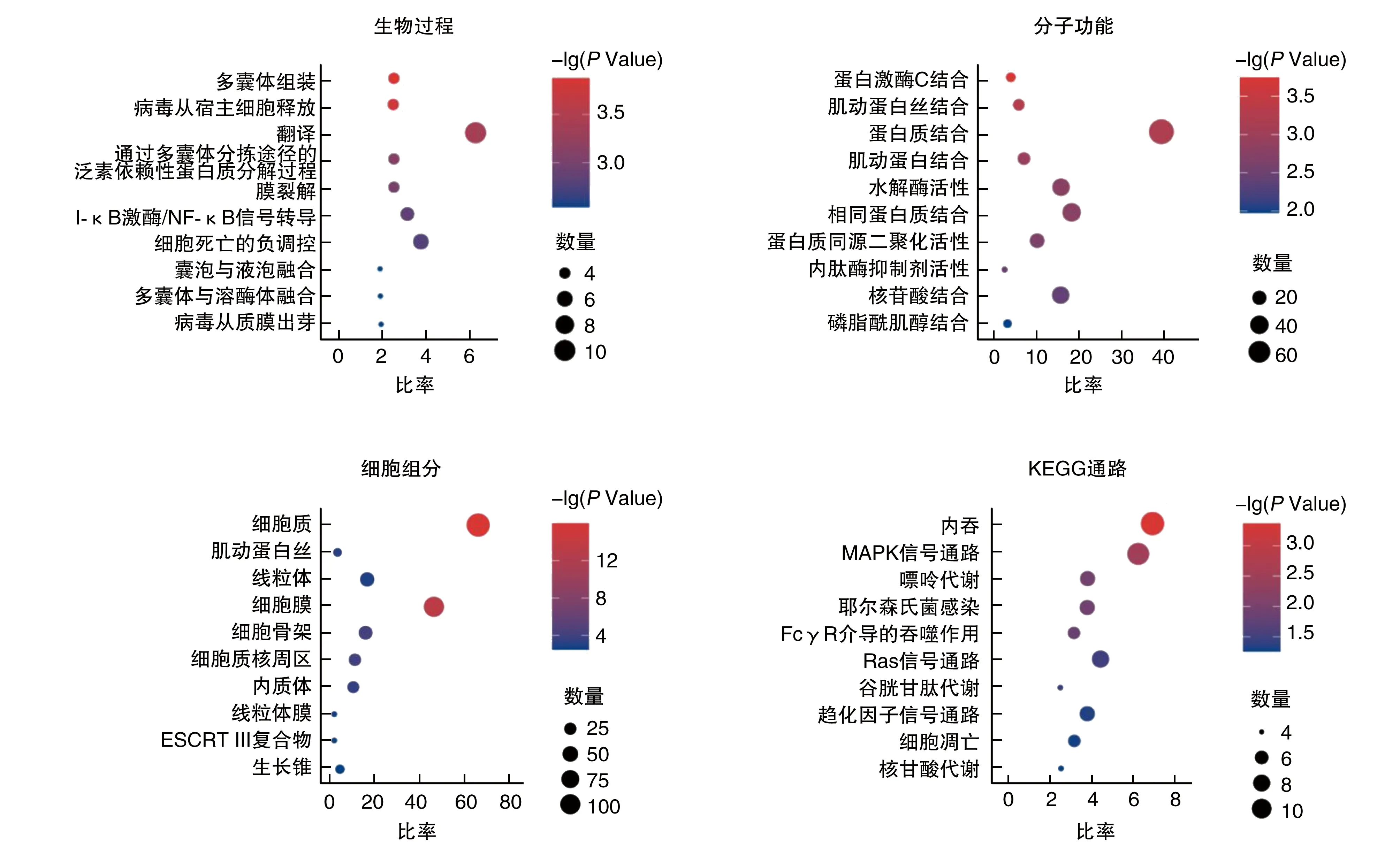
图4 ALS小鼠脑干中下调差异表达蛋白所参与生物过程、分子功能、细胞组分、KEGG通路富集结果
2.4 差异表达蛋白的PPI
采用MCODE分析寻找核心差异表达蛋白的基因集,并用Cytoscape软件来阐明变化的蛋白质之间的相互作用。功能上涉及氧化磷酸化、ECM-受体相互作用(图5)。
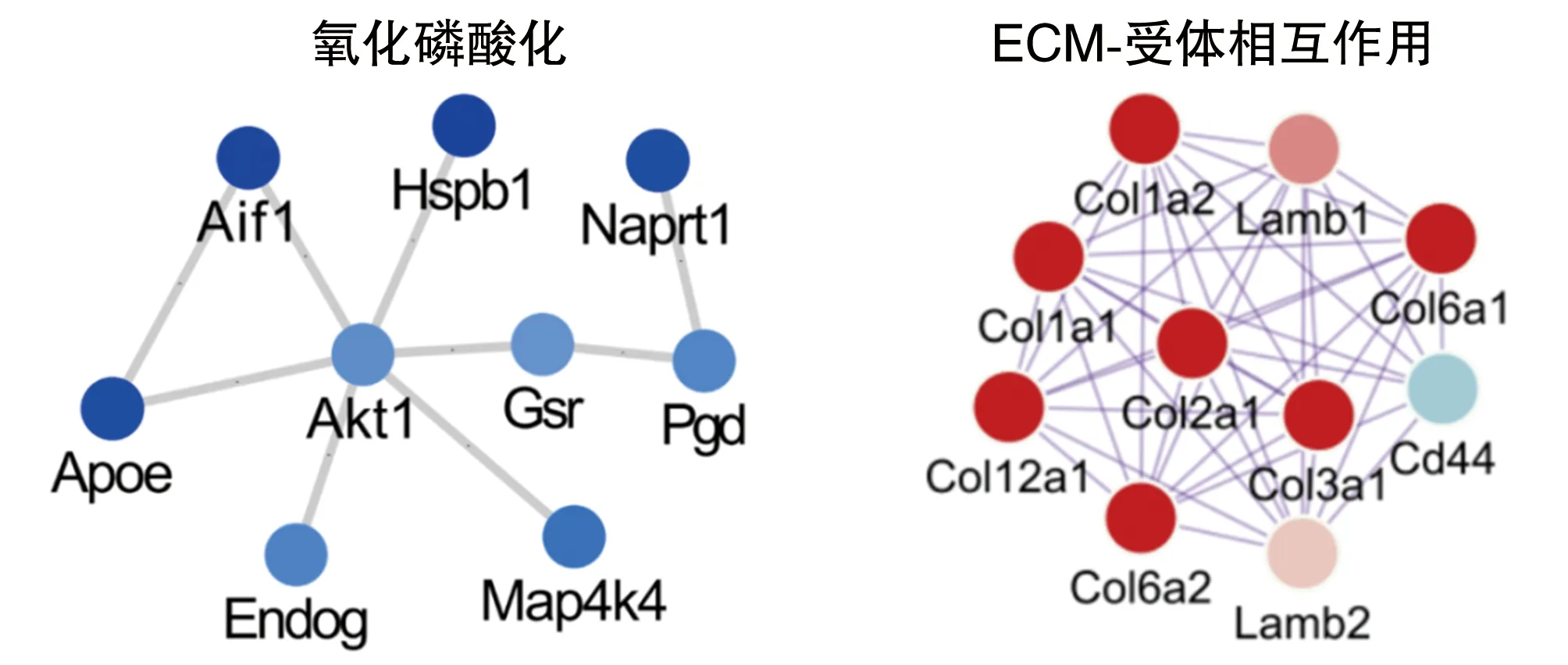
图5 差异表达蛋白的PPI图红色为上调,蓝色为下调。
3 讨 论
ALS是一种进行性和致命的神经退行性疾病,脑干是其发病最严重的区域之一,不同部位起病的患者临床表现有所不同。在ALS患者中,一部分以脑干症状开始,包括构音障碍和吞咽困难,严重影响患者的生活质量[7-8]。研究表明,ALS小鼠脑干神经胶质增生,氧化应激和自噬增加参与了脑干运动神经元的退化[9]。本研究补充了本课题组前期对ALS小鼠脊髓的研究[10],并表明ALS小鼠脑干中胶原蛋白纤维组织、细胞黏附蛋白、EMC-受体相互作用蛋白表达增加,线粒体、肌动蛋白、MAPK信号转导途径蛋白表达减少,这些蛋白表达谱的改变可能是ALS小鼠运动功能降低的分子基础。
胶原蛋白纤维组织、细胞黏附蛋白是炎症反应的重要组成部分[11-12],这些蛋白在本研究中模型组小鼠表达增加,与文献[13]结果一致。EMC-受体相互作用蛋白参与伤口愈合和纤维化[14],这些蛋白在模型组小鼠表达增加,说明脑干中存在神经元损伤。
线粒体是细胞内重要细胞器,不但控制着细胞能量的产生,还控制着细胞的钙平衡和细胞凋亡[15]。本研究发现,模型组小鼠脑干中线粒体相关蛋白表达减少,这可能导致三磷酸腺苷的产生减少,从而加速神经元的死亡。
MAPK信号转导途径是一个参与多种生命过程的信号通路,包括细胞生长、迁移、增殖、分化和存活[16]。本研究发现,模型组小鼠脑干中MAPK信号转导途径蛋白表达减少,这可能影响了神经元的正常生物过程,导致神经元功能受损。
综上所述,蛋白组学结果提示,ALS小鼠脑干中存在炎症和纤维化,线粒体功能受损。研究结果提示多种机制参与了ALS小鼠发病。
