绞股蓝多糖对热应激小鼠睾丸氧化损伤的保护作用
2023-11-10张颖蕾陈蕾晓李国艳卓然钟真黄远城唐小川王晓丽
张颖蕾,陈蕾晓,李国艳,卓然,钟真,黄远城,唐小川,王晓丽
(广西大学动物科学技术学院,广西 南宁 530005)
随着全球变暖,气温逐年升高,热应激对于动物机体的生长发育、生理功能等均产生了不利影响,因此寻求缓解热应激的相关研究受到了广泛关注[1-2]。睾丸是雄性动物的生殖器官,参与睾酮的合成、精子的产生等正常生殖生理过程,有研究表明热应激对睾丸生精能力有显著影响[3-4]。绞股蓝多糖(Gynostemmapentaphyllumpolysaccharides,GPP)是葫芦科绞股蓝属植物绞股蓝中的主要活性成分之一,实验室前期研究发现其具有抗衰老、抗氧化和免疫调节等作用[5-6]。但有关绞股蓝多糖对缓解热应激的研究较少,对热应激导致睾丸氧化损伤的保护作用还未见报道。因此,本研究在实验室前期研究基础上,以成年雄性小鼠为试验对象,在相同的热应激条件下,观察绞股蓝多糖对热应激小鼠睾丸氧化损伤的保护作用,为绞股蓝多糖的进一步研究与开发利用提供新的方向与理论依据。
1 材料与方法
1.1 绞股蓝多糖的提取与糖含量测定
绞股蓝原料购自广西中医药大学第一附属医院。洗净、烘干,经粉碎3 cm过筛加工后,避光干燥保存。参考杨勤等[7]文章中提到的方法,实验室水提醇沉法提取绞股蓝多糖,苯酚硫酸法测定绞股蓝多糖含量为 71.1%。
1.2 主要试剂
TUNEL细胞凋亡原位检测试剂盒、总超氧化物歧化酶(T-SOD)测定试剂盒(WST-1 法)、过氧化氢酶(CAT)测定试剂盒(紫外法)、谷胱甘肽过氧化物酶(GSH-PX)测定试剂盒(比色法)、丙二醛(MDA)测定试剂盒(TBA法)、睾酮(TESTO)测试盒均购于南京建成生物工程研究所。雄激素受体(AR)免疫组化试剂盒,购自美国Santa cruz公司。
1.3 实验动物与分组
6周龄,体重(20±0.2)g,SPF级昆明系健康雄性小鼠,购于广西医科大学动物实验中心(许可证编号:SYXK桂2020-0004)50只,饲养于标准鼠笼中,随机将小鼠分为5组:空白对照组(Con)、热应激对照组(HS)、绞股蓝多糖低剂量组(GPP-L)、绞股蓝多糖中剂量组(GPP-M)、绞股蓝多糖高剂量组(GPP-H),每组10只。Con组和HS组每天腹腔注射生理盐水,其余组每天腹腔注射绞股蓝多糖溶液,剂量按体重分别为50 mg/kg (GPP-L)、100 mg/kg(GPP-M)和200 mg/kg (GPP-H),以10 mL/(kg·d)连续给药,连续给药2周后进行连续7 d的热应激,应激条件为38 ℃ 45 min接着42 ℃ 20 min,21 d后处死,按照试验设计采样备用。
1.4 血清睾酮测定及脏器指数计算
小鼠末次用药1 d后眼眶采血,分离血清,采用放射免疫分析法测定血清中睾酮含量,结果以ng/mL表示。处死后75%酒精浸泡消毒后剪开腹腔,取出双侧睾丸分别称重,根据公式,脏器指数=脏器重量(mg)/ 体重(g)×100%,计算睾丸指数。
1.5 曲精小管直径测定
常规石蜡切片,厚5 μm,常规HE染色。光学显微镜(40×)下观察睾丸组织结构形态,拍照。通过Image Pro Plus软件测量睾丸曲精小管直径(每组随机测定20个管径,管径以最长管径与最短管径的平均值为准),记录并分析统计。
1.6 睾丸组织细胞凋亡及雄性激素受体的表达测定
按TUNEL原位凋亡及雄性激素受体(AR)检测试剂盒说明书操作。光镜下(40×)观察组织细胞染色情况,每组随机选取5个视野。利用 Image Pro Plus软件测定所选定视野凋亡细胞、AR阳性细胞累计光密度值(IOD)与视野下睾丸组织的面积(Area),计算各个视野下的凋亡细胞、IOD/Area。
1.7 睾丸组织抗氧化指标测定
取睾丸组织,以重量∶体积为1∶9的比例加入带冰的生理盐水中,采用组织匀浆研磨机研磨各睾丸组织,匀浆后离心,取上清液进行分装,用于试剂盒检测氧化损伤指标丙二醛(MDA)的含量、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的水平。
1.8 数据统计与分析
所有数据都用IBM SPSS Statistics 26统计软件进行统计分析。各指标采用单因素方差分析法(ANOVA)进行多组间数据分析比较,LSD-t检验法进行组间数据分析比较,以P<0.05为差异有统计学意义,数据以“平均数±标准差”来表示。使用Image Pro Plus软件对图片进行分析。
2 结果
2.1 睾丸指数及血清睾酮含量的变化
通过对各组双侧睾丸分别称重并计算睾丸指数,采用放射免疫分析法对各组血清中睾酮含量进行测定,记录数据并统计分析,结果如表1所示,GPP各剂量组睾丸指数与HS组比较均有所增长,但差异不显著。GPP-L和GPP-M组血清睾酮含量与HS组相比均显著升高(P<0.05),GPP-H与HS组无显著差异,但均低于Con组。
2.2 睾丸组织形态学、曲精小管直径的变化
各组睾丸分别进行石蜡切片,HE染色,光学显微镜下观察小鼠睾丸生精小管及各级生精细胞的形态,如图1所示。空白对照组(图1A)睾丸组织形态正常;热应激对照组(图1B)睾丸生精小管生精上皮变薄,生精细胞数量减少,管腔内见到脱落的生精细胞,各级生精细胞排列紊乱,且管腔内精子数目减少;各绞股蓝多糖组(图1C、D、E)生精小管外形较规则,界膜较完整,生精上皮层数增多,生精细胞排列整齐、紧密,生精小管的结构接近于正常组,精子主要聚集在曲精小管的管腔中央,且精子数目较多。
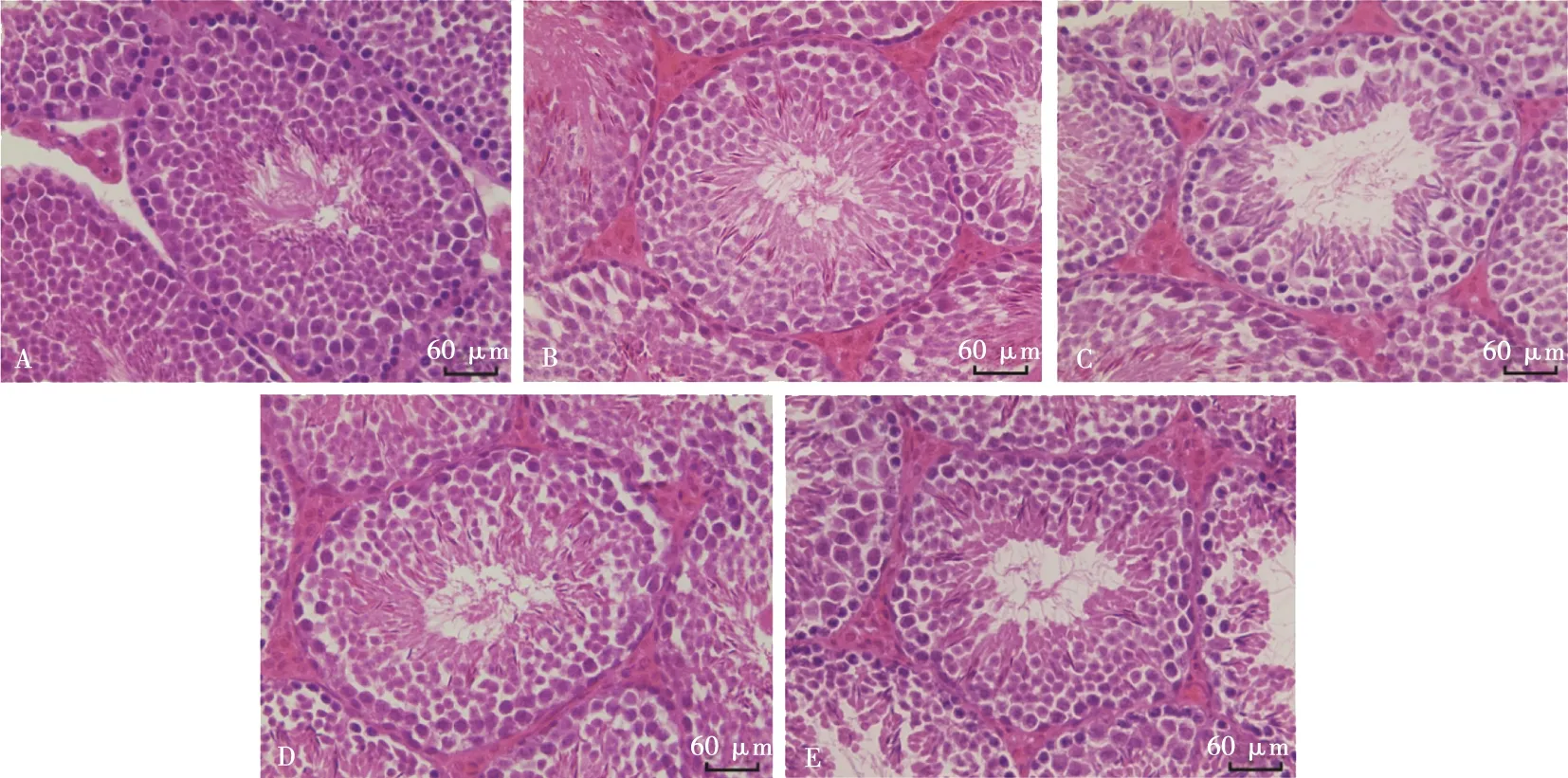
A.Con组;B. HS组;C. GPP-L组;D. GPP-M组;E. GPP-H组。
每组随机对20个曲精小管直径进行测量分析,结果如表2所示。GPP各剂量组睾丸曲精小管直径与HS组相比均显著增大(P<0.05),且GPP-L、GPP-M组曲精小管直径显著低于GPP-H和Con组(P<0.05),GPP-H组曲精小管直径显著高于Con组(P<0.05),GPP-L、GPP-M组间差异不显著。结合形态学观察,表明绞股蓝多糖可以改善热应激引起的睾丸组织结构损伤。

表2 曲精小管直径的变化
2.3 细胞凋亡及AR的表达
经TUNEL原位末端标记后,如图2所示,Con组有少量的细胞凋亡,热应激组凋亡细胞明显增多,各GPP组的凋亡细胞与Con组相比有所增加。经对凋亡细胞IOD/Area进行统计分析,如表3所示,发现HS组凋亡细胞的IOD/Area与Con组相比显著增大(P<0.05),各GPP剂量组IOD/Area数值较HS组均有所减小,其中,GPP-M组数值较HS组显著减小(P<0.05)且与Con组无显著差异,GPP-L、GPP-H与HS组IOD/Area差异不显著。

A.Con组;B. HS组;C. GPP-L组;D. GPP-M组;E. GPP-H组;箭头所指为TUNEL阳性细胞。
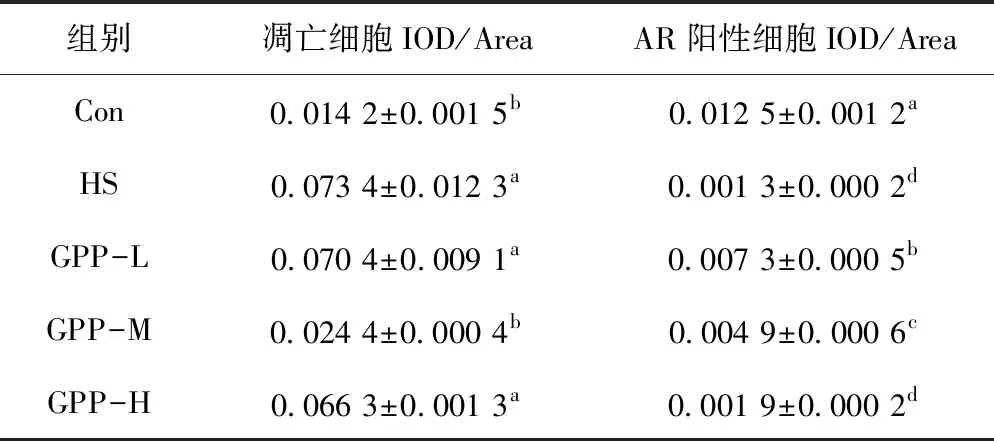
表3 睾丸凋亡细胞IOD/Area、雄性激素受体的变化
经AR免疫组化染色后,如图3所示,AR定位于细胞核,在曲细精管的基底膜处支持细胞以及间质细胞中表达。HS组及各GPP组与Con组相比,AR阳性细胞减少,表达减弱。随机选取5个视野,对AR阳性细胞IOD/Area进行统计分析,如表3所示,发现HS组睾丸组织AR阳性细胞的IOD/Area与Con组相比显著减小(P<0.05),各GPP剂量组IOD/Area较热应激组均有所增大,其中GPP-L和GPP-M组AR表达程度与HS组相比显著增强(P<0.05)。
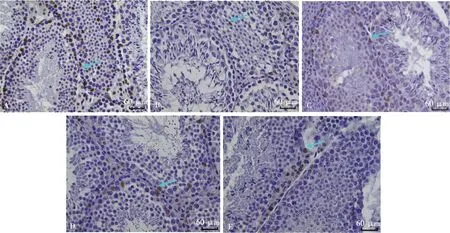
A. Con组;B. HS组;C. GPP-L组;D. GPP-M组;E. GPP-H组;箭头所指为TUNEL阳性细胞;箭头所指为AR阳性细胞。
2.4 睾丸组织抗氧化指标的变化
通过分光光度法,分别对睾丸组织中MDA、GSH-PX含量及SOD和CAT活力进行检测,结果见表4,GPP-M和GPP-L组的MDA含量与HS组相比显著降低(P<0.05),但高于Con组;GPP-M和GPP-L组的GSH-Px含量、CAT活力、SOD活力与HS组相比显著升高(P<0.05),但均低于Con组;GPP-H组的CAT活力、SOD活力与HS组相比显著升高(P<0.05)。
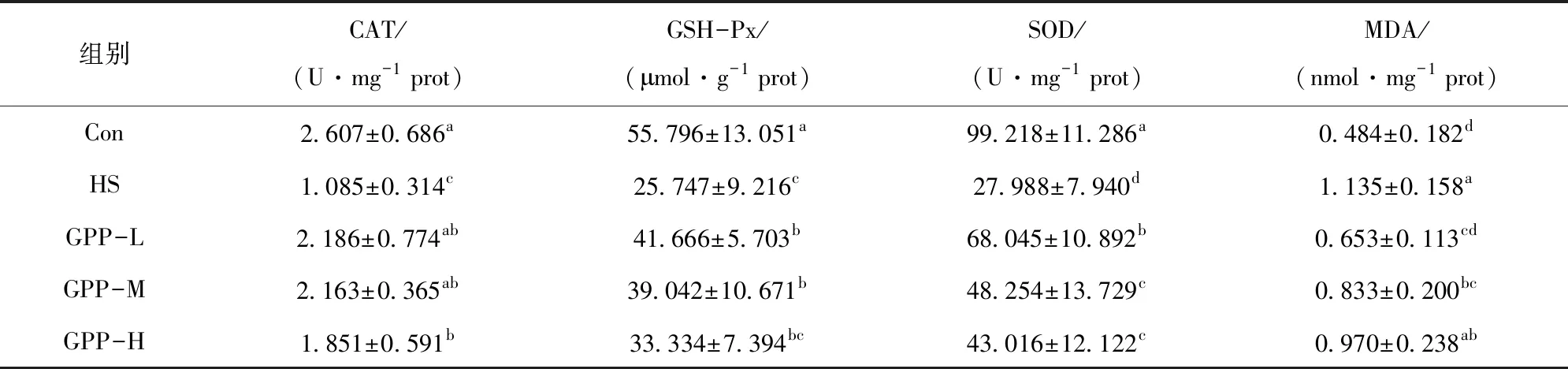
表4 睾丸组织CAT、GSH-Px、SOD、MDA含量的变化
3 讨论
睾丸对温度非常敏感,有研究表明,热应激可导致睾丸萎缩,睾丸指数变小[7]。睾丸形态和睾丸指数是睾丸健康情况的重要指标之一。刘慧娟等[2]在热应激小鼠日粮中添加芦丁,发现其可以提高热应激小鼠睾丸指数,显著增加热应激小鼠生精小管直径,降低热应激小鼠生精细胞脱落比率;高琛等[4]发现热应激可以导致小鼠睾丸系数降低,诱导小鼠睾丸组织结构损伤,黄芩苷可提高热应激小鼠睾丸指数,减轻热应激造成的小鼠睾丸损伤;吴璟等[8]给热应激小鼠灌胃葫芦巴碱,发现其能够明显改善热应激对小鼠睾丸的损伤程度,生精小管各级层数明显增多,生精细胞排列整齐。本研究也发现GPP可以提高热应激小鼠睾丸指数,显著增加热应激小鼠曲精小管直径,改善热应激对小鼠睾丸的损伤程度-曲精小管外形较规则,界膜较完整,生精上皮层数增多,生精细胞排列整齐、紧密,精子主要聚集在曲精小管的管腔中央。
雄性动物睾丸间质细胞合成和分泌的睾酮,能调控生殖细胞、器官生长发育成熟,促进精子发生,维持雄性正常生殖活动及第二性征[9]。有研究表明,热应激可以抑制睾酮的生成[1]。而黄晓兰等[10]通过研究发现,枸杞多糖能够改善高温引起的血清睾酮浓度降低,对受热损伤的雄性大鼠生殖系统具有良好的保护作用。姜志洋等[11]发现日粮中添加姜黄素和槲皮素可降低夏季热应激对湖羊睾酮分泌的影响。本研究也发现GPP-L组和GPP-M组均可显著提高血清睾酮含量,表明GPP能够改善热应激引起的血清睾酮下降,对热应激造成的睾丸生殖生理功能受损具有一定的保护作用。
在性激素调节过程中,下丘脑-垂体-性腺轴是最直接、最主要的调控方式,睾酮通过AR介导从而发挥功能。马瑞[12]研究发现,AR表达水平受睾酮浓度的调控,且呈时间和剂量依赖性。还有研究表明,应激会引起AR表达水平下调[13]。由此推测,睾酮浓度下降,为了适应睾酮浓度的变化产生了负反馈调节,AR蛋白表达水平下降。本研究也验证了这一点,GPP-L和GPP-M组AR表达程度较HS组均显著增强,说明GPP能够改善热应激小鼠睾丸AR蛋白的表达。
Paul等[14]发现高温可引起生精细胞凋亡增加,谭秋慧等[15]也发现热应激后凋亡阳性细胞明显增多。而邓琦等[16]研究发现绞股蓝多糖对MPP+诱导的PC12细胞凋亡有一定的保护作用。蔡冬宝[17]发现矢车菊素-3-O-葡萄糖及其代谢产物PCA均可缓解热应激造成的生精细胞凋亡。本研究也发现,热应激组凋亡细胞明显增多,GPP组凋亡细胞有所减小,其中GPP-M组显著减小,表明在热应激情况下小鼠睾丸细胞凋亡加剧,经过GPP处理后小鼠睾丸的细胞凋亡得到一定的缓解。
MDA是众多脂质过氧化产物的分解产物,MDA的含量反映机体或组织内脂质过氧化程度[18]。CAT、GSH-Px、SOD 3种酶是机体清除自由基的重要组分,三者具有协同作用,能够清除生物体代谢产生的自由基和H2O2,共同组成了细胞内的抗氧化酶防御系统[19-20]。高琛等[4]发现腹腔注射黄芩苷能够抑制热应激小鼠睾丸组织中MDA含量的升高,拮抗热应激引起的SOD、GSH-PX、CAT 3种酶的活力降低。曾新斌等[21]研究发现,饲粮中添加中剂量的牡蛎粗多糖能够显著提高小鼠血液中SOD和GSH-Px的活性,显著降低MAD活性,改善了应激状态下小鼠的生化指标,具有缓解热应激的作用。秦芹等[22]研究发现,山茱萸多糖能显著降低高温暴露大鼠睾丸组织中MDA含量,提高SOD活性,具有一定抗氧化损伤作用。本研究也发现 GPP-M组和GPP-L组的MDA含量显著降低,GSH-Px含量、CAT活力、SOD活力显著升高,抗氧化酶活力恢复,提示绞股蓝多糖对热应激引起的睾丸氧化损伤具有一定的保护作用。
4 结论
GPP可以有效抵制热应激引起的睾丸组织损伤和细胞凋亡,保护AR蛋白的正常表达以及提高热应激小鼠睾丸抗氧化能力,其中100 mg/kg GPP效果较明显。
