牛传染性鼻气管炎gE基因TaqMan-MGB与SYBR Green Ⅰ实时荧光定量PCR方法的建立及应用
2023-11-10袁浩芳朱晓晖张雨李焱李可伟胡剑武李家奎
袁浩芳,朱晓晖,张雨,李焱,李可伟,胡剑武,2,李家奎*
(1. 华中农业大学动物科学技术学院动物医学院,湖北 武汉 430070;2. 西藏自治区农业农村厅兽医局,西藏 拉萨 850000)
牛传染性鼻气管炎(infectious bovine rhinotracheitis,IBR)是牛感染牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus,IBRV)引起的急性、接触性传染病,临床又称“红鼻病”。IBRV在机体内分布极为广泛,可感染多种组织和器官,引起多种临床表现,常表现为高热、呼吸困难、呼吸道黏膜损伤,也可导致生殖道损伤如母畜阴道炎、流产,公畜包皮龟头炎等,偶见犊牛出现神经症状,肌肉震颤、共济失调,病程严重者亦会死亡[1-3]。该病被世界动物卫生组织(WOAH)列为必须通报的动物疫病,在中国被列为二类动物疫病[4-5]。2014年对青海地区的牦牛血清流行病学调查显示,牦牛感染IBRV的阳性率为44.64%[6];2019年苏中华等[7]检测西藏地区牦牛的IBR血清抗原平均阳性率达10%。可见该病在牦牛群体中流行广泛,制约了牦牛产业的发展。
IBR会造成免疫抑制、潜伏感染、终生带毒,从而导致病牛终生排毒,极难控制,难以实现群体净化[8]。尽管该病在一些欧洲发达国家已经完全被根除,但在我国,因为对该病没有有效的治疗方法,对牛鼻气管炎的预防措施仍然主要依靠疫苗接种。因此,建立能够早期特异性诊断IBR的方法将极大地提高疫苗接种的效率,对IBR的防控意义重大。IBRV基因组编码70个左右的蛋白,包括11种糖蛋白,近年来血清学检测方法的快速发展,针对血清中gB、gD、gE、gG、gL等糖蛋白特异性抗体的ELISA检测方法已在实验室得到了初步运用[9-14]。PCR方法是实验室常用的检测手段之一,徐娜等[15]基于gB和gE基因建立了普通双重PCR方法,在传统检测单基因基础上提高了准确率;曲光刚等[16]在2012年就基于gB基因建立了TaqMan探针荧光定量PCR方法,后续李东丽[17]、任强林[18]在此基础上选择gB保守区域设计引物,对该方法进行了改进。除此之外,王亚新等[19]基于gB基因设计引物建立了SYBR Green Ⅰ荧光定量PCR方法;任亚初等[20]根据gD基因设计了相应的SYBR Green Ⅰ荧光定量PCR方法,随后王倩颖等[21]根据gD基因保守序列优化了该方案。gE基因在IBRV基因组中高度保守,可作为PCR检测时的靶点。唐泰山等[22]根据gE基因完整序列设计了TaqMan探针荧光定量PCR方法,SYBR Green Ⅰ荧光定量PCR法尚未有报道。目前常用的IBR基因缺失疫苗为gE缺失苗,因此建立针对IBRVgE基因的检测方法,可筛选牛群中经过基因缺失疫苗免疫和野毒感染的牛,为IBR感染牛只的淘汰及牛群IBR的净化提供有效手段。
本研究基于gE基因的保守序列设计了MGB探针和特异性引物,构建了TaqMan-MGB和SYBR Green Ⅰ荧光定量PCR方法,旨在建立快速准确的IBRV检测方法,为牛传染性鼻气管炎的防控提供参考。
1 材料与方法
1.1 病毒株和样品来源
IBRV、牛副流感病毒3型(bovine parainfluenza virus type 3,BPIV3)、巴氏杆菌、牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)等相关病毒及菌株均为本实验室保存。130份牦牛鼻拭子样品来自西藏。
1.2 主要试剂
AceQ Universal U+ Probe Master Mix V2,AceQ Universal SYBR qPCR Master Mix,2 × Phanta Max Master Mix (Dye Plus),病毒基因组DNA/RNA提取试剂盒,FastPure®Gel DNA Extraction Mini Kit,质粒小提试剂盒,大肠杆菌DH5α感受态细胞,均购自南京诺唯赞生物科技有限公司;BM2000+ DNA Marker及GL DNA Marker 2000,分别购自北京博迈德基因技术有限公司及艾科瑞生物科技有限公司。
1.3 引物与探针的设计与合成
下载GenBank中IBRV的gE基因序列(GenBank:MK035760.1),通过Primer 5.0软件设计TaqMan荧光引物1对,F1:5′-GCCGTACCACTCCCACGTA-3′,R1:5′-TCGATGCTGGCCGAGAAG-3′,及探针Probe:5′-FAM-ATTCCTTTCTGCTATCGGT-MGB-3′,扩增目的片段大小为100 bp;SYBR Green Ⅰ荧光引物1对,F2:5′-GCCAGTTAGCGACGACGAAT-3′,R2:5′-ACTTTGAACCCAGAGCGACT-3′,扩增目的片段大小为186 bp;常规PCR引物1对,F3:5′-GTGTACTTCCTGTACGACCG-3′,R3:5′-CTTGAGTCGCGCTGCTACCA-3′,扩增目的片段大小为1 245 bp;参照王亚新等[19]建立的SYBR Green Ⅰ荧光定量PCR方法合成引物F4:5′-CGTGACGGTAGCCTGGGACT-3′,R4:5′-CGTCTCGCAGCATTTCGTC-3′。引物与探针均由擎科生物技术有限公司合成。
1.4 重组质粒标准品的制备
利用病毒基因组提取试剂盒,提取200 μL IBRV病毒原液DNA作为模板,F3/R3为引物,进行PCR扩增,1%琼脂糖凝胶电泳对扩增产物进行检测,检测无误后将目的片段回收,使用5 min TA/Blunt-Zero Cloning Kit快速克隆试剂盒进行纯化产物的连接,测序鉴定重组质粒序列正确后,测定重组质粒浓度,并使用以下公式将重组质粒的浓度转换为重组质粒的拷贝数:拷贝数=质粒浓度×109×6.02×1023/(660×质粒长度),并作为阳性标准品,命名为pCE2-gE,于-80 ℃保存。
1.5 荧光定量PCR反应程序及体系优化
制备20 μL以pCE2-gE为模板的反应体系。通过控制单一变量,对探针和引物浓度进行优化,并且设置不同的退火温度,根据扩增曲线Ct值最小、荧光值融解曲线单一且最高和特异性最明显为标准,确定最佳反应条件。
1.6 标准曲线的建立
将重组质粒标准品pCE2-gE稀释至1×1010copies/μL后再10倍梯度稀释至1×100copies/μL,获得1×1010~1×100copies/μL系列标准模板,利用已确定的最佳反应条件进行探针法和染料法荧光定量PCR扩增,以起始模板量拷贝数的稀释倍数作为横坐标,Ct值作为纵坐标绘制标准曲线。
1.7 特异性试验
分别以BVDV、BPIV-3、巴氏杆菌及IBRV的核酸为模板,以ddH2O为阴性对照,采用已建立的探针法和染料法荧光定量PCR进行扩增,分析该方法的特异性。
1.8 敏感性试验
以1.6中的系列标准质粒为模板,对照组使用ddH2O,每个模板浓度做3个重复,用已建立的探针法和染料法荧光定量PCR进行扩增,获得2种检测方法的最低检测限。
1.9 重复性试验
批内重复性试验:模板为5份不同稀释度pCE2-gE质粒,设置空白对照,进行荧光定量PCR检测,每份样品做3个重复,分析Ct值的标准差(S)和变异系数(CV)来确定批内重复性。
批间重复性试验:模板为5份不同稀释度pCE2-gE质粒,设置空白对照,进行荧光定量PCR检测,每间隔7 d重复1次共进行3次重复,分析Ct值的S和CV来确定批间重复性。
1.10 荧光定量 PCR 临界值的确定
取检测最低限质粒30份,用建立的荧光定量PCR方法进行检测,对Ct值计算平均值M和标准差SD。根据统计学规律,该方法的临界值为:阳性临界值=M-3SD,可疑区间为M±3SD[23]。
1.11 临床样品的检测
为比较2种荧光定量检测方法的临床应用性能,分别用本试验建立的2种荧光定量方法和王亚新等[19]建立的IBRV SYBR Green Ⅰ PCR方法对临床上收集的疑似感染IBRV的牦牛病料进行检测,比较不同检测方法的检出率及符合率。
2 结果
2.1 重组质粒标准品的制备
将提取的IBRV DNA作为模板,分别用F1/R1、F2/R2、F3/R3这3对引物进行PCR扩增,得到大小分别约为100 bp(图1A)、186 bp(图1B)和1 245 bp(图1C)的3条目的片段,与预期片段大小相符。经测序验证,重组质粒序列完整无误,质粒标准品pCE2-gE构建正确。扩菌后提取质粒,pCE2-gE的质粒浓度为396 ng/μL,经计算拷贝数为6.943×1010copies/μL。
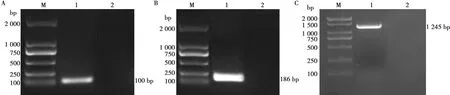
M. DM2000+ DNA Marker;1. 目的片段;2. 阴性对照。
2.2 荧光定量PCR反应程序及体系优化
通过单一变量法改变反应体系中引物和探针浓度、退火温度,确定最终的反应条件。
TaqMan荧光定量PCR法反应体系:2 × AceQ Universal U+ Probe Master Mix V2 10.0 μL,上、下游引物(F1/R1)各0.4 μL,IBRV DNA 模板为2 μL,探针0.2 μL,用ddH2O补足至20 μL。反应程序:37 ℃ 2 min;95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s,共45个循环。
SYBR Green Ⅰ荧光定量PCR法反应体系:2 × AceQ Universal SYBR qPCR Master Mix 10.0 μL,上、下游引物(F2/R2)各0.4 μL,IBRV DNA模板2 μL,用ddH2O补足至20 μL。反应程序:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s,共40个循环。
2.3 SYBR Green Ⅰ荧光定量PCR溶解曲线
使用建立的SYBR Green Ⅰ荧光定量PCR方法扩增重组质粒pCE2-gE,可见溶解曲线中,在89 ℃左右扩增产物均出现单峰(图2),表明扩增体系有特异性。
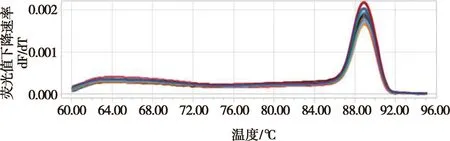
图2 SYBR Green Ⅰ荧光定量 PCR 溶解曲线
2.4 标准曲线的建立
以1.0×103~1.0×1010copies/μL的标准质粒为模板分别用2种荧光定量PCR方法进行检测并绘制标准曲线,其中,X轴为标准质粒稀释倍数,Y轴为读取的Ct值。
结果显示,探针法扩增相关系数R2为0.994,标准曲线方程为:y=-3.169 8x+44.153(图3A);染料法扩增相关系数R2为0.999,标准曲线的方程为:y=-3.756 1x+34.909(图3B)。

A. TaqMan荧光定量PCR标准曲线;B. SYBR Green Ⅰ荧光定量PCR标准曲线。
2.5 特异性试验
用建立的2种荧光定量PCR方法对IBRV、巴氏杆菌、BVDV和BPIV-3的核酸进行检测,结果显示,仅IBRV出现特异性扩增,表示建立的2种荧光定量PCR方法特异性良好(图4A和图4B)。

A.TaqMan 荧光定量PCR;B. SYBR Green Ⅰ荧光定量PCR。1. IBRV,2~5. 分别为BVDV、BPIV-3、巴氏杆菌、阴性对照。
2.6 敏感性试验
用本试验建立的2种荧光定量PCR法分别对1.0×101~1.0×1010copies/μL 10×倍比稀释的重组质粒pCE2-gE进行检测。
结果显示,探针法能检测到的最低浓度为1.0×101copies/μL(图5A),染料法能检测到的最低浓度为1.0×102copies/μL(图5B),探针法敏感性是染料法的10倍。结果表明,本研究建立的荧光定量PCR方法灵敏度高,且TaqMan荧光定量PCR法较SYBR Green Ⅰ荧光定量PCR法敏感性更高。

A. TaqMan荧光定量PCR法;B. SYBR Green Ⅰ荧光定量PCR法。1~11. 标准质粒浓度分别为1.0×1010~1.0×100 copies/μL;12. 阴性对照。
2.7 重复性试验
TaqMan-MGB荧光定量PCR法:以连续5个稀释倍数的重组质粒pCE2-gE为模板分别进行组内和组间重复性试验,结果显示组内和组间Ct值变异系数(CV)分别为0.75%~2.02% 和0.42%~2.30%(表1)。
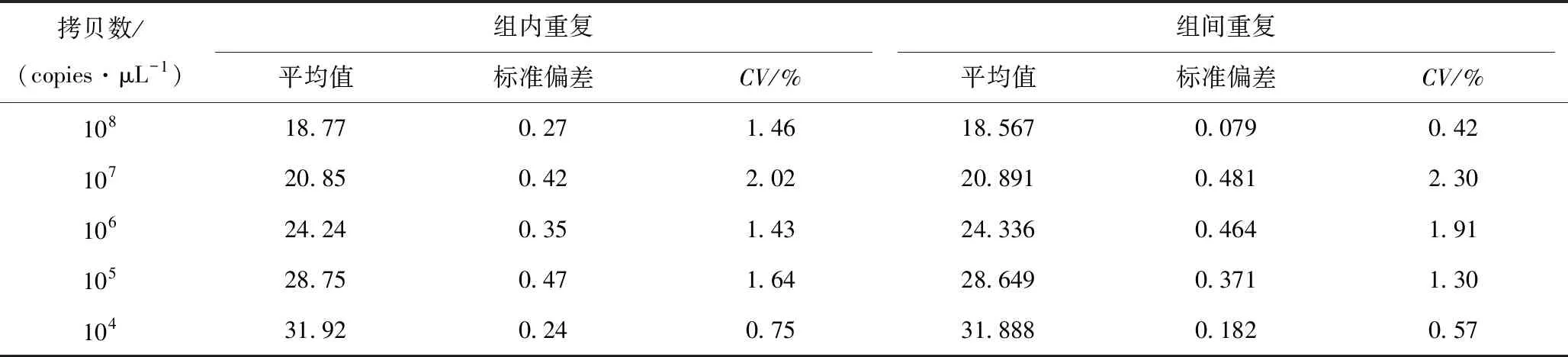
表1 TaqMan荧光定量PCR法的重复性试验结果
SYBR Green Ⅰ荧光定量PCR法:以连续5个稀释倍数的重组质粒pCE2-gE为模板分别进行组内和组间重复性试验,结果显示组内和组间Ct值变异系数(CV)分别为0.82%~1.90%和0.75%~1.95%(表2)。
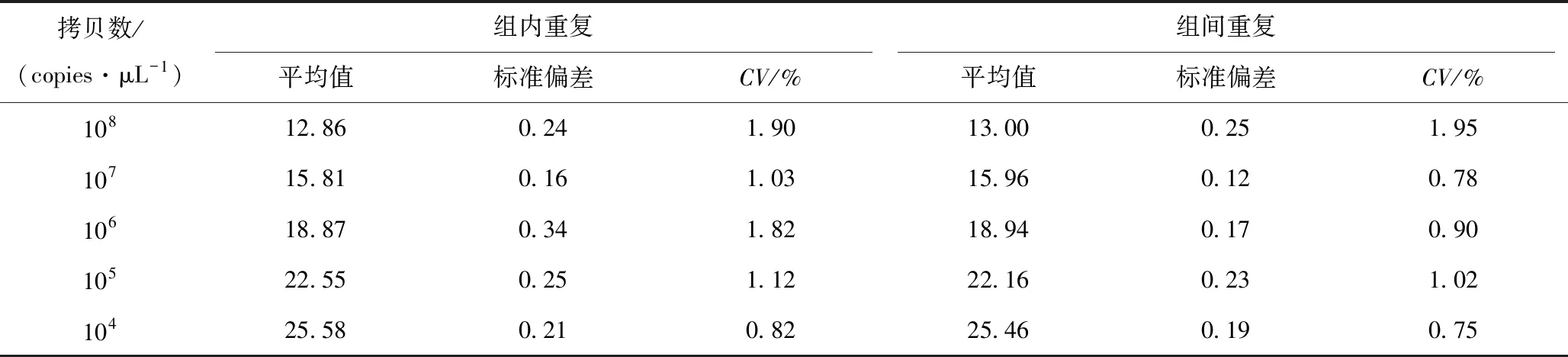
表2 SYBR Green Ⅰ荧光定量PCR法的重复性试验结果
以上结果显示2种方法的CV值均小于2.3%,具有良好的可重复性。
2.8 荧光定量PCR临界值的确定
取检测最低限质粒30份,分别用建立的2种荧光定量PCR方法进行检测,计算Ct值的平均值和标准差。探针法平均值和标准差分别为35.25和0.39,根据统计学规律计算:阴性临界值为M-3SD=34.08;可疑区间为M±3SD=34.08~36.42。染料法的平均值与标准差分别为33.79和0.40,根据统计学规律计算:阴性临界值为M-3SD=32.59;可疑区间为M±3SD=32.59~34.99。
使用建立的探针法荧光定量PCR检测时,当Ct<34.08并且扩增曲线规则判定为阳性;当34.08 使用建立的染料法荧光定量PCR检测时,当Ct<32.59并且扩增曲线规则判定为阳性;当32.59 使用建立的2种荧光定量PCR检测法分别对收集的130份疑似IBRV病料进行检测,探针法检出Ct值为28.19~34.57,130份样品均为阳性,检出率为100%;染料法检出Ct值为29.1~32.53,130份样品均为阳性,检出率为100%,2种荧光定量PCR方法的检测符合率为100%;使用王亚新等[19]建立的荧光定量检测方法检测出阳性130份,检出率为100%。结果表明,本试验建立的检测方法与已成功发表的检测方法检测符合率100%。 由于缺乏有效治疗措施,IBR自1980年在国内报道后就一直是我国重点监测的动物疫病之一[24]。防控本病的关键在于带病牛的及时检出和处理。牦牛粗放散养的养殖模式使得样本采集难度提高,相比之下鼻咽拭子要便于血清采集。因此,本试验设计IBRV检测方法时首选PCR法检测抗原。本研究基于IBRV的保守基因gE设计了引物,分别对反应条件进行优化后,建立了2种荧光定量PCR方法。敏感性试验结果显示,TaqMan荧光定量PCR法与SYBR Green Ⅰ荧光定量PCR法可检测到的最小质粒浓度分别为1.0×101copies/μL和 1.0×102copies/μL。王亚新等[19]建立的针对gB基因的SYBR Green Ⅰ荧光定量检测方法最低检测限为5.747×102copies/μL;王倩颖等[21]建立的针对gD基因SYBR Green Ⅰ光定量检测方法最低检测限为4.8×100copies/μL;刘占悝等[25]建立的针对IBRV SYBR Green Ⅰ实时荧光定量PCR检测方法最低检测限为3.04×101copies/μL;张喜喜[26]建立的SYBR Green Ⅰ荧光定量和TaqMan探针荧光定量检测方法最低检测限为1.0×102copies/μL。综合比较而言,本试验建立的2种荧光定量PCR方法灵敏度较好,具备转化成快速准确的临床检测试剂盒的潜力。目前国内的IBRV检测试剂多用于血清抗体检测,缺乏商品化的鼻咽拭子抗原检测试剂盒。本次试验所检测的临床样本为IBR疑似样品,检测的结果不代表真实感染率,但经与王亚新等[19]在2022年建立的IBRVgB基因的SYBR Green Ⅰ检测方法进行对比,3种方法阳性检出率均为100%,阳性检出符合率为100%,表明试验结果仍具有参考价值。2.9 临床样品的检测
3 讨论
