基于UHPLC-Q-TOF-MS整合网络药理学探讨青娥丸效应成分及抗抑郁作用机制
2023-11-10马程遥宋珊珊王一清戴国梁许美娟居文政
马程遥, 宋珊珊, 王一清, 赵 权, 3, 戴国梁, 许美娟, 居文政
(1. 南京中医药大学附属医院 临床药理科,江苏 南京 210029;2. 南京中医药大学博士后流动站,江苏 南京 210023;3. 南京中医药大学常州附属医院 药学部,江苏 常州 213003)
抑郁症是全球普遍的情感障碍疾病,属中医“郁症”范畴,中医师多从肝论治,而仝小林院士采用补肾阳之法,另辟蹊径,从肾论治[1]。肾者,属水,主藏志,抑郁症的精力减退,认知迟钝,失眠健忘等均符合肾虚症状。青娥丸为补肾助阳之良方,由杜仲、补骨脂、核桃仁和大蒜组成,本课题组前期研究证实,青娥丸可显著改善慢性不可预见性温和刺激(chronic unpredictable mild stress,CUMS)大鼠的抑郁样行为[2]。
网络药理学是系统生物学分支之一,其通过构建“成分-靶点-疾病”的多层次网络,形象地反映中药“多成分、多靶点、多途径”的起效特点,直观地阐明药物的作用机制,对揭示中药及其复方发挥疗效的内在机制有着重要贡献[3]。本研究通过液质联用技术识别入血成分,在此基础上结合网络药理学预测干预靶点,通过分子对接和蛋白免疫印迹综合验证,研究青娥丸中具有抗抑郁效用的潜在化学成分及其作用靶点。
1 材料与方法
1.1 药品与试剂盐杜仲(贵州,20210302-01,贵州同德药业)、盐补骨脂(云南,210401,马鞍山井泉中药)、核桃仁(山西,21010615,安徽协和成药业)、大蒜(山东,210613,南京侯家桥农贸市场);京尼平苷酸(Z24A10X95926),补骨脂素(091019),异补骨脂素(091104),含量均≥ 98%,购自上海源叶生物;乙醇(分析纯)、甲醇(色谱纯)、乙腈(色谱纯);ERα、ERβ抗体(英国Abcam);GAPDH抗体(美国Proteintech)。
1.2 仪器UHPLC-Q-TOF-MS系统:Agilent 1290超高性能液相色谱仪(美国Agilent),Triple-TOF 5600质谱系统(美国AB Sciex);Biofuge PrimoR冷冻高速离心机(德国Heraeus);Drict-Q超纯水机(法国Millipore);Centri Vap离心浓缩仪(Labconco公司);HB-202恒温金属浴(杭州博日);4600化学发光图形分析系统(上海天能)。
1.3 动物SD雄性大鼠(SPF级,200 ± 20 g),由南京青龙山动物繁殖场提供,并严格按照南京中医院大学附属医院伦理标准执行(No 21DW-16-01)。
1.4 方法
1.4.1青娥丸入血成分分析
1.4.1.1 青娥丸提取液的制备 青娥丸组方为盐杜仲480 g,盐补骨脂240 g,核桃仁150 g,大蒜120 g。加8倍量水回流提取2次,每次2 h,将两次提取液合并,纱布过滤,浓缩至1 mL药液相当于生药1 g,于4 ℃储存备用。
1.4.1.2 青娥丸含药血浆的制备 4只SD大鼠,经适应性喂养后,随机分为对照组和给药组,每组2只。连续3 d,每12 h灌胃11.22 g·kg-1生药量的青娥丸提取液(6倍量临床等效剂量)。末次给药前,禁食12 h,并于0.5、1、3 h时分别眼眶取血,合并给药组的各时间点血样,4 000 r·min-1离心10 min,取血浆-80 ℃储存,备用。
1.4.1.3 血浆样品的前处理 取血浆200 μL,加入800 μL甲醇,涡旋1 min,12 000 r·min-1离心10 min,取上清液,40 ℃离心浓缩。残渣加入100 μL 50%甲醇,涡旋复溶,12 000 r·min-1离心10 min 取上清液,再次离心取上清,进行UPLC-Q-TOF-MS分析。
1.4.1.4 液相条件 色谱柱:Agilent SB C18(4.6×100 mm,1.8 μm);流动相:A: 0.1%甲酸水溶液,B:甲醇 ∶乙腈=1 ∶1(V/V),梯度洗脱,流速0.4 mL·min-1,柱温:40℃。梯度洗脱程序:0~2.5 min, 15%~20% B; 2.5~7.0 min, 20%~25% B; 7.0~12.0 min, 25%~50% B; 12.0~19.0 min, 50%~90% B; 19.0~21.0 min, 90% B; 21.0~28.0 min, 90%~60%; 28.0~31.0 min, 60%~15% B; 31.0~35.0 min, 15% B。
1.4.1.5 质谱条件 ESI源正、负离子扫描,离子源温度550 ℃。负离子源电压分别为-4 500 V,DP: 80 V, CUR: 20, CE: 10 eV;二级质谱数据采集,DP: 100V, CE: 25 eV, CES: 15。正离子源电压分别为5 500 V,DP: 100 V. CUR: 20, CE: 10 eV;二级质谱采集,DP: 100 V, CE: 30 eV, CES: 15。
1.4.2网络药理学分析
1.4.2.1 药物入血成分靶点预测 借助PharmMapper (http://www.lilab-ecust.cn/pharmmapper/)平台,结合PubChem (https://pubchem.ncbi.nlm.nih.gov/) 报道的成分相关基因,对鉴别出的入血成分进行靶点预测。应用STRING (https://cn.string-db.org/) 数据库规范预测的靶点和基因,获得统一基因名。
1.4.2.2 抑郁症相关靶点的获取 在数据库DisGeNET (degree >0.33, https://www.disgenet.org/home/) 和 GeneCards (degree >3, https://www.genecards.org/) 以关键词“Major depressive disorder”和“Depressive Disorder”进行检索,得到抑郁症的潜在治疗靶点。取疾病-靶点和入血成分干预靶点的交集,获得青娥丸入血成分的抗抑郁效应靶点。
1.4.2.3 青娥丸入血成分-抑郁症靶点拓扑分析 将上述筛选到的青娥丸改善抑郁症的靶点与成分相关联,应用Cytoscape软件构建青娥丸入血成分-抗抑郁靶点网络,并用“Network Analyzer”对该网络进行拓扑分析,获取核心活性成分(degree >10)和重要起效靶点(degree ≥ 3)。
1.4.2.4 GO生物进程及KEGG通路分析 基于R 4.1.2中的ClusterProfiler包,以P<0.05、Q<0.2,对核心靶点进行GO生物进程和KEGG富集分析。
1.4.2.5 核心成分-靶点-通路分析 基于R中的Circlize包绘制和弦图,分析KEGG通路-靶点-核心成分的对应关系,筛选出多成分调控且涉及多个通路的核心靶点,以及多成分调控且仅针对某一通路的关键靶点。
1.4.2.6 分子对接验证 选择成分-靶点-通路分析分析中筛选出的核心靶点和关键靶点蛋白,运用Autodock vina软件进行分子对接,预测成分与靶点蛋白的亲和作用,并基于R中的pheatmap包绘制分子与蛋白的结合能热图。
1.4.2.7 蛋白免疫印迹验证 取课题组前期青娥丸干预CUMS抑郁模型大鼠实验的海马样本[2],于冰上RIPA研磨裂解,BCA法定量,加入蛋白上样缓冲液(5×)金属浴变性。使用12%的SDS聚丙烯凝胶进行电泳,经转膜、封闭后,于4 ℃孵育一抗过夜:ERα、ERβ(1 ∶10 000),GAPDH(1 ∶5 000)。次日,TBST洗膜3次,室温孵育二抗(1 ∶5 000)1 h,再经TBST洗膜3次,加入现配的ECL显影液,于凝胶成像仪扫描成像。
2 结果
2.1 青娥丸提取物入血成分分析在上述色谱、质谱条件下,应用UHPLC-Q-TOF-MS获取相应的色谱质谱数据,根据准确相对分子量推测化合物的分子式,通过对已有文献报道的青娥丸所含药味的成分[4-5],进行二级质谱匹配,共指认入血的外源性峰15个,识别出青娥丸所含成分18个,包括京尼平苷酸、补骨脂苷、异补骨脂苷、补骨脂素、异补骨脂素等,见Tab 1。
2.2 网络药理学预测结果
2.2.1青娥丸入血成分治疗抑郁症靶点筛选 通过PharmMapper平台结合PubChem数据库,对鉴别出的18个潜在入血成分进行靶点预测,去除重复靶点后,共得到青娥丸入血成分潜在靶标404个。通过GeneCards和DisGeNET数据库,共检索到254个潜在抗抑郁靶点。将入血成分的靶点与干预疾病的潜在靶点进行Venn分析,共得到50个可能与青娥丸入血成分防治抑郁症的相关靶点。
2.2.2核心靶点和关键成分的拓扑分析 将上述筛选到的青娥丸改善抑郁症的靶点对应回成分,应用Cytoscape软件构建成分-靶点网络,见Fig 1,并经“Network Analyzer”功能进行拓扑分析,圆形代表靶点,八边形代表入血成分。degree值越大,则形状越大、颜色越偏深红,代表与其相关联的靶点/成分越多,越可能是潜在的重要活性成分或抗抑郁靶点。

Tab 1 Identification analysis on drug-containing plasma of Qing’e Pill
*为与标准品比对后,鉴别出的成分;E. u:杜仲(EcomomiaulmoidesOliv);P. c:补骨脂(PsoraleacorylifoliaLinn.)
由Fig 1可见,拓扑分析筛得EGFR、ESR2、ESR1、PDE4B、AR等共计26个重要靶点 (degree ≥ 3),用于进一步GO、KEGG富集分析;成分筛选可见,京尼平苷酸、异补骨脂素、大豆苷元等9个入血成分 (degree >10) 能影响更多的潜在抗抑郁靶点蛋白,在青娥丸发挥抗抑郁作用的过程中扮演重要角色。
2.2.3GO生物进程分析及KEGG通路富集分析 GO生物进程分析见Fig 2A,可得知交集基因主要涉及对异种刺激的反应、对凋亡信号通路的负调控、对类固醇激素的反应、对脂多糖的反应和对凋亡信号通路的调控等生物过程;KEGG富集分析结果如Fig 2B所示,可知青娥丸主要通过PI3K-Akt、HIF-1、FoxO、雌激素和MAPK等信号通路,发挥抗抑郁效用。
2.2.4青娥丸入血成分-靶点-通路关系分析 经Circlize绘制和弦图Fig 3,可知靶点EGFR、AKT1均受多个关键成分调控,且参与PI3K-AKT、HIF-1、FoxO、MAPK和JAK-STAT等多个信号通路,推测为青娥丸发挥抗抑郁作用的核心靶点;而ESR1、ESR2受众多成分调控,仅参与雌激素通路,推测为青娥丸干预抑郁症的关键靶点。
2.2.5分子对接 将上述筛出的核心成分分别与核心/关键靶点进行分子对接,证实成分对靶点的调控能力,见Fig 4。结果显示的结合能越小,则配体和受体结合力越强。

Fig 1 Constituent-target network
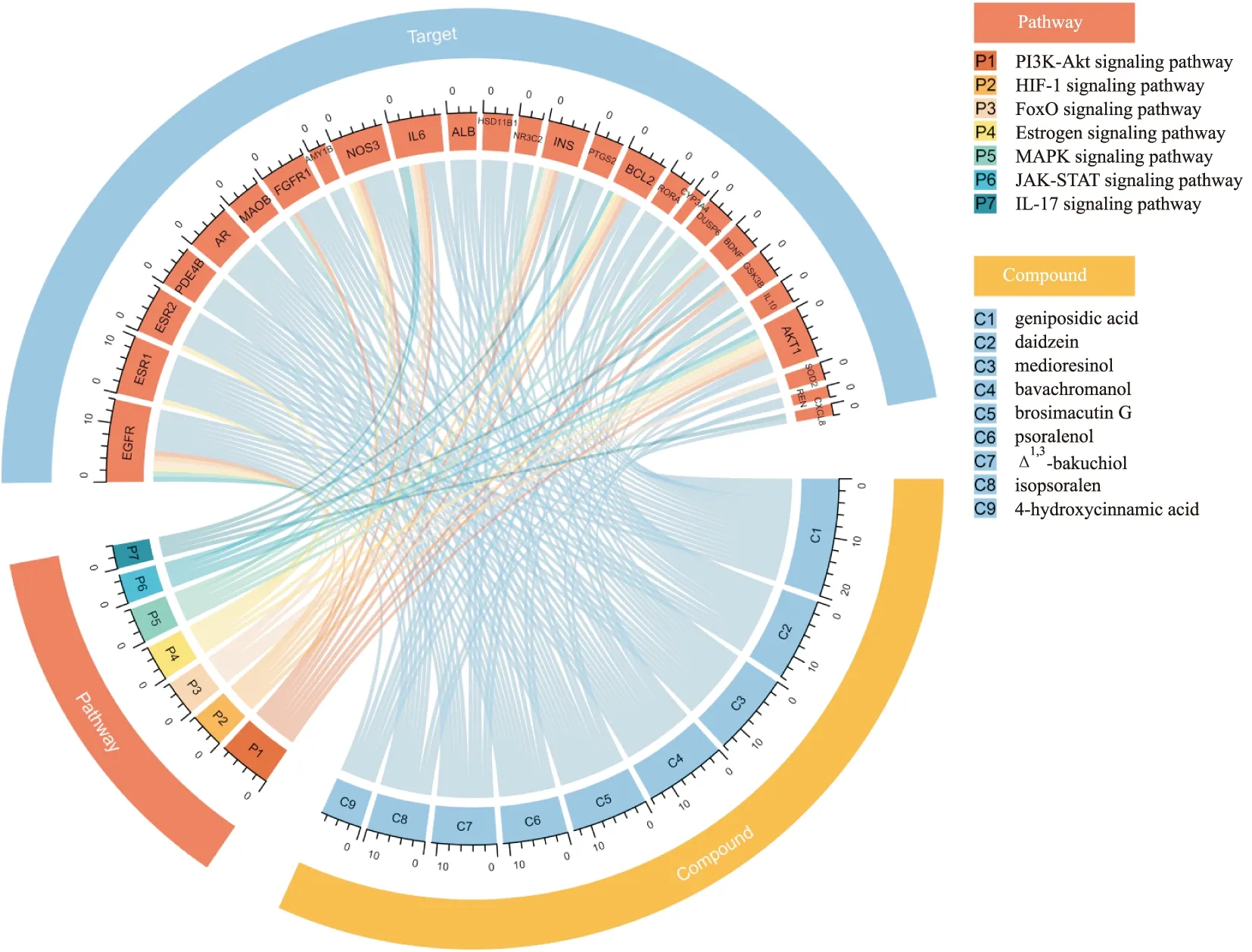
Fig 3 Circos diagram of core constituent-important target-pathway
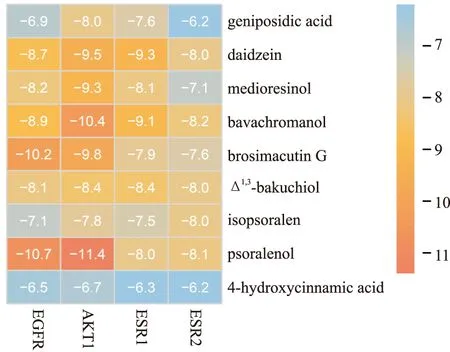
Fig 4 Heatmap based on binding energy among key targets and core constituents
2.2.6蛋白免疫印迹结果 相较于正常组(Ctrl),经CUMS造模的抑郁模型组(Model)表现出较低的ERα和ERβ蛋白表达,而经不同剂量青娥丸干预后(Q-L:临床等效剂量;Q-M:3倍临床等效剂量;Q-H:9倍临床等效剂量),ERα和ERβ蛋白表达量均呈现回调趋势,见Fig 5。上述结果与文献一致[2],证实青娥丸水提物对由ESR1和ESR2基因编码的ERα和ERβ蛋白,确有调控作用。

Fig 5 Qing’e pill improved protein expression of ERα and ERβ in hippocampus of CUMS rats
3 讨论
青娥丸为温肾补阳之名方,契合仝小林院士治疗抑郁症的温补肾阳之法[1],本课题组前期也构建了肾阳虚型抑郁大鼠模型[6]。前期研究表明,青娥丸对CUMS抑郁模型大鼠确有改善抑郁行为之效,并可干预BDNF、TrkB等蛋白表达[2],但对于青娥丸抗抑郁的潜在药效成分及作用靶点未作深入探讨。
本研究应用LC-Q-TOF/MS系统,从灌胃青娥丸水提物大鼠的血浆中识别出入血成分18个,主要有环烯醚萜、木脂素、香豆素、黄酮等类别成分。采用网络药理学方法,构建成分-靶点-通路网络,探讨青娥丸抗抑郁活性的潜在药效成分、靶点和通路。在18个入血成分中,京尼平苷酸、异补骨脂素、大豆苷元等9个成分在网络中有重要作用。据报道,京尼平苷酸具有改善APP/PS1双转基因AD模型小鼠空间学习能力和记忆缺陷,并能缓解神经炎症[7];大豆苷元对MPTP诱导的PD模型小鼠具有神经保护作用[8];异补骨脂素可通过ERα受体发挥脊髓损伤的神经保护作用[9]。据报道[10-11],大豆苷元和京尼平苷酸均可透过血脑屏障。
通过对26个重要靶点进行GO和KEGG富集分析,发现上述靶点主要涉及负向调控凋亡信号通路、对类固醇激素和脂多糖的反应等生物过程,通过PI3K-AKT、MAPK、Estrogen、JAK-STAT等多条通路改善抑郁。其中PI3K-AKT通路最为显著,该通路参与细胞凋亡和炎症反应等过程,激活PI3K-AKT通路可引起神经元凋亡引发抑郁样行为[12],而抑制PI3K-AKT通路可缓解神经炎症反应[13];雌激素可阻断小胶质细胞应对脂多糖的炎性激活,并抑制神经炎症反应[14];JAK-STAT通路参与中枢神经系统的多个功能,有临床研究表明该通路可能参与了抑郁症的生理病理过程[15],抑制JAK-STAT通路可改善氟化物引发的小鼠抑郁样行为[16];MAPK抑制剂SB239063可缓解小胶质细胞的激活和神经炎症[17];而IL-17a被认为是引发小鼠抑郁样行为的重要因素[18]。
经和弦图结果提示,EGFR、AKT1、ESR1和ESR2等靶点在青娥丸抗抑郁作用中具有重要地位。将青娥丸原方水提物入血成分中的9个核心成分与4个靶点进行分子对接,结果显示,9个核心成分中7个与靶点均能有较好亲和力,结合蛋白免疫印迹结果:青娥丸水提物可上调CUMS模型大鼠ERα和ERβ蛋白(由ESR1和ESR2基因编码)的表达,进一步证实了网络药理学结果的可靠性。
综上,本实验基于UPLC-Q-TOF-MS技术,准确快速地揭示了青娥丸入血成分;应用网络药理学方法,对青娥丸抗抑郁的潜在药效成分、作用靶点进行了研究;综合分子对接技术和蛋白免疫印迹法验证靶点蛋白,初步阐述了青娥丸抗抑郁活性的潜在物质基础与作用机制,为青娥丸抗抑郁症的临床前机制研究和临床疗效试验奠定基础。
