cGAS-STING通路异常激活及其抑制剂在免疫和炎症疾病中的研究进展
2023-11-10李文欣张贺峰谢作权段文虎
李文欣,张贺峰,谢作权,段文虎
(中国科学院上海药物研究所,上海 201203)
先天免疫应答通过模式识别受体来识别病原生物中的病原体相关模式分子(pathogen associated molecular pattern, PAMP)结构,进而促进I型干扰素(IFN-I)及其它细胞因子的表达,在机体抵御病原体入侵过程中承担重要的角色。研究表明,在细胞损伤的情况下,核酸可以作为PAMP并引发强烈的免疫反应[1]。为了维持免疫系统的稳定,机体内的cGAS-STING通路将受到精准调控,其主要的感应器是环鸟苷酸-腺苷酸合成酶(cGAS)。cGAS可以识别细胞质中的DNA并催化生成cGAMP(cyclic GMP-AMP),后者与干扰素基因刺激因子(STING)结合后会促进IFN-I和其他免疫介质的表达与分泌[2]。
先天免疫途径的异常激活可导致强烈的IFN-I反应,进而引发自身免疫性疾病[3],因此使用抑制剂适当抑制cGAS-STING通路有望改善自身免疫和炎症相关疾病。本文首先介绍了cGAS-STING通路及作用机制,其次阐述了该通路相关的免疫及炎症疾病,最后概述了靶向cGAS-STING通路的抑制剂的研究进展。
1 cGAS-STING通路
1.1 cGAS催化cGAMP合成cGAS(Fig 1A)属于核酸转移酶家族,全长522个氨基酸,包含核苷酸转移酶结构域和DNA结合结构域。其氨基端参与DNA结合;中间段为保守的核苷酸转移酶基序NTase结构域;羧基端为Mab-21结构域并包含一个高度保守的锌囊结构,具有识别DNA和合成cGAMP的功能。该锌囊结构是cGAS识别双链DNA的重要位点,通过结合Zn2+维持其蛋白结构作用和正常生理功能,抑制该结构将导致cGAS无法识别DNA。基于cGAS-DNA晶体结构的研究发现,作为细胞质DNA感受器的cGAS,主要通过与脱氧核糖磷酸骨架结合来识别双链DNA,而这种识别没有序列特异性,但结合的长度必须大于45个核苷酸,因此cGAS几乎能够识别所有类型的双链DNA和部分单链DNA[4]。当与双链DNA结合后,cGAS的R150和R192插入到DNA双螺旋结构的空隙中,使cGAS-DNA复合体更加牢固[5]。
cGAMP的合成是启动cGAS介导免疫反应的第一步。cGAS的催化活性是通过与DNA相互作用触发的:cGAS依靠表面的正电荷和锌囊结构吸引双链DNA,与双链DNA中的脱氧核糖磷酸骨架以2︰2的形式结合成多聚体,诱导cGAS的核酸转移酶催化区域的构象发生变化,进而催化口袋可识别ATP和GTP底物,并合成2′,3′-cGAMP,而2′,3′-cGAMP可以进一步结合并激活下游的STING[6]。
cGAS作为一种模式识别受体,与细胞质DNA的检测密切相关。cGAS不能识别特定的DNA序列,因此可以通过检测内源性及外源性DNA从而调节免疫反应[7]。研究表明,cGAS不仅与外源性感染的免疫反应有关,还可以通过促进IFN-I来对DNA损伤剂、微核形成和细胞衰老诱导的基因毒性产生应激反应。因此,cGAS不仅是病原体的传感器,也是细胞应激和基因组完整性的传感器[8]。
1.2 cGAMP与STING的结合干扰素基因刺激因子STING也被称为TMEM173、MPYS、MITA和ERIS,是参与先天免疫反应中的多个重要蛋白质分子之一。STING有多个跨膜结构域,在内皮细胞、上皮细胞以及造血肝细胞中均有表达。人源和鼠源的STING分别由379和378个氨基酸构成[9]。人源和鼠源的STING序列一致性为69%。人源STING由羧基端结构域和跨膜结构域组成(Fig 1B)。跨膜结构域由4个跨膜结构域组成,即TM1-4。羧基端结构域由配体结合域和羧基末端结构域组成。STING的羧基端结构域负责配体结合、蛋白质相互作用和信号转导等功能。羧基末端尾包含保守的TANK结合激酶1(TBK1)结合位点。STING需要多聚化进而促进下游信号通路:据推测TBK1通过磷酸化STING的S358和S366来促进其聚合,而棕榈酰化STING的C88和C91促进其在高尔基体上的聚合。STING二聚体形成激活的STING单元,进而启动下游效应器功能[10]。
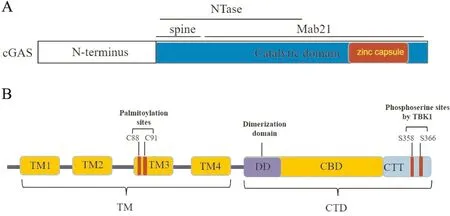
Fig 1 Structure diagram of cGAS (1A) and human STING (1B)
内质网结合的STING是一种二聚体,其羧基端结构域延伸到细胞质中并形成“V”形配体结合口袋,与cGAMP结合并被激活后,从内质网转移到高尔基。在STING易位之后激活下游信号通路所必需的关键修饰步骤——棕榈酰化[11]。除了哺乳动物内源性合成的cGAMP之外,STING还可以被病原体的环状二核苷酸(CDN)直接激活或被DNA损伤激活。CDN作为一种第二信使,普遍存在于原核生物和真核生物中。一般来说,内源性cGAMP或外源性CDN与STING配体结合口袋结合后,均可以促进STING下游信号通路[12]。
1.3 STING下游通路cGAMP作为第二信使被内质网表面的接头分子STING识别后,通过STING的信号级联效应诱导下游相关免疫及炎症反应,进而促进宿主的免疫反应。但STING的异常激活会触发过多的下游炎症反应,甚至导致自身免疫性疾病的发生[13]。
研究表明,到达高尔基体后,棕榈酰化的STING募集TBK1,进而磷酸化STING的羧基末端并募集转录因子干扰素调节因子3(IRF3)。随后TBK1以STING依赖的方式磷酸化IRF3,导致IRF3二聚化并易位到细胞核,启动IFN-I和其他免疫介质的表达[14]。此外,STING可以结合并刺激IкB激酶从而触发NF-кB的转录激活,最终调节促炎细胞因子的表达和分泌,包括IFN-α和IFN-β。随后,IFN与异二聚体IFN受体IFNAR1/IFNAR2结合激活Janus激酶1,它可以磷酸化信号转导和转录激活因子,并诱导干扰素刺激基因(ISGs)的表达。ISGs通过靶向调节病原体生命周期来控制病毒、细菌和寄生虫感染。有研究显示,cGAS-STING信号通路也可以在相邻细胞之间发挥作用,并可能通过在病毒颗粒中包装cGAMP传递到更远的细胞组织[15]。cGAS-STING通路的信号传导途径见Fig 2。

Fig 2 cGAS-STING signaling pathway
2 cGAS-STING异常激活与疾病
cGAS-STING通路是主要的细胞质DNA传感通路。异常激活的cGAS-STING通路涉及多种炎症过程和自身免疫性疾病,根据引发疾病的方式主要分为两类:一类是DNA异常累积,导致cGAS-STING通路持续激活,诱导IFN-I等炎症细胞因子的持续释放;另一类是STING自身突变,导致其不再依赖上游信号并持续激活,进而引发自身免疫性疾病[16]。
2.1 DNA异常累积通常,细胞DNA被限制在细胞核或线粒体中。尽管降解DNA的核酸酶相当丰富,但自身DNA仍然可以通过多种机制在细胞质累积。细胞核和线粒体DNA的错误定位以及cGAS无法区分外源和自身DNA这两者共同促进了自身免疫性疾病的发生。例如,共济失调毛细血管扩张症[17]是一种伤及神经、血管、皮肤的原发性免疫缺陷疾病,是由于细胞质中存在未配对的DNA而引起IFN-I产生,表现为进行性共济失调、免疫功能缺陷、眼结膜和皮肤毛细血管扩张以及肿瘤倾向等。
体内的DNA酶通过降低细胞质DNA水平来抑制cGAS检测自身DNA。三素修复核酸外切酶1(Trex1)和脱氧核糖核酸酶II分别降解细胞质和溶酶体中的DNA,当人体中这两种脱氧核糖核酸酶发生突变,则会导致自身DNA的过度积累,从而激活cGAS,引发IFN-I依赖性自身免疫性疾病。例如,Trex1功能丧失突变导致自身DNA的过度积累[18],引发Aicardi-Goutieres综合征和系统性红斑狼疮等疾病;脱氧核糖核酸酶II的缺乏阻止清除死亡细胞释放的DNA和细胞核中泄漏的DNA,这也促进了cGAS激活和IFN-I依赖性自身免疫性疾病的发生,如类风湿性关节炎等[19]。
此外,DNA异常累积还涉及代谢与炎症性疾病。在急性胰腺炎模型中,坏死组织泄露的外源性DNA诱导大量炎症因子产生,造成组织损伤,而敲除cGAS和STING基因的小鼠病症有所缓解。在非酒精性脂肪肝中,同样发现cGAS和STING基因敲除的小鼠中得到了改善[20]。因此,抑制cGAS-STING通路还可能用于某些代谢疾病及炎症疾病的治疗。
2.2 STING突变配体无关的STING激活案例最早发现于一种罕见的获得性突变相关自身炎症性疾病中。由于在临床上发现此类疾病早发于婴儿时期,故命名为STING相关幼年发病性血管病变(SAVI)[18]。随后,在STING上的两个独立区域中鉴定出几个突变残基,即二聚化界面(V147L、N154S、V155M和G166E)和聚合界面(C206Y、R281Q、R284S和R284G)。结构分析表明,V147L、N154S和V155M诱导STING细胞质结构域180°旋转,而C206Y、R281Q、R284S和R284G突变体减轻了STING寡聚化的自身抑制,从而导致STING自发性寡聚化和在高尔基体的积累。突变STING在这些患者的成纤维细胞中积累并激活下游,即使在没有cGAMP的情况下,STING信号通路也可以持续激活[21]。这些STING突变体在SAVI患者中自动激活会造成严重的肺部炎症、广泛的皮肤血管病变、全身炎症、联合免疫缺陷,甚至导致死亡。
3 cGAS-STING通路抑制剂
cGAS-STING通路异常激活会引发自身免疫性疾病,通过特定的化学分子抑制cGAS-STING通路有望改善这些疾病[22](Fig 3)。
3.1 cGAS抑制剂Jiang等[23]报道了乙酰化修饰是控制cGAS活性的关键分子事件,发现K384、K394和K414位点的乙酰化能够抑制cGAS活化。首先在细胞内对模拟乙酰化的cGAS突变体进行功能评价,初步发现乙酰化修饰对cGAS的抑制作用。其后利用CRISPR-Cas9基因编辑技术、体外定点乙酰化蛋白纯化系统、cGAMP定量分析技术等验证了乙酰化修饰对cGAS的抑制作用。通过对cGAS乙酰化修饰位点的分析,最终证明了阿司匹林可以直接乙酰化cGAS,并且在细胞及动物水平验证了阿司匹林的作用,能够有效抑制AGS患者细胞和小鼠模型中自身DNA诱导的自身免疫。
Vincent等[24]通过高通量筛选发现一系列活性化合物。代表性化合物RU.521表现出良好的细胞活性和选择性。通过等温滴定量热法测得其对cGAS的Kd为36 nmol·L-1。在细胞试验中测得RU.521对DNA诱导的原始巨噬细胞中cGAS信号通路的IC50为0.70 μmol·L-1。RU.521降低了Aicardi-Goutières综合征小鼠模型巨噬细胞中干扰素的表达。RU.521与cGAS结合的晶体结构确证其占据了cGAS的活性位点,并且RU.521有助于进一步了解cGAS的生物学作用。
3.2 STING的CDN口袋抑制剂Astin C是一种源自紫菀的天然环肽。Li等[25]研究发现,Astin C可抑制cGAS-STING信号传导,从而减轻Trex1-/-鼠模型和巨噬细胞的自身炎症反应。研究小组发现Astin C与STING的羧基端激活口袋特异性结合,通过作用于结合口袋阻止IRF3募集,同时保持完整的STING-TBK1相互作用。尽管Astin C结合亲和力较低,但Astin C在小鼠模型上具有较好的耐受性和较低的细胞毒副作用,有望通过进一步改造提高亲和力,发现具有较大治疗窗的STING抑制剂。
Hong等[26]发现了一类能够与cGAMP竞争结合STING的抑制剂。研究以计算机对接的方式确定了一种有效的STING抑制剂SN-011,它与STING的CDN结合口袋的亲和力高于cGAMP,其IC50为76 nmol·L-1。SN-011将STING锁定在开放的非活性构象中,从而抑制由2′3′-cGAMP、单纯疱疹病毒1型感染、Trex1缺乏、cGAS-STING过量表达或其他因素激活的IFN-I和炎性细胞因子的产生。在Trex1-/-小鼠中,SN-011表现出良好的耐受性。SN-011作为与CDN结合口袋结合的特异性STING抑制剂,是治疗STING异常激活相关疾病中有前景的先导化合物之一。

Fig 3 Structure of inhibitors of cGAS-STING pathway
3.3 STING棕榈酰化抑制剂STING棕榈酰化是促进高尔基体上的STING聚集和随后募集STING下游信号分子的关键过程之一。
2018年,Haag等[27]发现,化合物H-151通过共价修饰STING的C91残基来阻断棕榈酰化诱导的STING聚集。该类共价抑制剂结合在STING的连接跨膜结构域,从而阻止STING获得活性构象。研究表明,在Trex1-/-鼠模型和人类细胞中,H-151有效抑制人源STING棕榈酰化(IC50<1 μmol·L-1),并降低了TBK1磷酸水平及IFN-I反应。化合物H-151具有活性强、分子量低、配体效率高和药代动力学性质好的特点,是极具潜力的候选药物。
硝基脂肪酸(NO2-FAs)是内源性形成的脂肪酸,介导抗炎、抗氧化和细胞保护作用。Hansen等[28]报道NO2-FAs可以通过硝基烷基化共价修饰STING,具体是将STING的C88和C91的硫醇基团硝基烷基化。该共价修饰将阻断STING棕榈酰化和信号传导,抑制IFN-I的产生。经验证,NO2-FAs可以抑制SAVI患者的成纤维细胞中IFN-I的产生。NO2-FAs的五项I期临床试验已证明了NO2-FAs的良好耐受性。
3.4 TBK1抑制剂葛兰素史克公司[29]报道了一种新的高效和高选择性的TBK1抑制剂GSK8612的发现和特性。在细胞检测中,该小分子抑制了Ramos细胞中Toll样受体3诱导的IFN-Ⅲ的磷酸化,并抑制了人类原代单核细胞中IFN-I的分泌。在单核巨噬细胞中,GSK8612能够响应双链DNA和cGAMP而抑制IFN-β的分泌。GSK8612作为一种TBK1小分子抑制剂,是进一步分析TBK1在免疫、神经炎症、肥胖或癌症模型中的生物学特性的理想探针。
4 总结与展望
近年来,研究人员投入了大量的精力和资源来研究cGAS-STING通路,从而推进了cGAS和STING抑制剂的在免疫和炎症疾病中的应用[30]。从结构和功能的角度来看:在上游,cGAS作为DNA传感器,通过合成cGAMP引发后续通路;在下游,TBK1和IRF3的募集和磷酸化现在也被确立为免疫激活的关键机制之一;对处在中心的STING,其与配体识别后构象的变化和翻译后修饰的机制也有了较清晰的认识,通过抑制棕榈酰化和占据CDN口袋这两种方式来抑制STING策略已经得到证实。cGAS-STING通路异常与多种自身免疫性疾病的关系也逐渐明晰。
作为核心调控蛋白的STING不仅接受来自宿主DNA的受损信号,还对基因突变和内质网应激做出反应,从而参与多种自身免疫和炎症疾病的调控。从这一点出发,靶向STING比靶向上游cGAS或下游TBK1在药物发现中可能更可取。基于这些已鉴定的先导化合物的母核结构,需进行结构优化以提高其生物活性、靶标选择性和药物吸收,同时尽量减少毒性作用。此外,从生物活性的角度来看,基于生化的高通量筛选中发现的cGAS-STING通路抑制剂对细胞层面的测定几乎没有影响。因此,未来可首选基于细胞的高通量方法进行药物筛选。同时,新技术的开发与应用,例如蛋白水解靶向联合体利用泛素-蛋白酶体系统对靶蛋白进行降解的药物开发技术,为阻断cGAS-STING信号传导提供了新途径。目前,cGAS-STING通路抑制剂为治疗自身免疫性疾病提供了良好的策略,预计在不久的将来,高效低毒的cGAS-STING通路抑制剂将会被开发并最终应用于临床。
