肝移植术后人群新型冠状病毒奥密克戎变异株感染临床表现及预后分析
2023-11-09占俊杰杭小锋宋少华傅志仁
占俊杰, 张 磊, 杭小锋, 宋少华, 傅志仁
2022年以来,新型冠状病毒(简称新冠病毒)奥密克戎变异株逐渐成为主要流行株,其传播力和免疫逃逸能力显著增强,但致病力明显减弱,临床表现已由肺炎为主衍变为以上呼吸道感染为主[1]。对于有免疫缺陷或需要免疫抑制治疗的基础疾病的个体,奥密克戎变异株仍然是一种风险较高的病毒[2-3]。肝移植术后患者,由于长期服用免疫抑制剂导致免疫系统功能失调,是新冠病毒等传染性病毒的易感人群,因此肝移植患者或者有意愿行肝移植手术患者对于新冠病毒难免产生恐慌情绪[4]。目前缺乏大样本的针对肝移植人群奥密克戎变异株感染的临床研究与观察,亦鲜见肝移植是否是奥密克戎变异株感染预后危险因素的相关研究报道。本研究通过电话方式调查肝移植人群和慢性代偿性肝病人群感染奥密克戎变异株后的住院率,回顾性分析2022年12月至2023年2月奥密克戎变异株感染流行期间上海2家综合三甲医院收治的住院患者的临床资料,旨在分析肝移植术后及非肝移植患者的临床特征,探讨肝移植手术史在奥密克戎变异株感染预后风险评估中的意义。
1 资料与方法
1.1临床资料 通过电话方式调查随访肝移植人群和慢性代偿性肝病人群感染奥密克戎变异株的416例患者的住院率,回顾性分析2022年12月至2023年2月新冠病毒奥密克戎变异株感染流行期间上海交通大学医学院附属瑞金医院和海军军医大学第二附属医院收治的35例新冠病毒核酸阳性住院患者的临床资料。除电话调查随访人群外,35例新型冠状病毒感染(coronavirus disease 2019,COVID-19)患者均经咽拭子标本实时荧光反转录聚合酶链反应(reverse transcription-polymerase chain reation,RT-PCR)检测或新冠病毒抗原检测确诊。对住院患者严格评估入院指征,并按照有无肝移植手术史分为两组:肝移植术后奥密克戎变异株感染患者6例为肝移植组,其中肝移植术后年限最短5年,最长20年;同期29例住院的未接受任何器官移植手术的奥密克戎变异株感染患者为非肝移植组。肝移植组患者均未接种新冠病毒疫苗,非肝移植组有24例接种新冠病毒疫苗。比较两组患者临床基线资料、临床表现及检查、治疗情况、预后转归等。本研究经海军军医大学第二附属医院医学伦理委员会批准(编号:2022SL025A)。
1.2影像学检查 奥密克戎变异株肺炎病变发生率低,范围小,且高峰出现时间晚。临床上可以根据CT机化征象,区分奥密克戎变异株感染病程急性期和机化期,从而调整相应治疗方案[5]。本研究采用Philips ingenuitycore 128 64排螺旋CT机进行检查,扫描条件为层厚5 mm,层间距5 mm,然后进行1.0 mm薄层重建。检查时间为发病早期(发病1~4 d)和进展期(发病5~10 d)。患者均进行2次及以上的CT检查。由2名经验丰富的临床医师(近3年一直从事COVID-19一线诊治)独立分析所有CT图像,应用联影科技人工智能软件InferRead CT Pneumonia对两肺病灶进行自动识别、勾勒,医师审阅后修正,结合软件计算出肺炎病变体积及肺炎全肺占比。依据肺部病变体积进行肺炎CT评分,>30%为3分,10%~30%为2分,<10%为1分。
2 结果
2.1肝移植人群和慢性代偿性肝病人群感染奥密克戎变异株后住院率比较 本研究中,随访奥密克戎变异株感染的肝移植人群(287例,肝移植组)和慢性代偿性肝病人群(129例,慢性代偿性肝病组)共计416例。肝移植组的年龄为(54.2±15.1)岁,慢性代偿性肝病组的年龄为(49.4±24.0)岁,两组年龄比较差异无统计学意义(t=0.387,P=0.702)。两组感染奥密克戎变异株后住院的共22例,肝移植组的住院率为5.57%(16/287),慢性代偿性肝病组住院率为4.65%(6/129),两组比较差异无统计学意义(χ2=0.152,P=0.697)。
2.2肝移植组和非肝移植组住院患者临床症状及基础疾病比较 两组年龄、临床症状(发热、咳嗽)、基础病(慢性肺疾病、高血压、糖尿病、慢性肾病、心血管疾病、脑血管疾病)差异均无统计学意义(P>0.05)。见表1。
表1 肝移植组和非肝移植组住院患者临床症状及基础疾病比较
2.3肝移植组和非肝移植组患者临床治疗及转归比较 两组患者均有肺部影像学改变,故按照临床分型分为中型、重型、危重型。两组分型比较:中型(83.3% vs 89.7%)、重型(16.7% vs 6.9%)、危重型(0% vs 3.4%),差异无统计学意义(P=0.076)。见图1ⓐ。两组患者使用激素治疗的人数比例差异无统计学意义(P>0.05)。按照抗病毒药物使用指征,两组使用阿兹夫定的比例差异无统计学意义(P>0.05),但肝移植组无患者使用奈玛特韦/利托那韦片(Paxlovid)。依据肺部病变体积进行肺炎CT评分,两组差异无统计学意义(P=0.641)。见图1ⓑ。分析发现两组患者淋巴细胞计数分布无显著差异,见图1ⓒ。按照淋巴细胞计数<0.5×109/L分组[6-7],两组患者分别为33.3%和6.9%(P=0.733),差异亦无统计学意义。两组患者住院天数、核酸转阴时间、住院天数≥2周的人数比例差异无统计学意义(P>0.05)。非肝移植组有1例患者出现不良预后(接受有创呼吸支持或死亡),肝移植组无不良预后患者。见表2。
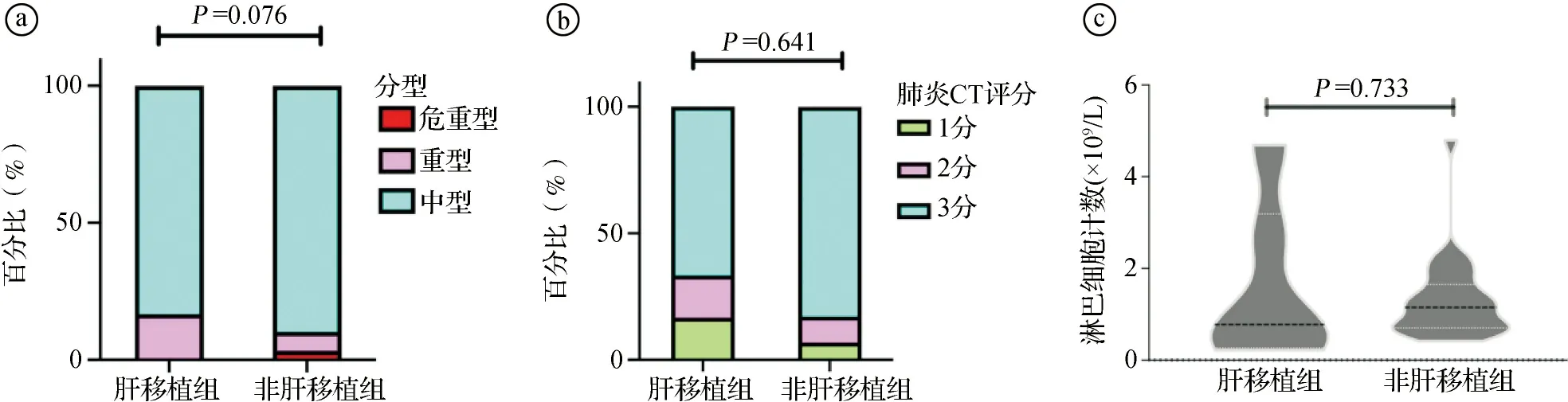
ⓐ临床分型; ⓑ肺炎CT评分; ⓒ淋巴细胞计数
表2 肝移植组和非肝移植组患者临床治疗及转归比较
3 讨论
3.1奥密克戎变异株目前仍为全球新冠病毒传播的主要流行株,而奥密克戎BA.5株是目前国内流行的主要病毒株。与既往流行株相比,奥密克戎变异株致病严重程度和病死率降低,无症状感染者明显增加[8]。了解肝移植患者及非肝移植患者感染新冠病毒奥密克戎变异株的差异,有助于医师评估肝移植患者感染新冠病毒后的病情、制定治疗方案等,同时对于肝移植术后患者及准备行肝移植的患者有一定的参考意义。
3.2本研究中,电话随访感染奥密克戎变异株肝移植患者和慢性代偿性肝病患者共计416例,两组住院率差异无统计学意义,提示肝移植术后患者未显著增加奥密克戎变异株感染相关住院率。既往研究表明,在肝移植患者中,慢性免疫抑制会增加感染新冠病毒的风险,但免疫抑制药物可能会限制炎症反应,并保护这些患者免受COVID-19的过度炎症和急性呼吸窘迫综合征发展,可以降低疾病的严重程度[9-10]。
3.3在合并症中,相关研究发现脑卒中、肾脏疾病、心血管疾病、高血压、糖尿病、肺部疾病、肝脏疾病为COVID-19患者院内死亡的危险因素。合并基础疾病及高龄人群易发展为重型及危重型COVID-19。患者感染新冠病毒可导致原本的慢性基础疾病急性加重,甚至可能危及生命[11-13]。另一项回顾性研究显示,年龄≥63岁、淋巴细胞计数≤1.02×109/L、C反应蛋白(C-reactive protein,CRP)≥65.08 mg/L的COVID-19患者重症化的风险较高[6]。COVID-19患者外周血淋巴细胞计数与病情严重程度相关,病情越严重,淋巴细胞计数越少,住ICU组低于住普通病房组[7,14],病情严重组低于普通病例组[15]。相关Meta分析提出淋巴细胞计数及比例降低与重症COVID-19风险增加密切相关[16]。本研究中,肝移植组与非肝移植组淋巴细胞计数比较无显著差异,考虑与纳入患者样本例数相对较少有关;采用更严格的淋巴细胞计数<0.5×109/L分组比较,结果显示两组例数分布无显著差异。COVID-19早期肺部的病灶范围不大,进展期病灶增多,范围增大,分布于双肺多个肺叶、肺段,典型者呈对称性沿胸壁平行分布[17]。肝移植及非肝移植两组平均年龄相仿,合并上述基础病的情况类似,两组患者临床分型分布、肺炎CT评分及住院时间等无显著差异。虽肝移植术后患者疫苗接种率普遍较低,但两组患者预后无明显差异,提示肝移植手术史对奥密克戎变异株感染预后风险预测的意义有限。
3.4糖皮质激素的合理使用,对COVID-19患者阻断病情进展可能有效,能够减少COVID-19患者的病死率和并发症[18-19]。本研究中,肝移植组和非肝移植组使用激素治疗的人数比例差异无统计学意义,提示肝移植手术史未明显增加糖皮质激素的使用率。COVID-19患者应尽早接受抗病毒治疗,最佳时机为出现感染症状后5 d内。抗病毒药物可用于治疗中型COVID-19的成年患者[20]。相关共识及研究指出在使用Paxlovid时应注意其与免疫抑制剂的相互作用,注意调整钙调磷酸酶抑制剂、哺乳动物雷帕霉素靶蛋白抑制剂和糖皮质激素的剂量,密切监测药物浓度[21-24]。本研究中,对肝移植患者使用阿兹夫定的治疗比例与普通人群相仿,但肝移植组患者未应用Paxlovid,部分原因为考虑药物相互作用、肝移植患者病情相对轻及药物可及性等。两组患者在接受类似抗病毒治疗的情况下,核酸转阴时间及住院时间无显著差异。
3.5本研究有一些局限性。首先,由于长期随访的肝移植患者中因奥密克戎变异株感染住院率低,入组的肝移植住院病例数较少,研究样本量小;其次,存在一定的选择偏倚,仅仅纳入2家综合三甲医院的数据,虽然匹配的是同期住院且临床基本特征无差异的非肝移植患者,但未纳入包括各级医院在内的更多中心的数据,结论有待在大样本研究中进一步证实。
综上所述,肝移植术后奥密克戎变异株感染患者的临床表现、治疗及转归与非肝移植患者相比无显著差异。肝移植手术史在奥密克戎变异株感染预后风险评估中的意义有限,有待进一步大样本研究。
