生物炭添加下枯草芽孢杆菌应对镉胁迫的分子机制
2023-11-09丁静陈伟光陈宇婷何岸飞姜晶盛光遥
丁静,陈伟光,陈宇婷,何岸飞,姜晶,盛光遥
(苏州科技大学环境科学与工程学院,江苏 苏州 215009)
镉具有很高的毒性,不仅会破坏生物机能,影响生态系统的正常功能[1],还会通过食物链在生物以及人体内富集,给人类健康带来巨大风险[2],因此对镉污染水体进行修复至关重要。生物炭是由富碳生物质(如农副产品)在缺氧条件下通过热加工(如热解)而获得的物质[3],其孔隙和表面官能团可与镉发生物理化学作用[4],是一种新兴、低成本的吸附剂。然而,生物炭对镉的固定效果较差,在废水长期处理过程中可能发生解吸,造成二次污染[5]。枯草芽孢杆菌是一种广泛分布于不同环境的革兰氏阳性杆状细菌,是原位生态水体中的代表菌种[6]。它被认为是一种良好的生物吸附剂,低成本及环境友好的特点更使其在镉废水修复领域具有不可替代的优势[7-9]。然而,利用微生物吸附剂处理含镉废水存在难以分离和回收、微生物活性在生长初期易受镉毒性影响等缺点[10],从而限制了微生物吸附剂的应用。
有研究指出,生物炭是固定微生物的良好载体,不仅可以为微生物提供有利的生存环境,还能为微生物生长提供碳源、能源和矿物营养[11]。而微生物可以协助生物炭完成对污染物的长期固定,同时还可能将生物炭用作厌氧呼吸中的末端电子受体[12]。Yuan等[13]的研究也证实了生物炭可作为微生物的电子供体。因此,近年来有学者采用生物炭联合枯草芽孢杆菌处理含镉废水[14-15],该方法可以弥补单一生物炭和微生物处理时的缺陷,同时生物炭和枯草芽孢杆菌之间的相互作用可能会进一步加强对含镉废水的处理效果。然而,这些研究主要关注体系中镉的吸附去除效果,并结合一系列的外在表征手段,从化学层面探索镉、枯草芽孢杆菌和生物炭之间的相互作用过程,缺乏从微生物角度阐述其详细的内在分子机制[16]。明确枯草芽孢杆菌在生物炭添加及重金属胁迫环境下的生理响应和分子作用机制,对优化生物炭-枯草芽孢杆菌复合技术处理重金属废水至关重要。
微生物对外在环境的生理适应主要在转录水平上协调[17],因此研究微生物在不同环境条件下基因转录表达的变化,可以理解环境条件对微生物的内在影响机制[18-20]。Yu 等[21]通过转录组分析系统研究了溶解氧对枯草芽孢杆菌遗传调控和代谢的影响。转录组数据分析显示,低氧供应对代谢有3 个主要影响:增强碳代谢(葡萄糖代谢、丙酮酸代谢和碳溢出)、抑制氮源降解(谷氨酸族氨基酸和黄嘌呤)和嘌呤合成。此外,参与能量、细胞类型分化、蛋白质合成的基因表达也受氧气供应的影响。Oomes 等[22]通过转录组学研究了钙离子对枯草芽孢杆菌孢子形成的影响,结果显示,孢子形成、鞭毛形成和生物膜基质形成通路都受到了显著影响,孢壁多糖生物合成基因以及生物膜形成相关基因的表达也被影响。此外,对于枯草芽孢杆菌暴露于多种营养和环境条件下平铺阵列转录组的研究,为研究枯草芽孢杆菌与环境污染物的相互作用机制提供了强大的理论基础[23]。
因此,本实验利用转录组学测序,研究枯草芽孢杆菌在不同体系(正常、镉胁迫、生物炭、生物炭-镉胁迫)中的转录调控分子机理,讨论生物炭添加对枯草芽孢杆菌抵抗镉胁迫压力及镉去除能力的影响机制。研究结果可为未来生物炭-微生物联用处理重金属废水提供理论支撑。
1 材料与方法
1.1 生物炭制备
生物炭原料为玉米秸秆,产自江苏东海。将收集的玉米秸秆用粉碎机打碎(2~5 cm)后装入砂锅,用锡纸包裹,置于马弗炉中,在500 ℃条件下高温热解3 h。待自然降温6 h 后取出,在研钵中研磨,过100 目筛。洗净烘干,最后冷冻干燥24 h后收集备用。
1.2 细菌来源及培养
本实验采用的枯草芽孢杆菌购自中国普通微生物菌种保藏管理中心(CGMCC 编号1.4255)。培养基包括氯化钠5 g·L-1、蛋白胨10 g·L-1、牛肉膏3 g·L-1,pH 7.0。在30 ℃、170 r·min-1下培养。
1.3 实验体系搭建
实验设置正常培养(BS)、生物炭添加(BS_C)、镉胁迫(BS_Cd)、生物炭-镉胁迫(BS_C_Cd)4 组体系。将对数期保藏的枯草芽孢杆菌按7%(V/V)的比例先后两次接种于新鲜培养基中,依次完成活化(2 h)和扩大培养(8 h)。考虑到枯草芽孢杆菌在生物炭添加和镉胁迫环境中适宜的暴露时间并不一致,并且在BS_C_Cd体系中,需要将枯草芽孢杆菌和生物炭混合培养一段时间后再进入镉胁迫环境,因此本实验设置了两组培养体系。将扩大培养的枯草芽孢杆菌等量(200 mL)分装到两组无菌锥形瓶中,选择一组为BS体系,在另一组中加入生物炭(0.2 g),形成BS_C 体系。两组体系均设置3 个生物学重复,并将其置于30 ℃和170 r·min-1的条件下继续培养。培养3.5 h后,对两组体系进行取样,用于转录组测序。取样结束后,迅速在两组体系中加入灭菌后的CdCl2溶液,控制每组体系中的镉浓度为50 mg·L-1,形成BS_Cd 体系和BS_C_Cd 体系,反应时间控制为20 min,用于分析镉胁迫对枯草芽孢杆菌的即时压力效应。在此期间,分别在0、10、20 min 时对两组体系进行镉浓度测定。反应结束时(20 min),取样用于转录组测序。
1.4 镉浓度测定
采用原子吸收光谱仪PinAAcle900T(PerkinElmer,Waltham,MA,USA)测定溶液中的镉浓度。标准镉溶液(1000 µg·mL-1)购自上海阿拉丁生化科技股份有限公司。样品测定前使用0.45µm 滤膜过滤,并加入定量硝酸(1%)稀释,以控制浓度在标准曲线范围内,同时也抑制溶液中的镉水解。
1.5 样品收集及RNA分离纯化
BS 体系和BS_Cd 体系:样品采集后,利用离心机在4 000 r·min-1下离心3 min 收集菌体,用液氮快速冷冻后放入-80 ℃超低温冰箱中保存。
BS_C体系和BS_C_Cd体系:样品采集后,分两次离心收集菌体。第一次以2 500 r·min-1的较低转速离心,除去样品中的生物炭。第二次以4 000 r·min-1转速离心收集菌体,用液氮快速冷冻,放入-80 ℃超低温冰箱中保存。
采用标准方法进行样品总RNA 提取,通过琼脂糖凝胶电泳分析RNA 完整性及是否存在DNA 污染,利用NanoPhotometer spectrophotometer(Implen,Munich,德国)检测RNA的纯度,通过Agilent 2100 bioanalyzer(Agilent,Palo Alto,CA,美国)精确检测RNA 的完整性。
1.6 转录组学测序及分析
从提取的总RNA 中去除rRNA,获得mRNA。随后加入碎片化缓冲液,将得到的mRNA随机打断成短片段,按照链特异性方式建库[24]。文库构建完成后,使用Invitrogen Qubit 2.0 Fluorometer(ThermoFisher,Waltham,MA,美国)对其进行初步定量,然后稀释文库至1.5 ng·µL-1。随后使用Agilent 2100 bioanalyzer(Agilent,Palo Alto,CA,美国)对文库中的插入片段大小进行检测。插入片段大小符合预期后,利用qRTPCR对文库的有效浓度进行准确定量(文库有效浓度高于2 nmol·L-1),并进行Illumina测序。
测序完成后,对获得的转录组数据进行原始数据过滤,去除带接头的序列、含N(N 表示无法确定碱基信息)序列和低质量序列(Qphred≤20 的碱基数占整个序列长度50%以上),并进行测序错误率和C 含量分布检查,最终获得用于后续分析使用的高质量序列。用Bowtie2软件对过滤后的序列进行基因组定位分析[25]。用Rockhopper软件将测序结果根据参考基因组进行组装,并与已注释的基因模型进行比较,发现新的转录本区域[26]。通过Blastx与Nr库比对,对新预测的转录本区域进行注释。采用ClusterProfiler软件对差异基因集进行GO功能富集和KEGG通路富集分析,找出与差异基因显著性相关的生物学功能或通路[27]。
2 结果与讨论
2.1 含镉体系中的镉去除情况
图1 显示,两个含镉体系(BS_Cd 和BS_C_Cd)均在0~10 min 阶段即表现出明显的镉吸附,之后在10~20 min 阶段吸附放缓。BS_C_Cd 体系中生物炭和细菌对镉的复合吸附量远大于BS_Cd 体系中单一细菌的吸附量,这可能会在一定程度上缓解体系中枯草芽孢杆菌的镉胁迫毒性。因此本实验将镉胁迫的反应时间设定为20 min,尽量让枯草芽孢杆菌在镉胁迫环境中具有一定的暴露时间,同时控制两个体系中的镉浓度差,从而获得较科学的镉胁迫/生物炭添加对枯草芽孢杆菌生理代谢的影响机制。
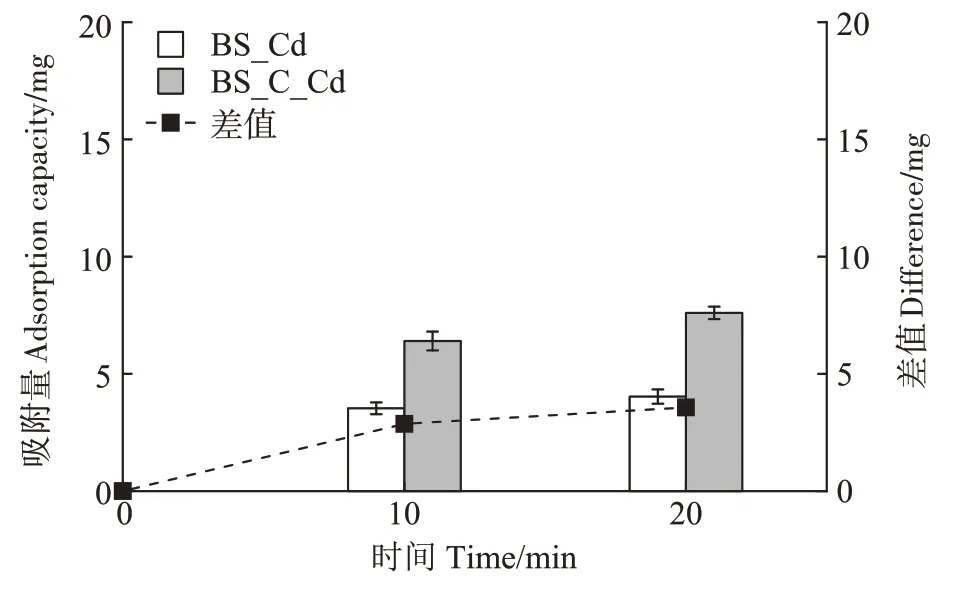
图1 BS_Cd和BS_C_Cd体系中的镉去除情况Figure 1 Cadmium removal in BS_Cd and BS_C_Cd systems
2.2 枯草芽孢杆菌在不同体系中的基因表达差异
由于本实验中设置了两组培养体系(每个体系又分为两个阶段),为了更好地认识枯草芽孢杆菌受生物炭刺激活性后,其对镉胁迫压力的生理响应,本研究对BS_C_Cd 和BS_Cd 的转录组结果进行了对比分析。从图2 中可以发现,生物炭和镉的加入均会导致枯草芽孢杆菌基因表达差异。BS_CdvsBS 组共有1 932 个差异表达基因,其中上调基因967 个,下调基因965 个;BS_CvsBS 组有312 个差异表达基因,其中上调基因133 个,下调基因179 个;BS_C_CdvsBS_C组有1 722 个差异表达基因,其中上调基因834 个,下调基因888 个。除此之外,在对BS_C_Cd 和BS_Cd 样品进行对比分析时发现,其存在1 541 个差异表达基因,其中上调基因691 个,下调基因850 个,差异基因数目远高于BS_CvsBS 组,说明在镉胁迫压力下,生物炭对枯草芽孢杆菌生理代谢的影响要远大于正常生长条件。BS_C_CdvsBS_C 组差异基因数目少于BS_CdvsBS 组,这进一步证明枯草芽孢杆菌受到生物炭的积极作用,缓解了外界镉胁迫对其造成的压力和影响。这可能是因为生物炭粗糙的表面孔道、较大的比表面积和孔隙容量为枯草芽孢杆菌提供了良好的生存环境,帮助枯草芽孢杆菌在一定程度上规避了镉毒性[28]。同时在生物炭-镉胁迫体系中,生物炭的存在为枯草芽孢杆菌的生长提供了营养[29]。Tao 等[30]以棉秆为原料制备生物炭作为枯草芽孢杆菌的高效接种载体,也发现与未添加生物炭的体系相比,细菌在生物炭体系中生长较快,细菌的最高浓度也较高。火山图直观展示了每个组合的差异基因分布情况(图2b~图2f)。相比BS_CvsBS 组,其余有镉添加的实验组都表现出较高的基因表达差异及显著性水平。这进一步说明当暴露在镉胁迫压力下时,枯草芽孢杆菌的生理代谢会受到明显抑制。然而如前所述,可能由于生物炭能帮助枯草芽孢杆菌规避镉毒性,并可为细菌生长提供营养,因此在细菌应对镉胁迫的生理响应上产生明显影响,从而导致其基因表达差异显著。
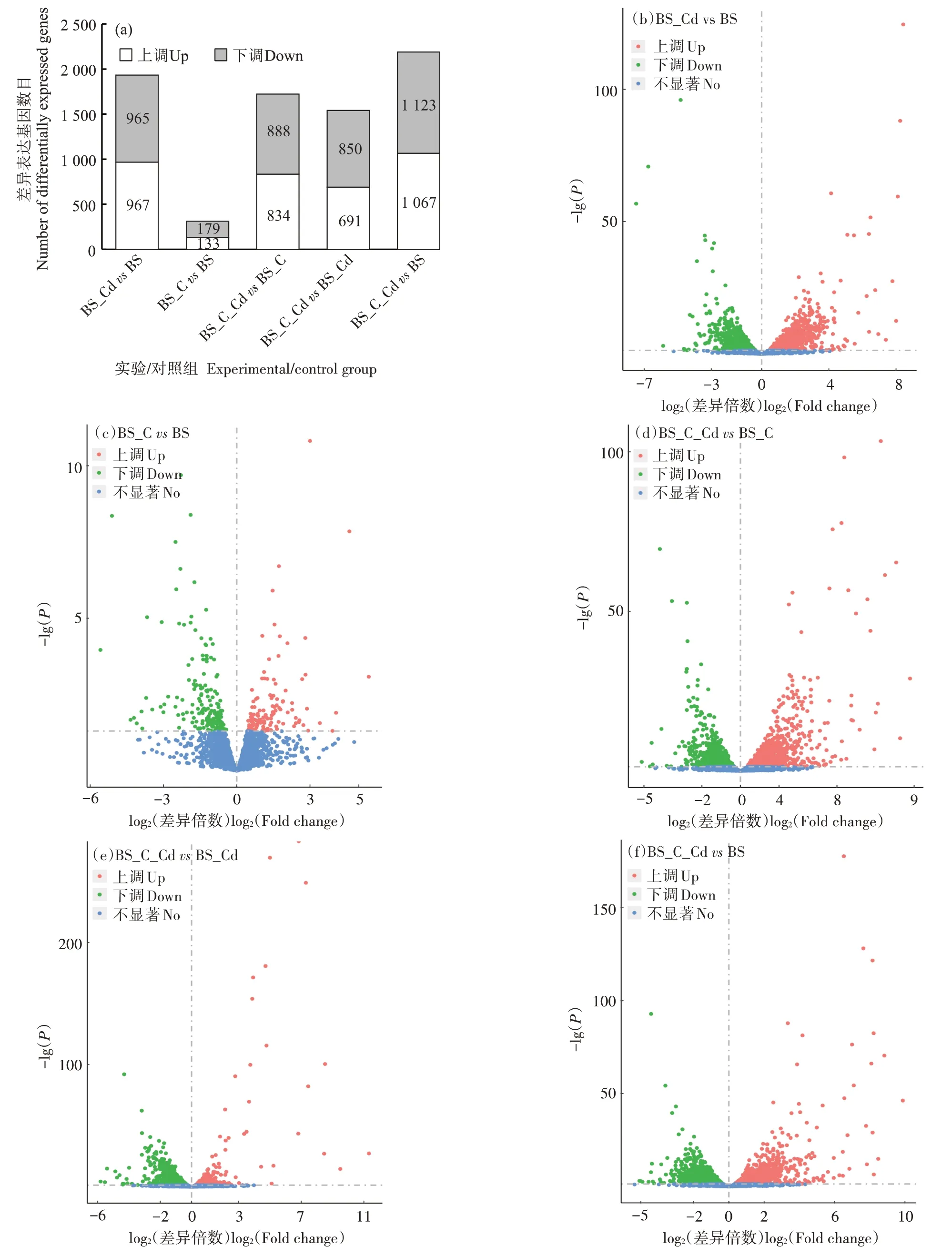
图2 各实验/对照组间的差异表达基因数量(a)及其差异表达基因火山图分布(P<0.05,|log2差异倍数|>0)(b)~(f)Figure 2 Numbers of differentially expressed genes(a)and volcano plot of the differentially expressed genes in the experimental/control groups(P<0.05,|log2 Fold Change|>0)(b)~(f)
2.3 枯草芽孢杆菌在不同体系中的GO功能富集
2.3.1 镉胁迫/生物炭添加前后枯草芽孢杆菌重要功能条目表达变化
GO 功能富集揭示了各实验/对照组重要功能条目相关基因的上/下调情况。BS_CdvsBS组的差异基因GO 功能富集分析结果如图3(a)所示,BS_CdvsBS以BS_Cd 为实验组、BS 为对照组。图3(a)显示,在镉胁迫下,上调的差异表达基因主要归类为蛋白质复合物(Protein-containing complex)、离子转运(Ion transport)、细胞器(Organelle)、阳离子跨膜转运蛋白活性(Cation transmembrane transporter activity)、运动(Locomotion)。这表明在镉压力下,枯草芽孢杆菌通过调控阳离子运输和转运基因的表达来加快溶液中镉的去除。此外,差异基因在蛋白质复合物方面也出现了正向调控,特别是CotA基因表达上调。CotA 是枯草芽孢杆菌的芽孢外壁蛋白,可以保护细菌免受紫外线辐射和过氧化物的损害[31],因此该生物功能的正向调控可能有助于细菌隔绝溶液中镉的直接毒害。下调的差异基因主要归类为氧化还原酶活性(Oxidoreductase activity)、肽酶活性(Peptidase activity,acting on L-amino acid peptides)、维生素生物合成过程(Vitamin biosynthetic process)。整体来看,GO 富集分析在细胞组分分类中的上调基因数量均多于下调基因,同时在生物学过程分类中的离子转运和运动功能条目、分子功能中的阳离子跨膜转运蛋白活性功能条目中,上调基因数量也多于下调基因。而在生物学过程分类中的维生素合成功能条目、分子功能分类中的氧化还原酶和水解酶活性功能条目中,下调基因数量要多于上调基因。此外,值得一提的是运动功能条目,其差异基因表达全部为上调,这意味着镉压力明显增强了细胞运动功能。尽管枯草芽孢杆菌面对镉毒性会产生上述自卫反应,但镉胁迫对枯草芽孢杆菌的侵害仍然是直接且不可避免的,在镉毒性下,枯草芽孢杆菌的部分生理代谢功能仍然受到了明显抑制。
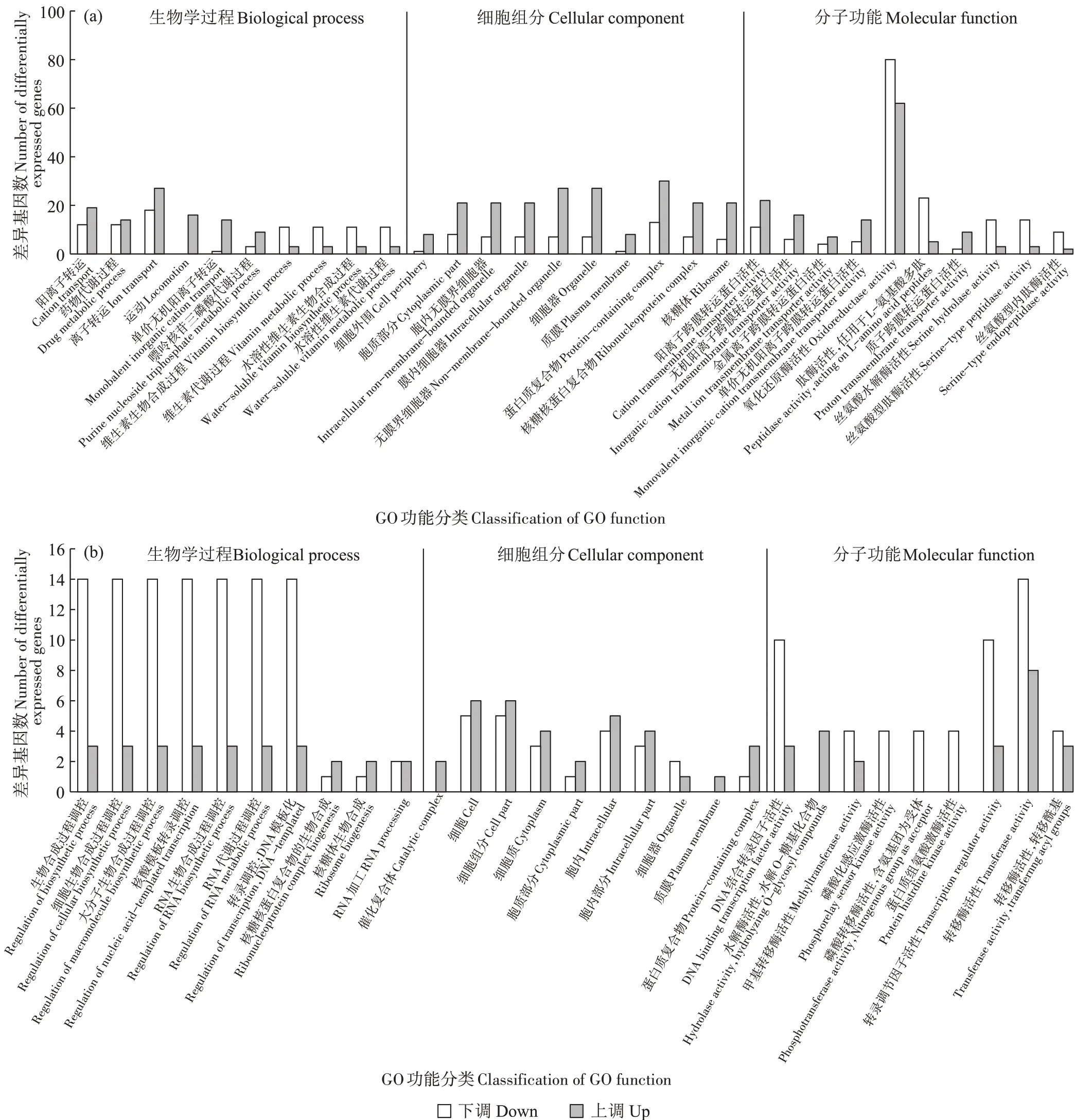
图3 BS_Cd vs BS组(a)和BS_C vs BS组(b)的差异基因GO功能富集分析Figure 3 GO function enrichment analysis of differentially expressed genes in BS_Cd vs BS(a)and BS_C vs BS(b)groups
BS_CvsBS以BS_C为处理组、BS为对照组。图3(b)显示,添加生物炭后,GO 富集分析在细胞组分分类中上调基因数量均多于下调基因。上调的差异表达基因主要归类为细胞(Cell)、胞内(Intracellular)、水解酶活性(Hydrolase activity,hydrolyzing O-glycosyl compounds)、催化复合体(Catalytic complex)、核糖核蛋白复合物的生物合成(Ribonucleoprotein complex biogenesis)。下调的差异基因主要归类为各种生物大分子合成及代谢调控,包括RNA 合成和DNA 的转录过程,以及各种转移酶活性。从增强的基因功能条目来看,生物炭的添加对枯草芽孢杆菌的细胞组分相关功能产生了积极影响,但对其生物合成和各种转移酶活性产生了负面影响。
2.3.2 生物炭-镉胁迫体系中枯草芽孢杆菌重要功能条目表达变化
BS_C_CdvsBS_C 是以BS_C_Cd 为处理组、BS_C为对照组。图4(a)显示,上调的差异基因包括细胞组分的各功能条目和分子功能下的各种底物/离子转运功能条目,特别是转运活性(Transporter activity)。此外,在生物学过程分类下的细胞运动(Cell motility)、趋化性(Chemotaxis)、纤毛或鞭毛依赖的细胞运动(Cilium or flagellum-dependent cell motility)、运动(Locomotion)、细胞或亚细胞组分的移动(Movement of cell or subcellular component)和趋避性(Taxis)功能条目中,差异基因表达全部为上调。下调的差异基因主要为维生素的生物合成和代谢过程,以及内肽酶活性。这表明相对于BS_C 体系,BS_C_Cd 体系中的枯草芽孢杆菌受到镉胁迫时,其细胞内部的一些生物合成和代谢过程会受到抑制,但是细胞运动趋势明显增强(或许会向生物炭表面和内部运动),从而使其有效规避镉毒性压力。并且,细菌的离子转运功能也得到明显增强,这可能提高了枯草芽孢杆菌的镉转移能力。
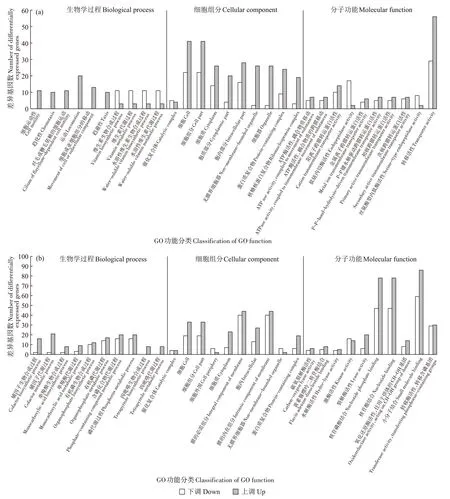
图4 BS_C_Cd vs BS_C组(a)和BS_C_Cd vs BS_Cd组(b)的差异基因GO功能富集分析Figure 4 GO function enrichment analysis of differentially expressed genes in BS_C_Cd vs BS_C(a)and BS_C_Cd vs BS_Cd(b)groups
如前所述,除上述3 组样品间的差异基因分析外,本研究对BS_C_Cd 和BS_Cd 的转录组结果也进行了对比分析,用以参考性地认识生物炭刺激枯草芽孢杆菌活性后,枯草芽孢杆菌对镉胁迫压力的生理响应是否与正常状态下的镉应对措施有所不同。图4(b)显示,GO 富集分析在大部分功能条目中的上调基因数量都多于下调基因。上调的差异基因主要有小分子结合(Small molecule binding)、核苷酸结合(Nucleotide binding)、核苷磷酸结合(Nucleoside phosphate binding)、裂解酶活性(Lyase activity)、氧化还原酶活性(Oxidoreductase activity,acting on CH-OH group of donors)、膜的内在组分(Intrinsic component of membrane)、膜的必需组分(Integral component of membrane)、细胞(Cell)、细胞组分(Cell part)、细胞质(Cytoplasm)、胞内(Intracellular)、辅因子生物合成过程(Cofactor biosynthetic process)、辅因子代谢过程(Cofactor metabolic process)、单羧酸生物合成过程(Monocarboxylic acid biosynthetic process)、单羧酸代谢过程(Monocarboxylic acid metabolic process)、有机磷生物合成过程(Organophosphate biosynthetic process)、有机磷代谢过程(Organophosphate metabolic process)、含磷化合物代谢过程(Phosphate-containing compound metabolic process)、磷代谢过程(Phosphorus metabolic process)、四吡咯生物合成过程(Tetrapyrrole biosynthetic process)、四吡咯代谢过程(Tetrapyrrole metabolic process)。下调的差异基因有细胞外围(Cell periphery)、质膜(Plasma membrane)和激酶活性(Kinase activity)。可以看到,相比于单一含镉体系,生物炭的存在增强了枯草芽孢杆菌体内各种生物学过程、细胞组分和分子功能基因的表达,这与前文生物炭为枯草芽孢杆菌提供营养的说法相一致。张秋等[32]探究了生物炭对镉污染土壤团聚体酶活性的影响,结果显示,生物炭显著提升了镉污染土壤团聚体的酶活性,尤其是在碳循环酶中的蛋白酶和氧化还原酶中的过氧化氢酶处理上表现明显。本研究认为,这可能是因为生物炭改良和提高了团聚体的结构和性能,形成了对微生物更有利的生存环境,同时对土壤中重金属有效态的钝化作用也促进了作物根系的生长,但对酶活性变化机理并未进行深入讨论。生物炭也促进了细菌在镉环境下对含磷化合物的合成和代谢。有研究指出[33],微生物分泌的有机酸会在生物炭表面形成弱酸性的微环境,促进生物炭中磷的释放,使重金属与其形成稳定的磷化合物进而被长期固定在生物炭表面。此外值得注意的是,阳离子跨膜转运蛋白相关基因czcD和重金属外流泵蛋白相关基因cadA在BS_CdvsBS 组的表达均表现为下调,而在BS_C_Cd 和BS_Cd 的对比结果中则呈现为上调。czcD基因已被证明是金属抗性基因[34]。并且研究发现,镉的抗性基因系统主要有czc 和cad 两种,cadA基因存在于包括葡萄球菌属、微球菌属及盐芽孢杆菌属等多种细菌基因组中,菌株通过该基因所编码的酶将镉泵出菌体外,从而起到解毒作用[35]。因此,czcD和cadA基因在BS_C_Cd 和BS_Cd 组中的表达上调,意味着生物炭可能激活了枯草芽孢杆菌体内镉抗性基因的表达,从而增强了其对镉胁迫的抵抗能力。并且膜相关功能条目的差异基因以上调为主。已有研究通过扫描电镜观察发现,在生物炭-镉胁迫体系中确实形成了生物膜[15]。因此,本实验中膜相关功能条目差异基因的上调,也进一步验证了以上的实验结果,预示着体系中早期生物膜发育迹象。
2.4 枯草芽孢杆菌在不同体系中的KEGG通路富集
2.4.1 镉胁迫/生物炭添加前后枯草芽孢杆菌代谢通路表达变化
KEGG 富集分析结果表明(表1),体系中加入镉后,枯草芽孢杆菌的鞭毛组装和细菌趋化性通路都明显增强。这两条通路的增强是枯草芽孢杆菌在镉胁迫下产生应激自卫反应的直接表现。鞭毛是细菌的运动器官,同时也在细菌的表面黏附上起到一定作用[36]。镉的存在激活了枯草芽孢杆菌鞭毛运动的开关FliM,鞭毛组装通路的增强说明在镉环境中,枯草芽孢杆菌通过加快自身运动来躲避镉毒性[37]。此外,氧化磷酸化通路也被增强。氧化磷酸化是细菌生成ATP 的重要途径之一。相关研究发现,氧化磷酸化参与了细胞的抗毒害活动,通过促进细胞产能和提高能量转化效率来解毒,证实了能量衰竭可能是造成毒害的原因[38]。而核黄素代谢和硫传递系统相关通路都受到了明显抑制,说明细菌在镉毒性压力下部分物质代谢能力减弱,进一步体现了镉毒性对枯草芽孢杆菌代谢活性的抑制。BS_CvsBS处理组的KEGG通路富集分析中,只有淀粉和蔗糖代谢通路表现出显著富集,说明生物炭的添加显著增强了枯草芽孢杆菌对能源物质的代谢功能。

表1 各处理/对照组KEGG显著富集通路中的差异基因表达情况Table 1 Expression of the differential genes in KEGG enrichment pathways in the experimental/control groups
2.4.2 生物炭-镉胁迫体系中枯草芽孢杆菌代谢通路表达变化
BS_C_CdvsBS_C 处理组的差异基因显著富集通路情况与BS_CdvsBS 组相似,部分代谢相关通路(核黄素代谢、硫代谢、不同环境中的微生物代谢)的基因表达呈现下调,但与鞭毛组装及细菌趋化性通路相关的基因表达则呈现上调。此外,核糖体和缬氨酸、亮氨酸及异亮氨酸生物合成通路的差异基因表达也表现出明显上调。可见镉添加确实对细菌的代谢产生了部分抑制,但是会明显增强细胞躲避压力和毒性的运动行为。
而对BS_C_Cd 和BS_Cd 的差异基因进行显著富集代谢通路分析时发现(表2),枯草芽孢杆菌物质和能源代谢相关通路的基因表达均呈现上调,包括氨基糖和核苷酸糖代谢、不同环境中的微生物代谢、碳代谢、糖酵解和糖异生以及磷酸戊糖途径。这说明生物炭的存在可以缓解镉胁迫对枯草芽孢杆菌的毒性效应,且可能为细菌提供了能源,继而刺激了枯草芽孢杆菌的生命代谢活动。这也与周凤等[39]的研究结果类似。
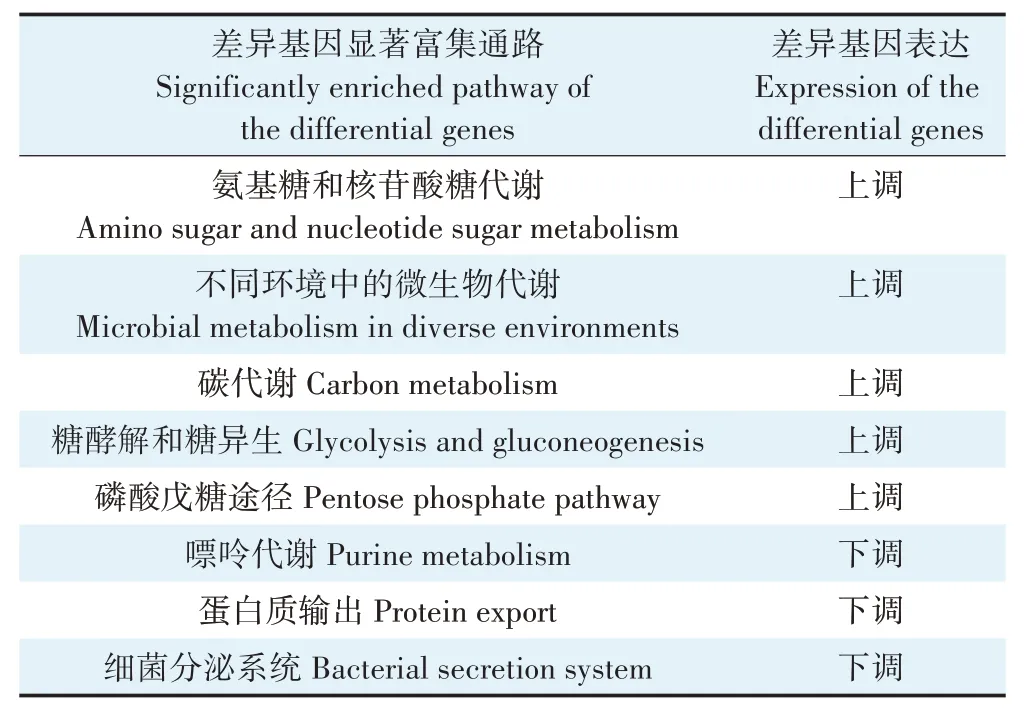
表2 BS_C_Cd和BS_Cd差异基因的KEGG显著富集通路情况Table 2 KEGG enrichment pathway of differentially expressed genes between BS_C_Cd and BS_Cd
差异基因在氨基糖和核苷酸糖代谢、糖酵解和糖异生、磷酸戊糖途径通路的显著富集,也揭示了生物膜的早期发育现象。有研究指出,生物膜发育过程中,大多数被测的代谢途径都发生了显著的动态变化,包括TCA 循环、糖酵解、核苷酸和氨基酸生物合成等[40]。并且差异基因在细胞组分显著富集的功能条目也与膜组成有关。而在BS_CdvsBS 组中,则没有表现出任何生物膜形成迹象。已有研究发现,在生物炭协同体系中,枯草芽孢杆菌可以附着在生物炭表面及孔道内生长,形成复合体;并且菌体分泌出更多的胞外聚合物,使得细菌间粘连现象更明显,这可能是形成生物膜的重要标志[15]。生物膜附着在固体载体上,对机械应力和生物量具有一定的保护作用,是一种有潜力的工业废水处理方法[41]。因此生物膜的形成可以对细菌产生保护作用,这对于提高枯草芽孢杆菌对含镉废水的处理能力具有重要意义。
此外,在不显著富集通路中,与谷胱甘肽代谢相关的差异基因表达呈现上调,但在BS_CdvsBS 组中,相关的差异基因表达则呈现下调。谷胱甘肽具有抗氧化和解毒功能,可防止活性氧物质如自由基、过氧化物等对细胞造成损害[42]。并且有研究指出,谷胱甘肽在金属结合肽的合成中至关重要,金属结合肽可通过形成细胞内稳定的金属络合物来螯合重金属[43-44]。因此,该差异基因上调说明生物炭的存在提高了谷胱甘肽代谢活性,在提高细菌抗氧化和解毒能力的同时,可能也对镉的去除起到了积极作用。嘌呤代谢、蛋白质输出、细菌分泌系统这几个通路的基因表达呈现下调,这可能是由于在BS_Cd 体系中,枯草芽孢杆菌直接暴露于镉胁迫压力下,需要更多刺激自身的免疫和保护功能。而在BS_C_Cd 体系中,受到生物炭的外在物理性保护和内在代谢促进,枯草芽孢杆菌受到的镉胁迫压力相对较小,因此对这些通路的基因表达刺激较小。
3 结论
(1)生物炭添加和镉胁迫均会导致枯草芽孢杆菌基因表达差异,但生物炭可以缓解镉胁迫对枯草芽孢杆菌的压力和影响。
(2)在镉胁迫压力下,枯草芽孢杆菌的生理代谢功能受到了明显抑制,但细菌通过上调细胞运动及镉转运相关基因的表达来规避镉毒性,其鞭毛组装和细菌趋化性通路都明显增强。
(3)生物炭添加对枯草芽孢杆菌的细胞组分相关功能产生了积极影响,并且增强了细菌对能源物质的代谢功能。
(4)生物炭-镉胁迫体系中,生物炭增强了枯草芽孢杆菌在镉胁迫压力下各种生物过程、细胞组分和分子功能基因的表达,包括细菌对含磷化合物的合成和代谢,以及细菌体内镉抗性基因的表达。
