高效液相色谱-串联质谱法测定天王补心丸中山麦冬
2023-11-09李丽莉吕轶峰宁崇良覃丽郦白桂昌何颂华
李丽莉,吕轶峰,宁崇良,覃丽郦,白桂昌,何颂华
(广西壮族自治区食品药品检验所,国家药品监督管理局中药材质量监测与评价重点实验室,南宁 530021)
天王补心丸来源于明代洪基《摄生秘剖》天王补心丹,最早被《中华人民共和国药典》(以下简称《中国药典》)1977年版收载,现收载于中国药典2020年版一部[1],有大蜜丸、小蜜丸、水蜜丸等剂型。天王补心丸由丹参、当归、石菖蒲、党参、茯苓、五味子、麦冬、天冬、地黄、玄参、制远志、炒酸枣仁、柏子仁、桔梗、甘草、朱砂16 味药材组成,具有滋阴养血,补心安神的功效。其中麦冬滋阴清热,为方中臣药。《中国药典》中规定麦冬的来源为百合科植物麦冬的干燥块根[1],山麦冬为百合科植物湖北麦冬或短葶山麦冬的干燥块根。目前市场上由于麦冬需求量大,而山麦冬市场需求较少、产量大且与麦冬形态相近,有部分厂家以山麦冬代替麦冬或在麦冬中混入山麦冬为原料生产中成药。虽然麦冬和山麦冬性状相近,疗效类似[2],但现代研究表明两者的化学成分和药理作用具有一定区别[3-7]。鉴于古今麦冬药用习惯、现代化学与药理研究基础和中医临床实际,《中国药典》将麦冬和山麦冬归属为两个不同的药味,不允许二者混用。
根据文献[8-11]记载,山麦冬皂苷B为湖北麦冬的特征性成分,短葶山麦冬皂苷C 为短葶山麦冬的特征性成分,而麦冬几乎不含以上两种成分。笔者以山麦冬皂苷B 和短葶山麦冬皂苷C 为指标性成分,建立天王补心丸中山麦冬皂苷B和短葶山麦冬皂苷C的HPLC-MS/MS检查方法,若样品中检出一定量的山麦冬皂苷B 或短葶山麦冬皂苷C,则认为存在以山麦冬替代麦冬投料的掺伪情况。该方法对于天王补心丸的规范生产以及质量安全具有重要意义。
1 实验部分
1.1 主要仪器与试剂
液相色谱-串连三重四级杆质谱仪:Agilent 1290-6490型,美国安捷伦科技有限公司。
分析天平:(1) ML204 型,感量为0.1 mg,梅特勒-托利多仪器上海有限公司;(2) XS205型,感量为0.01 mg,梅特勒-托利多仪器上海有限公司。
数控超声波清洗器:KQ-250DU 型,昆山超声仪器有限公司。
超纯水仪:Milli-Q型,美国密理博公司。
天王补心丸样品:大蜜丸,市售。
山麦冬皂苷B 对照品:批号为111907-201103,中国食品药品检定研究院。
短葶山麦冬皂苷C 对照品:批号为111908-201102,中国食品药品检定研究院。
乙腈:色谱纯,美国费希尔公司。
实验所用其它试剂均为分析纯。
实验用水为去离子水。
1.2 仪器工作条件
1.2.1 液相色谱仪
色谱柱:Waters CORTECS®C18柱(2.1 mm×100 mm,2.7 µm,美国沃特世公司);柱温:35 ℃;进样体积:1 μL;流动相:A相为0.1% (体积分数,下同)的甲酸溶液,B相为乙腈,流量为0.2 mL/min;洗脱方式:梯度洗脱,洗脱程序见表1。
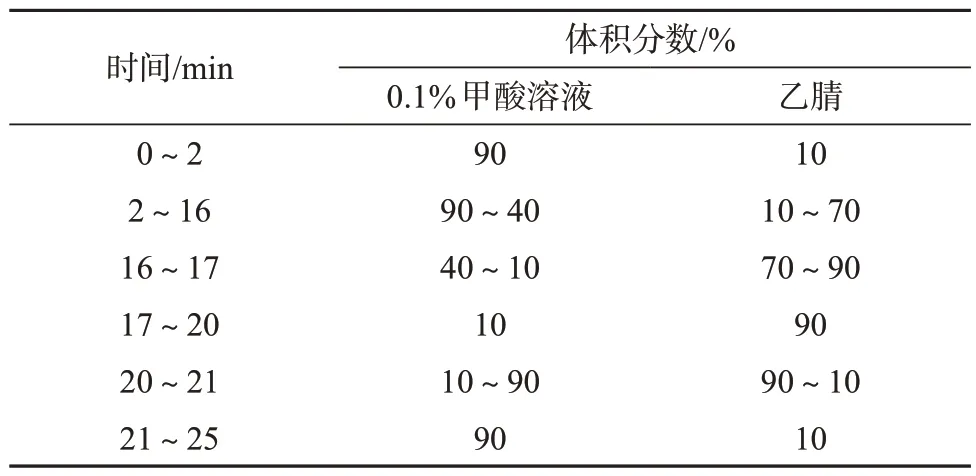
表1 梯度洗脱程序
1.2.1 质谱仪
离子源:电喷雾电离源;扫描模式:正负离子同时扫描(ESI+/ESI-);检测方式:多重反应监测(MRM)模式;干燥气:氮气,流量为12 L/min,温度为350 ℃;雾化气压力:1.379×105Pa;鞘气:氮气,流量为11 L/min,温度为350 ℃;毛细管电压:4 kV;喷嘴电压:500 V。山麦冬皂苷B和短亭山麦冬皂苷C质谱参数见表2。

表2 山麦冬皂苷B和短亭山麦冬皂苷C的质谱参数
1.3 实验方法
1.3.1 样品溶液制备
取大蜜丸样品,剪碎,混匀,取适量,精密称定,加入两倍量的硅藻土,研匀,取约4.5 g,精密称定,置于具塞锥形瓶中,加入甲醇20 mL,密塞,称定质量,超声处理(功率为180 W,频率为50 kHz) 30 min,放冷,再次称定质量,用甲醇补足减失的质量,摇匀。精密吸取续滤液1 mL,置于5 mL容量瓶中,加入甲醇稀释至标线,摇匀,滤过,滤液作为样品溶液。
1.3.2 阴性样品溶液制备
按《中国药典》2020年版一部天王补心丸处方,取除麦冬以外的15味药材,按大蜜丸的配比和制备方法制成45 g不含麦冬成分的阴性对照制剂。取阴性对照制剂1 g,按1.3.1 样品溶液制备方法制成不含麦冬成分的阴性样品溶液。
1.3.3 对照制剂溶液制备
按《中国药典》2020年版一部天王补心丸处方,以正品麦冬为原料,按大蜜丸的配比和制备方法制成45 g 对照制剂。取对照制剂1 g,按1.3.1 方法制成对照制剂溶液。
1.3.4 混合标准溶液制备
(1) 定量用混合标准溶液。取山麦冬皂苷B、短葶山麦冬皂苷C对照品适量,精密称定,加入甲醇制成含山麦冬皂苷B 9 ng/mL、短葶山麦冬皂苷C 120 ng/mL的混合溶液,作为定量用混合标准溶液。
(2) 系列混合标准工作溶液。分别称取山麦冬皂苷B、短葶山麦冬皂苷C 对照品适量,精密称定,以甲醇为溶剂,配制成山麦冬皂苷B 质量浓度分别为5.18、10.37、20.74、51.85、103.70、207.40 ng/mL,短葶山麦冬皂苷C 质量浓度分别为5.20、20.80、52.00、208.00、1040.00、2 080.00 ng/mL 的系列混合标准工作溶液。
1.3.5 定量方法
按1.2仪器工作条件测定,以定量用混合标准溶液为对照,以外标单点法定量。
2 结果与讨论
2.1 样品提取方法优化
根据处方,样品中含有质量分数为33.3%~47.2%的炼蜜,采用硅藻土与样品混匀,可以达到去除蜂蜜干扰的目的。采用甲醇提取,与采用不同浓度的甲醇水溶液提取相比,可大幅度减少强极性杂质的提取量,且有利于样品溶液在质谱中的雾化与离子化,使得灵敏度得到进一步的提高。
2.2 色谱条件与质谱条件优化
比较了乙腈-水、乙腈-10 mmol/L乙酸铵溶液、乙腈-0.1%甲酸溶液3 种流动相体系,分别采用正、负离子模式进行扫描,发现当采用乙腈-0.1%甲酸溶液为流动相时,电离模式为正离子模式时,山麦冬皂苷B 有较强的响应,母离子为m/z723.4,为[M+H]+;电离模式为负离子模式时,短葶山麦冬皂苷C 有较强的响应,母离子为m/z915.5,为[M+COOH]-。故采用0.1%甲酸溶液为流动相A,以乙腈为流动相B,采用正、负离子模式同时测定,在保证灵敏度的同时,减少了流动相的用量。山麦冬皂苷B、短葶山麦冬皂苷C 和天王补心丸样品检测离子色谱图如图1所示。

图1 山麦冬皂苷B、短葶山麦冬皂苷C对照品及天王补心丸样品检测离子色谱图
2.3 专属性试验
在1.2 仪器工作条件下,分别取阴性样品溶液、对照制剂溶液进行测定,色谱图如图2和图3所示。由图2和图3可以看出,阴性样品和对照制剂色谱图中均未出现与山麦冬皂苷B、短葶山麦冬C 对照品色谱保留时间相同的色谱峰,表明阴性样品和对照制剂中共存成分对方法无干扰。
图2 阴性样品溶液监测离子色谱图

图3 对照制剂溶液监测离子色谱图
2.4 线性关系考察
2.4.1 对照品线性
取1.3.4.中的系列混合标准工作溶液,在1.2 仪器工作条件下,分别进样1 μL 进行测定,以目标物质量浓度(x)为横坐标,色谱峰面积(y)为纵坐标绘制标准工作曲线,计算线性方程和相关系数,结果见表3。由表3可知,山麦冬皂苷B和短葶山麦冬皂苷C的质量浓度分别在5.18~207.4、5.2~2 080 ng/mL范围内与色谱峰面积线性关系良好,相关系数均为0.999 3。

表3 质量浓度线性范围、线性方程、相关系数
2.4.2 掺伪线性
在1.2仪器工作条件下,按天王补心丸(大蜜丸)的处方和制备方法,分别制备处方含量的5%、10%、20%、50%、80%、100%(质量分数)掺湖北麦冬、短葶山麦冬样品,按1.3.1方法配制成不同掺伪比例的样品溶液,测定并计算色谱峰面积,以目标物掺伪质量分数(x)为横坐标,以色谱峰面积(y)为纵坐标,绘制标准曲线,计算线性方程和相关系数,结果见表4。由表4 数据可知,麦冬掺伪(湖北麦冬、短葶山麦冬)质量分数在5%~100%范围内与色谱峰峰面积线性关系良好,可以准确定量。

表4 天王补心丸中湖北麦冬和短葶山麦冬掺入质量分数线性范围、线性方程、相关系数
2.5 方法检出限
取掺伪样品溶液,不断稀释并测定,以信噪比为3 对应的样品中目标物的质量分数作为方法检出限,得山麦冬皂苷B、短葶山麦冬皂苷C的检出限分别为56、134 ng/g。
2.6 精密度试验
取6份不含山麦冬皂苷B、短葶山麦冬皂苷C的样品,各4.5 g,分别精密加入山麦冬皂苷B、短葶山麦冬皂苷C 的质量浓度分别为4.14、4.16 μg/mL 的混合标准溶液0.1 mL,按1.3.1方法制备成同时含有山麦冬皂苷B、短葶山麦冬皂苷C的样品溶液,分别测定,结果列于表5。由表5可知,山麦冬皂苷B、短葶山麦冬皂苷C 6次测定值的相对标准偏差分别为2.57%、5.27%,表明该方法精密度良好。

表5 精密度试验结果
2.7 稳定性试验
取掺伪样品溶液1 份,分别于溶液配制后第0、4、8、12、16、20、24 h进样测定,色谱峰面积测定结果列于表6。由表6 可知,24 h 内山麦冬皂苷B、短葶山麦冬皂苷C色谱峰峰面积测定值的相对标准偏差分别为3.67%、3.93%,表明样品溶液在24 h 内稳定性良好。

表6 不同放置时间时色谱峰面积测定结果
2.8 加标回收试验
精密称取阴性对照制剂约4.5 g,平行称取9份,分别精密加入高、中、低不同质量浓度水平的山麦冬皂苷B、短葶山麦冬皂苷C混合标准溶液各0 mL,按1.3.1 方法制备加标样品溶液,每种溶液分别测定3次,结果列于表7。由表7数据可知,山麦冬皂苷B、短葶山麦冬皂苷C 的平均回收率分别为99.16%、101.54%,表明该方法准确度较高。
3 结语
中药材是中成药生产的基础物质,其质量状况将会直接影响药品质量,随着中药产业的发展及中药材资源的短缺,中药的质量问题屡屡发生。中药制剂中,以山麦冬代替麦冬作为料的现象常见报道[12-17],说明药品生产企业对中药制剂的原料把控缺失,企业质检人员缺乏一定的鉴别能力或企业存在失信的行为,需引起相关技术部门和监管部门的注意。采用HPLC-MS/MS 法测定天王补心丸中山麦冬专属性强,灵敏度高,可以简化样品处理过程,提高检测准确性。通过优化梯度洗脱程序与质谱条件,采用MRM 模式,正负离子同时测定,节省了测定时间,为药品质量监督提供了技术支持。
