脓毒症的免疫监测和免疫治疗
2023-11-08刘凤琪唐坎凯张根生
刘凤琪 唐坎凯 张根生
1 湖州市第一人民医院重症医学科, 湖州 313000;2 浙江大学医学院附属第二医院重症医学科,多脏器衰竭预警与干预教育部重点实验室(浙江大学),杭州 310009
脓毒症是病原体和宿主免疫系统之间的一场死亡竞赛[1]。 尽管在早期识别、预防和治疗方面已经取得了巨大进展, 脓毒症的发病率和死亡率仍居高不下。 2017 年,全球有4 890 万例患者发生脓毒症,其中有1 100 万例与脓毒症相关的死亡, 占当年死亡人数的19.7%[2]。 动物实验和临床研究表明,脓毒症不仅会引起过度炎症, 还会同时导致免疫系统功能障碍和抗菌免疫力受损。 因此, 免疫治疗是提高宿主感染抵抗力最有希望的潜在方法。 本文主要聚焦脓毒症免疫紊乱的主要机制、免疫监测的手段,以及新型免疫诊疗进展。
一、脓毒症免疫紊乱机制
脓毒症除早期对感染产生炎症反应或部分发生过度炎症反应外, 代偿性抗炎反应引起的严重免疫抑制是脓毒症死亡的主要原因, 而宿主的免疫失调是脓毒症发病以及进展的关键机制[3]。 脓毒症早期促炎反应的特点是激活多个复杂的分子和细胞过程,进一步促进炎症反应,引发“细胞因子风暴”,共同导致微循环和大循环失调,包括毛细血管渗漏、组织水肿、血管扩张和凝血功能障碍等,最终导致多器官功能障碍综合征(MODS)。 过度炎症仅仅是脓毒症的开始,一旦免疫紊乱得不到及时稳定,后续将发生严重的免疫麻痹状态。 脓毒症免疫抑制期间发生淋巴细胞消耗和衰竭、抗炎免疫细胞扩增、人类白细胞抗原DR(HLA-DR)和细胞程序性死亡受体-1/细胞程序性死亡-配体1(PD1/PD-L1)表达异常以及代谢和表观遗传学改变, 这些机制共同作用形成了复杂的免疫抑制环境, 从而导致继发感染甚至死亡风险的增加。 脓毒症免疫紊乱具体机制见图1。
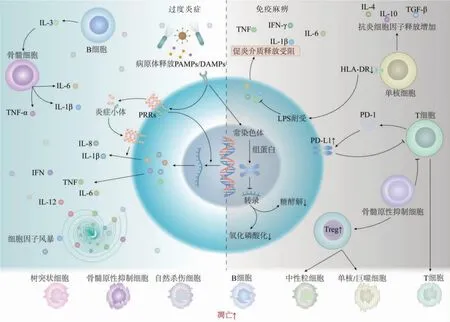
图1 脓毒症免疫紊乱机制
二、脓毒症免疫抑制识别
监测脓毒症常用的生物标志物为降钙素原、C反应蛋白和白细胞。 然而, 这些标记物的主要缺陷是特异性不高, 既不能反映宿主对感染反应的严重程度,也不能帮助识别参与免疫失调的细胞或组织。在脓毒症状态下, 先天免疫细胞通过介导病原体清除,有助于激活和调节适应性免疫反应。 因此,中性粒细胞、单核/巨噬细胞、DC 和NK 细胞等数量和功能状态的改变以及细胞亚群间的不平衡是监测脓毒症先天性免疫应答的关键指标,而T 细胞和B 细胞是获得性免疫系统功能障碍的主要监测对象。 目前大量的临床研究发现潜在的生物标记物有助于脓毒症的诊断、 疾病状态的监测和不良临床结局的预测(见表1)[4-6]。根据最近发表的《脓毒症免疫抑制监测和治疗专家共识》[5],推荐将mHLA-DR 下降、单核细胞对内毒素(LPS)刺激的反应性降低、淋巴细胞计数减少、调节性T 细胞(Tregs)的比例增加、Th1/Th2比例失衡和免疫球蛋白(IgA、IgM 和IgG)浓度降低作为脓毒症所致免疫抑制的监测指标。

表1 脓毒症免疫监测指标
三、脓毒症的免疫治疗
目前, 已经有一些脓毒症免疫制剂在动物模型和临床实践中进行了研究和验证, 具有代表性的包括粒细胞-巨噬细胞集落刺激因子(GM-CSF)、IFN-γ、抗PD-1/PD-L1 抗体和胸腺肽α1(Tα1)等。 近年也有一些新的免疫制剂问世,并取得了令人惊喜的疗效。
1. Tα1
Tα1 能激活DC、NK 细胞和巨噬细胞等免疫细胞,刺激T 细胞增殖和活化,增强Th1 细胞的抗菌作用。最近的研究表明,Tα1 可通过增加重症COVID-19 患者CD4+和CD8+T 细胞数量,降低CD8+T 细胞上PD-1和Tim-3 的表达, 以恢复淋巴细胞数量和逆转T 细胞耗竭,进而降低重症COVID-19 患者的死亡率[7]。
2. IFN-γ
IFN-γ 是Ⅱ型IFN 家族的唯一成员, 具有增强巨噬细胞的吞噬和杀菌, 促进消灭病原体的能力。动物实验最新证明,IFN-γ 通过PI3K/Akt/mTOR 通路促进Warburg 效应逆转脓毒症小鼠引起的免疫抑制[8],该研究阐明了IFN-γ 对脓毒症免疫治疗的潜在作用机制, 为脓毒症的治疗提供了新的靶点。 但在一项随机对照研究中,与安慰剂相比,IFN-γ 治疗并未显著降低机械通气的成年危重患者第28 天医院获得性肺炎发生率或死亡率[9]。 此外,由于IFN-γ 治疗安全性问题,该试验提前终止。因此,IFN-γ 在脓毒症中的防治作用及其临床安全性均值得进一步关注。
3. GM-CSF
GM-CSF 作为一种促炎细胞因子和骨髓生成生长因子在介导肺泡巨噬细胞稳态和肺部炎症中发挥着重要作用[10]。 在一项随机对照研究中,使用GMCSF 单克隆抗体治疗重症COVID-19,第28 天时存活且无呼吸衰竭的患者比例与对照组的差异没有统计学意义[11]。 另一项前瞻性临床研究正在评估新型吸入式GM-CSF 制剂在改善COVID-19 相关急性缺氧性呼吸衰竭患者的氧合以及短期和长期的疗效(临床试验注册号:NCT04326920)[12], 以验证其在脓毒症治疗中的作用。
4. 抗PD-1/PD-L1 抗体
抗PD-1/PD-L1 抗体能恢复中性粒细胞、单核细胞、T 细胞和NK 细胞在脓毒症免疫抑制中的功能。在Ⅰ期临床实验中, 脓毒症诱导的免疫抑制患者静脉给予抗PD-1 抗体治疗,结果显示960 mg 单药剂量具有良好临床耐受性,且未诱发任何“细胞因子风暴”[13],但是需要后续的Ⅱ期和Ⅲ期临床试验进一步验证其疗效。
5. 重组人IL-7
IL-7 能诱导脓毒症免疫抑制状态患者的淋巴细胞增殖和防止淋巴细胞凋亡。 最新一项前瞻性的RCT 研究, 发现无论是静脉还是肌肉注射IL-7,均能够逆转脓毒症诱导的淋巴细胞减少症, 同时未观察到细胞因子风暴和针对IL-7 的抗体的形成[14]。 但静脉注射IL-7 可引起短暂的呼吸窘迫和发热,故优先推荐肌肉注射。 此外,还有研究发现,肌肉注射IL-7能够促进血液中的淋巴细胞恢复到参考水平, 其可逆转危重症COVID-19 导致的病理损伤, 而且不会加剧炎症或肺损伤[15]。
6. 重组人Prokineticin-2(rPK2)
rPK2 是rPK 家族的成员,与多种生物学功能有关,包括神经发育、血管生成和炎症反应等,其在脓毒症中的研究才刚刚兴起。 近期研究发现严重脓毒症患者血清rPK2 的浓度显著降低[16]。 在动物模型中,重组rPK2 可以提高脓毒症小鼠的存活率, 并减轻脓毒症引起的多器官损伤[16]。 在体外细胞模型中,rPK2 通过rPK2-PKR1-ST3 信号通路可以增强巨噬细胞的吞噬和杀菌能力[16]。 这些研究提示,rPK2 既可作为脓毒症和脓毒性休克的潜在生物标志物,同时又为脓毒症免疫治疗提供了新的策略。
7. 巴瑞替尼
巴瑞替尼是一种酪氨酸蛋白激酶抑制剂, 可防止炎症刺激引起的毛细血管渗漏和肺泡水肿。 荷兰一项随机、双盲、安慰剂对照临床试验发现,与安慰剂相比, 口服巴瑞替尼能减少危重症COVID-19 住院患者机械通气时间(7 dvs.12 d),而且能降低28 d死亡率(8%vs. 14%)[17]。 最新一项研究也发现,巴瑞替尼尽管对接受机械通气COVID-19 患者的肺水肿或临床结局没有显著改善作用,但可减轻以高IL-6、高肿瘤坏死因子受体1(TNFR1)和高表面活性蛋白-D(SP-D)为特征的亚表型患者的肺水肿[18]。 因此,这些结果为后续继续探索巴瑞替尼治疗脓毒症或者COVID-19 患者提供科学依据。
8. 抗IL-6 受体抗体
IL-6 是感染时由多种免疫细胞释放的一种重要的炎症细胞因子。 鉴于严重COVID-19 患者体内存在过度炎症反应、 淋巴细胞功能缺陷、 内皮功能障碍、血栓栓塞形成等复杂的病理生理[19],IL-6 途径抑制剂已作为一种重要的生物标志物驱动免疫治疗手段在COVID-19 大流行期间开展应用, 并取得了较好的临床疗效[20-21]。 REMAP-CAP 试验结果显示,与对照组相比,IL-6 受体拮抗剂可提高COVID-19 患者6 个月生存率的获益概率超过99.9%[22]。 总的来说,IL-6 受体拮抗剂对COVID-19 患者是一种很有吸引力的免疫治疗策略, 但其是否能够应用于其他病原体如金黄色葡萄球菌等引起的脓毒症感染有待进一步研究。
9. 中医药治疗
研究表明, 中药制剂可通过抑制炎症和调节免疫反应、 减少氧化应激和维持细胞稳态来减轻脓毒症引起的器官功能障碍[23]。一些中药复方制剂,如血必净、黄连解毒汤和参附注射液,已在脓毒症导致的免疫失调方面显示出疗效。 现有研究显示, 血必净对脓毒症具有纠正促炎/抗炎失衡、减少免疫细胞凋亡和改善凝血功能障碍等方面发挥作用, 且不良反应少[24-25]。 最新一项大规模随机临床试验发现,血必净能够降低脓毒症患者28 d 的死亡率[26]。 动物实验表明, 黄连解毒汤在脓毒症模型中表现出很强的保护作用[27],这种作用主要涉及RNA 聚合酶Ⅱ启动子转录的正调控、细胞凋亡过程的负调控、对缺氧的反应等生物学过程,为以后的临床和基础研究提供参考[28]。参附注射液可通过加强固有免疫延长脓毒症大鼠的存活时间,保护肠道黏膜[29]。在烧伤并发的脓毒症患者中,参附注射液可有效提高患者的免疫力,改善临床预后[30]。
四、免疫监测和治疗需要解决的问题和展望
首先, 脓毒症免疫生物标志物的临床应用仍存在着巨大的阻碍:(1)大多数免疫相关生物标志物缺乏特异性, 不能反映脓毒症免疫的全部动态过程;(2) 淋巴细胞计数等常用的生物标记物缺少量化标准,无法指导免疫调节治疗以及启动和调整的时机;(3)免疫学监测技术缺乏标准化;(4)常规临床检验室使用传统的流式细胞术、ELISA 和qPCR 等监测脓毒症,目前无法开展飞行时间细胞计数(CytoF)和单细胞RNA 测序(scRNA-seq)等技术,而这些多组学技术能够更好地识别脓毒症免疫抑制相关的免疫细胞簇和细胞状态[31-32]。 基于现状,联合多个免疫相关参数指导脓毒症免疫治疗很有必要。 比如单核细胞/高密度脂蛋白胆固醇比值联合中性粒细胞/淋巴细胞比值在预测脓毒症患者死亡率方面比单一参数效果更好[33];联合血清铁蛋白和HLA-DR/CD14 可以对脓毒症免疫状态进行分层, 指导个性化辅助免疫治疗[34]。另外,需要对脓毒症患者免疫状态进行连续动态监测以便了解免疫抑制的进展和疾病的严重程度,进而指导治疗和判断预后。
其次, 用于模拟脓毒症免疫治疗的动物模型本身存在差异性, 动物模型亦不能充分反映脓毒症患者病理生理状态。 年龄、 合并症和同时进行的支持性治疗(包括机械通气、激素或血管活性药)等,因素均导致临床应用与人体实验的偏差,需要进一步验证。
另外,目前免疫抑制患者越来越多,如恶性肿瘤尤其是血液系统恶性肿瘤接受放疗或化疗出现中性粒细胞减少患者、老年患者(≥60 岁)、长期使用类固醇和免疫抑制剂者, 这些患者常处于免疫抑制状态,主要是细胞免疫抑制,容易发生潜伏病毒(如巨细胞病毒)重新激活和机会病原体(如念珠菌)感染的巨大风险。 因此, 本身存在这些免疫抑制高危因素的脓毒症患者更需要考虑免疫调节治疗[5]。 然而,这样的研究数据相对稀少, 有待今后开展更多的动物实验和临床研究。
五、结语
脓毒症引起复杂的免疫紊乱, 导致机体长期处于免疫抑制、易感染状态,甚至死亡。 尽管有较多的临床和动物实验研究来阐述脓毒症免疫治疗的病理生理机制、有效性以及远期预后,但仍不清楚脓毒症患者免疫治疗的时机以及获益/风险比。脓毒症免疫治疗成功的关键是确定哪些患者可能受益于哪种免疫治疗, 并制定相应个体化的免疫治疗策略。 借助个性化的生物标志物以指导和监测对脓毒症的疗效,这将是未来的重大挑战;因此,需根据个体的免疫状态进行分层,达到有效识别和精准干预,制定目标导向的个性化脓毒症免疫治疗方案以达到最佳的临床疗效, 将使免疫治疗在未来有望成为一种有前景的治疗策略。
利益冲突所有作者均声明不存在利益冲突
